Kiến thức về quặng pirit sắt có công thức FeS2 và ứng dụng trong công nghiệp
Quặng pirit sắt có công thức là FeS2 – khoáng chất phổ biến trong tự nhiên. Pirit sắt mang ánh kim vàng óng ánh đặc trưng. Khoáng vật này đóng vai trò quan trọng trong sản xuất axit sunfuric và luyện kim. Các phương pháp khai thác, tuyển quặng pirit sắt ngày càng hiện đại.
Quặng pirit sắt có công thức là FeS2
Pirit sắt là một loại quặng phổ biến trong tự nhiên. Quặng pirit sắt có công thức là FeS2, được biết đến với tên gọi “vàng của kẻ ngốc” do có màu vàng óng ánh.

Trong công thức FeS2:
- Fe: Nguyên tố sắt
- S: Nguyên tố lưu huỳnh
- Chỉ số 2: Cho biết trong phân tử có 2 nguyên tử lưu huỳnh
Pirit sắt có cấu trúc tinh thể lập phương đặc trưng. Các nguyên tử sắt nằm ở tâm khối lập phương, còn các nguyên tử lưu huỳnh xếp thành cặp tại các đỉnh.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách liên tưởng: “Fe đứng một mình còn S phải đi cặp”. Cách này giúp các em dễ dàng phân biệt với các sulfua sắt khác như FeS.
Quặng pirit sắt là nguồn nguyên liệu quan trọng trong công nghiệp. Nó được sử dụng để sản xuất axit sulfuric và thu hồi sắt kim loại qua các phản ứng hóa học phù hợp.
Cấu tạo và đặc điểm của quặng pirit sắt trong tự nhiên
Quặng pirit sắt trong tự nhiên có công thức hóa học là FeS2, được biết đến với tên gọi “vàng của kẻ ngốc”. Đây là một trong những khoáng vật sulfua phổ biến nhất trên Trái đất.
Cấu trúc tinh thể của quặng pirit
Pirit có cấu trúc tinh thể lập phương với các nguyên tử sắt nằm ở các đỉnh và tâm mặt. Các nguyên tử lưu huỳnh tạo thành cặp S2 nằm dọc theo đường chéo của tinh thể.
Mỗi nguyên tử sắt trong tinh thể được bao quanh bởi 6 nguyên tử lưu huỳnh, tạo thành cấu trúc bát diện FeS6. Liên kết giữa Fe-S mang tính chất cộng hóa trị và ion.
Thành phần hóa học và tính chất vật lý
Cấu tạo quặng pirit bao gồm 46.55% Fe và 53.45% S theo tỷ lệ khối lượng. Khoáng vật có màu vàng đồng với ánh kim loại đặc trưng.

Pirit có độ cứng cao (6-6.5 trên thang Mohs) và tỷ trọng 5.0-5.2 g/cm3. Khi bị oxy hóa, pirit tạo thành oxit sắt và axit sulfuric.
Đặc biệt, pirit thường chứa các nguyên tố vết như Au, As, Cu, Zn có giá trị kinh tế trong khai thác.
Sự hình thành quặng pirit trong tự nhiên
Pirit được hình thành trong nhiều môi trường địa chất khác nhau. Quá trình tạo khoáng chủ yếu diễn ra trong điều kiện nhiệt độ và áp suất cao.
Trong môi trường magma, pirit kết tinh từ dung thể sulfua giàu sắt. Ở môi trường trầm tích, vi khuẩn khử sulfat đóng vai trò quan trọng trong việc tạo ra pirit.
Theo nghiên cứu của Viện Địa chất và Khoáng sản Việt Nam, các mỏ pirit lớn thường hình thành ở vùng biến chất nhiệt dịch, nơi dung dịch nóng giàu sắt và lưu huỳnh thấm qua đá.
Tính chất hóa học và phản ứng đặc trưng của FeS2
Quặng pirit là một khoáng chất phổ biến trong tự nhiên. FeS2 là hợp chất vô cơ có màu vàng đồng, thường được gọi là “vàng của kẻ ngốc” do màu sắc đặc trưng của nó.
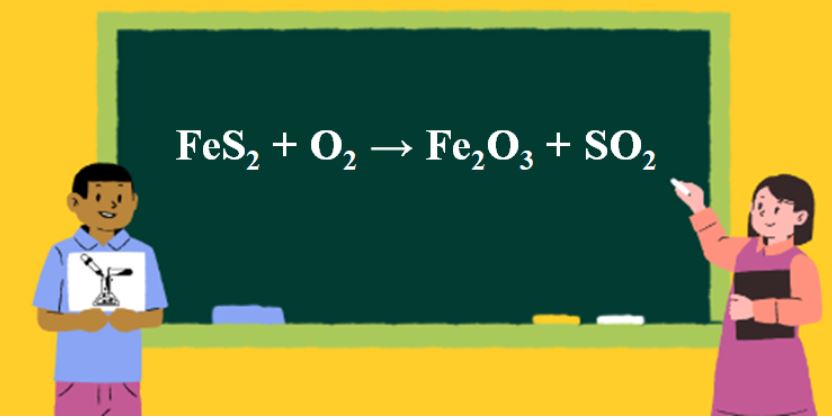
Pirit có cấu trúc tinh thể lập phương, trong đó ion Fe2+ được bao quanh bởi 6 ion S2-. Đây là một sulfua kim loại bền vững ở nhiệt độ thường.
Tôi sẽ phân tích chi tiết các phản ứng hóa học quan trọng của FeS2 để các em dễ nắm bắt và vận dụng.
Phản ứng oxi hóa – khử
Pirit dễ dàng bị oxi hóa khi tiếp xúc với không khí ẩm và oxi:
4FeS2 + 15O2 + 2H2O → 2Fe2(SO4)3 + 2H2SO4
Phản ứng này tạo ra axit sulfuric và sắt(III) sulfat. Đây là nguyên nhân gây ô nhiễm nước thải mỏ.
Trong môi trường kiềm, pirit bị oxi hóa theo phương trình:
2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4
Phản ứng với axit và bazơ
Pirit không tan trong axit HCl và H2SO4 loãng ở nhiệt độ thường.
Với axit HNO3 đặc nóng, phản ứng xảy ra mạnh:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
Trong dung dịch bazơ mạnh như NaOH đặc, FeS2 bị phân hủy chậm tạo thành Fe(OH)3 và Na2S.
Sự phân hủy nhiệt
Khi nung nóng trong điều kiện không có không khí, FeS2 bị phân hủy:
FeS2 → FeS + S
Phản ứng này xảy ra ở nhiệt độ khoảng 600°C. Lưu huỳnh nguyên tố bay hơi và có thể thu hồi được.
Trong không khí, sự phân hủy phức tạp hơn do có thêm phản ứng oxi hóa:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
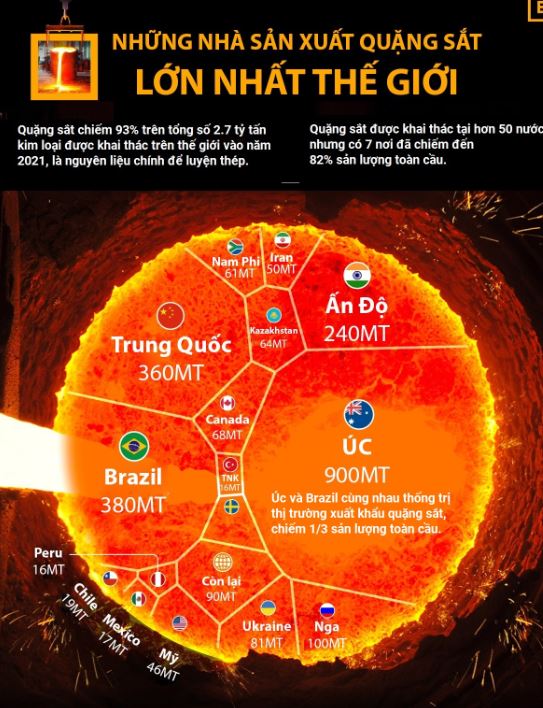
Phân bố và khai thác quặng pirit sắt trên thế giới
Quặng pirit sắt phân bố rộng rãi ở nhiều khu vực trên thế giới, đặc biệt tập trung tại các vùng có hoạt động địa chất mạnh. Các mỏ lớn được tìm thấy ở Bắc Mỹ, Nam Mỹ, châu Âu và châu Á.
Việc khai thác quặng pirit đóng vai trò quan trọng trong ngành công nghiệp hóa chất và luyện kim. Quặng pirit sắt cung cấp nguyên liệu cho sản xuất axit sulfuric và thu hồi các kim loại quý đi kèm.
Các mỏ quặng pirit sắt lớn
Mỏ Rio Tinto ở Tây Ban Nha là một trong những mỏ pirit sắt lớn nhất thế giới với trữ lượng ước tính trên 350 triệu tấn. Mỏ này đã hoạt động từ thời La Mã cổ đại.
Khu vực Ural của Nga cũng sở hữu nhiều mỏ pirit sắt quy mô lớn như Gaysky và Sibay. Các mỏ này không chỉ cung cấp pirit mà còn chứa đồng, kẽm và các kim loại quý khác.
Phương pháp khai thác và tuyển quặng
Khai thác pirit sắt thường được thực hiện bằng phương pháp lộ thiên hoặc hầm lò tùy theo điều kiện địa chất. Công nghệ khoan nổ mìn được áp dụng phổ biến để phá vỡ đá.
Quá trình tuyển quặng bao gồm nghiền, phân loại và tuyển nổi. Các thiết bị hiện đại như máy nghiền bi, máy tuyển từ và máy tuyển nổi được sử dụng để nâng cao hiệu quả.
Công nghệ tuyển quặng tiên tiến giúp thu hồi tối đa khoáng sản có ích và giảm thiểu tác động môi trường. Nước thải được xử lý và tái sử dụng trong quy trình khép kín.
Trữ lượng và sản lượng khai thác
Trữ lượng pirit sắt toàn cầu ước tính khoảng 2 tỷ tấn, trong đó châu Âu chiếm 40%. Các nước có trữ lượng lớn gồm Tây Ban Nha, Nga, Peru và Trung Quốc.
Sản lượng khai thác hàng năm đạt khoảng 50 triệu tấn, chủ yếu phục vụ sản xuất axit sulfuric. Nhu cầu thị trường tăng đều qua các năm do phát triển công nghiệp hóa chất.
Việc quản lý và sử dụng hợp lý nguồn tài nguyên pirit sắt đóng vai trò quan trọng trong phát triển bền vững ngành khai khoáng. Các quốc gia đang tăng cường áp dụng công nghệ xanh trong khai thác.
Ứng dụng của quặng pirit sắt trong công nghiệp
Quặng pirit sắt có công thức là FeS2 được ứng dụng rộng rãi trong nhiều ngành công nghiệp khác nhau. Loại khoáng chất này đóng vai trò quan trọng trong sản xuất hóa chất và luyện kim. Tôi sẽ phân tích chi tiết từng ứng dụng chính của nó.
Sản xuất axit sunfuric
Pirit sắt là nguyên liệu quan trọng trong sản xuất axit sunfuric công nghiệp. Quá trình này diễn ra qua hai giai đoạn chính:

Giai đoạn 1: Nung pirit ở nhiệt độ cao để tạo SO2
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Giai đoạn 2: Chuyển hóa SO2 thành H2SO4 qua xúc tác V2O5
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
Luyện kim và sản xuất sắt
Quặng pirit sắt ứng dụng trong luyện kim đen để sản xuất gang thép. Quá trình này tận dụng hàm lượng sắt cao trong pirit, tương tự như cách tính hàm lượng photphorit.
Khi nung nóng, pirit phân hủy thành Fe2O3 – nguyên liệu cho quá trình khử để tạo sắt kim loại. Phần lưu huỳnh được thu hồi dưới dạng SO2 để sản xuất axit sunfuric.
Các ứng dụng khác
Pirit sắt còn được sử dụng làm chất xúc tác trong một số phản ứng hóa học công nghiệp. Nó cũng là nguồn cung cấp lưu huỳnh quan trọng cho ngành công nghiệp hóa chất.
Trong công nghiệp sản xuất phân bón, pirit được dùng để điều chế các hợp chất lưu huỳnh. Các tinh thể pirit còn được ứng dụng trong chế tác đồ trang sức do có ánh kim đặc trưng.
FAQ: Câu hỏi thường gặp về quặng pirit sắt
Pirit là một trong những khoáng vật phổ biến trong tự nhiên. Dưới đây là một số câu hỏi thường gặp về loại quặng này.
Làm thế nào để nhận biết quặng pirit sắt?
Quặng pirit sắt là gì và cách nhận biết nó khá đơn giản qua các đặc điểm vật lý. Pirit có màu vàng đồng đặc trưng, ánh kim loại sáng bóng rất đẹp mắt.
Khi cọ xát với vật cứng, pirit để lại vệt màu đen xanh. Đặc biệt, quặng pirit có công thức là FeS2 với cấu trúc tinh thể lập phương hoặc hình bát diện.
Một cách nhận biết khác là dùng nam châm – pirit không bị hút bởi nam châm do không có từ tính. Điều này giúp phân biệt với các khoáng vật sắt khác.
Tại sao quặng pirit còn được gọi là vàng của kẻ nghèo?
Do màu sắc vàng óng ánh của pirit khá giống vàng tự nhiên nên nhiều người nhầm lẫn. Công thức quặng pirit cho thấy đây chỉ là hợp chất của sắt và lưu huỳnh.
Trong lịch sử, đã có nhiều thợ mỏ nghèo đào được pirit tưởng là vàng thật. Khi biết sự thật, họ rất thất vọng nên gọi là “vàng của kẻ nghèo”.
Tuy nhiên, pirit vẫn có giá trị công nghiệp quan trọng. Nó được dùng làm nguyên liệu sản xuất axit sulfuric và thu hồi lưu huỳnh.
Quặng pirit sắt có độc hại không?
Bản thân pirit không độc hại khi tiếp xúc trực tiếp. Tuy nhiên, khi bị phong hóa, nó tạo ra axit sulfuric có thể gây ô nhiễm môi trường.
Bụi pirit mịn có thể gây kích ứng đường hô hấp nếu hít phải. Vì vậy cần đeo khẩu trang, găng tay khi tiếp xúc với quặng dạng bột.
Khi khai thác và chế biến pirit cần tuân thủ quy trình an toàn, tránh tác động xấu đến sức khỏe và môi trường.
Trong tự nhiên, quặng pirit sắt có công thức là FeS2 đóng vai trò quan trọng trong ngành công nghiệp hóa chất và luyện kim. Khoáng vật này không chỉ là nguồn nguyên liệu chính để sản xuất axit sunfuric mà còn được ứng dụng trong nhiều lĩnh vực khác. Việc nắm vững cấu tạo, tính chất và phương pháp khai thác quặng pirit sắt giúp tối ưu hóa quá trình sử dụng khoáng sản này trong thực tế.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

