Hiểu rõ olefin công thức và tính chất trong hóa học hữu cơ
Olefin công thức là nền tảng quan trọng trong hóa học hữu cơ. Các phản ứng đặc trưng của olefin tạo nên nhiều hợp chất hữu ích. Bài viết phân tích chi tiết cấu tạo, tính chất và ứng dụng của olefin trong thực tế. Các ví dụ minh họa giúp học sinh dễ dàng nắm vững kiến thức cơ bản.
Olefin công thức và cấu tạo đặc trưng
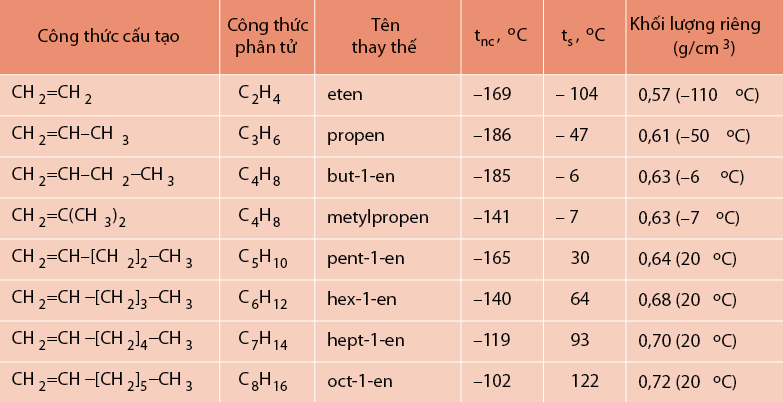
Olefin là nhóm hydrocarbon không no chứa liên kết đôi C=C. Olefin công thức tổng quát là CnH2n, với n ≥ 2.

Các olefin thường gặp nhất là ethylene (C2H4) và propylene (C3H6). Chúng là những hợp chất quan trọng trong công nghiệp hóa dầu.
Olefin cấu tạo đặc trưng bởi liên kết đôi C=C. Liên kết này tạo ra tính chất hoạt động cao của olefin.
Cấu tạo phân tử olefin có 2 dạng chính:
- Dạng thẳng: Các nguyên tử carbon xếp thành chuỗi thẳng
- Dạng nhánh: Có nhánh carbon bám vào mạch chính
Trong quá trình giảng dạy, tôi thường ví von liên kết đôi C=C như “chiếc cầu nối” giữa các nguyên tử carbon. Điều này giúp học sinh dễ hình dung và nhớ lâu hơn.
Một điểm quan trọng về cấu tạo olefin là vị trí liên kết đôi. Nó quyết định tính chất và phản ứng của olefin.
Ví dụ: But-1-ene (CH3-CH2-CH=CH2) và but-2-ene (CH3-CH=CH-CH3) có cùng công thức phân tử nhưng khác nhau về vị trí liên kết đôi.
Kinh nghiệm của tôi cho thấy việc vẽ công thức cấu tạo olefin theo hình “ziczac” sẽ giúp học sinh hiểu rõ hơn về góc liên kết.
Cách viết công thức phân tử và cấu tạo của olefin
Olefin là nhóm hydrocarbon không no chứa liên kết đôi C=C. Cách viết công thức olefin cần tuân theo các quy tắc cụ thể về cấu trúc phân tử và liên kết hóa học.
Quy tắc viết công thức phân tử olefin
Công thức olefin là gì? Olefin có công thức tổng quát CnH2n, trong đó n là số nguyên ≥ 2. Công thức này phản ánh đặc điểm cấu trúc đặc trưng của olefin.
Khi viết công thức phân tử, cần xác định số nguyên tử carbon (n) trước. Sau đó nhân đôi số carbon để có số nguyên tử hydro. Ví dụ với n=2, ta có C2H4 (ethylene).
Một số olefin có thể tạo thành dẫn xuất khi phản ứng với oleum công thức, tạo ra các sản phẩm quan trọng trong công nghiệp hóa chất.
Cách xác định công thức cấu tạo olefin
Công thức cấu tạo olefin thể hiện vị trí liên kết đôi C=C và cách sắp xếp các nguyên tử trong phân tử. Mạch carbon có thể thẳng hoặc phân nhánh.
Khi viết công thức cấu tạo, cần đặt liên kết đôi C=C vào vị trí ưu tiên có số thứ tự nhỏ nhất. Các nhánh alkyl được sắp xếp theo thứ tự alphabet.
Trong quá trình giảng dạy, tôi thường hướng dẫn học sinh vẽ khung carbon trước, sau đó điền hydro và các nhánh phụ để tránh nhầm lẫn.
Các dạng đồng phân của olefin
Olefin có thể tồn tại dưới nhiều dạng đồng phân khác nhau. Đồng phân cấu trúc bao gồm đồng phân mạch carbon và đồng phân vị trí liên kết đôi.
Đồng phân hình học cis-trans xuất hiện khi hai nhóm thế khác nhau gắn vào hai carbon của liên kết đôi. Cấu hình cis có hai nhóm cùng phía, trans có hai nhóm đối diện.
Việc xác định đúng dạng đồng phân rất quan trọng vì mỗi đồng phân có tính chất vật lý và hóa học khác nhau. Điều này ảnh hưởng trực tiếp đến phản ứng và ứng dụng của chúng.
Phân loại và tính chất hóa học của olefin
Olefin là nhóm hydrocarbon không no chứa liên kết đôi C=C. Các hợp chất này có vai trò quan trọng trong công nghiệp hóa dầu và tổng hợp hữu cơ.
Trong quá trình giảng dạy, tôi thường ví von olefin như những mắt xích có thể kết nối với nhau. Điều này giúp học sinh dễ hình dung về phân loại olefin và phản ứng của chúng.
Các nhóm olefin chính
Olefin được chia thành 3 nhóm chính dựa vào cấu trúc phân tử:
Olefin mạch thẳng như ethene (C2H4) và propene (C3H6) là những hợp chất đơn giản nhất. Chúng thường được sử dụng làm nguyên liệu sản xuất polymer.
Olefin mạch nhánh như 2-methylpropene có cấu trúc phức tạp hơn. Nhóm này thường có nhiệt độ sôi cao hơn olefin mạch thẳng cùng số carbon.
Tính chất vật lý của olefin
Các olefin có khối lượng phân tử thấp (C2-C4) tồn tại ở dạng khí trong điều kiện thường. Điều này khiến việc thu gom và bảo quản chúng khá khó khăn.
Olefin có khối lượng phân tử cao hơn (từ C5) tồn tại ở dạng lỏng hoặc rắn. Tính chất olefin này phụ thuộc vào độ dài mạch carbon và mức độ phân nhánh.
Phản ứng cộng của olefin
Liên kết đôi C=C trong olefin rất hoạt động và dễ tham gia phản ứng cộng. Đây là đặc trưng quan trọng nhất của nhóm hợp chất này.
Phản ứng cộng hydro halogen (HX) vào olefin tuân theo quy tắc Markovnikov. Tôi thường nhắc học sinh: “Hydro luôn thích gắn vào carbon có nhiều hydro hơn”.
Phản ứng trùng hợp olefin
Phản ứng olefin điển hình là trùng hợp tạo polymer. Ethene trùng hợp tạo polyethylene (PE) – nhựa được sử dụng rộng rãi.
Quá trình này đòi hỏi xúc tác và điều kiện phản ứng phù hợp. Tôi thường so sánh nó như việc xếp các viên gạch thành bức tường vững chắc.
Các polymer từ olefin có tính chất đa dạng, từ mềm dẻo đến cứng chắc. Điều này phụ thuộc vào cấu trúc của monomer ban đầu và điều kiện trùng hợp.
Phương pháp tổng hợp và ứng dụng của olefin
Olefin tổng hợp là nhóm hydrocacbon không no quan trọng trong công nghiệp hóa dầu. Chúng có cấu tạo đặc trưng với liên kết đôi C=C và công thức tổng quát CnH2n. Các phân tử olefin có khả năng phản ứng cao nhờ liên kết đôi này.
Các phương pháp điều chế olefin
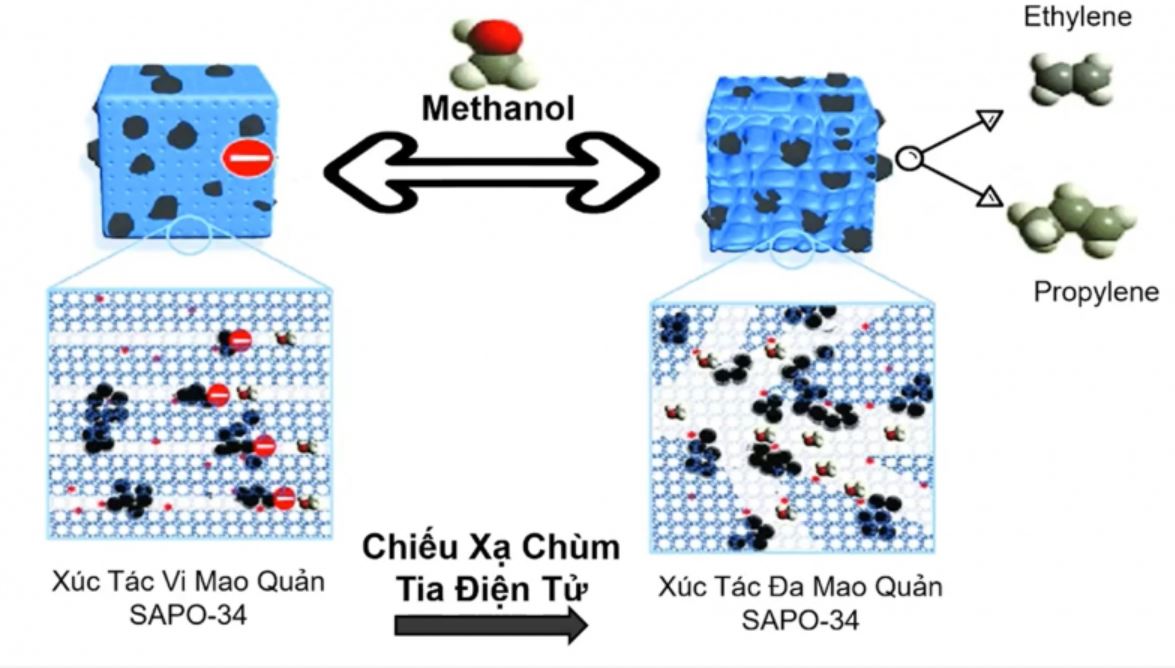
Phương pháp cracking nhiệt là cách điều chế olefin trong hóa học phổ biến nhất. Quá trình này đòi hỏi nhiệt độ cao 800-900°C để phân hủy các hydrocacbon no thành olefin ngắn mạch hơn.
Dehydro hóa ancol cũng là phương pháp quan trọng. Khi đun nóng ancol với xúc tác H2SO4 đặc ở 170-180°C sẽ tạo thành olefin tương ứng và nước.
Phản ứng khử halogen từ dẫn xuất dihalogen cũng tạo ra olefin. Quá trình này thường dùng kẽm kim loại làm tác nhân khử trong môi trường methanol.
Ứng dụng olefin trong công nghiệp
Olefin hóa học hữu cơ đóng vai trò then chốt trong sản xuất polymer. Ethylene được polymer hóa thành polyethylene dùng làm túi nilon, chai nhựa và vật liệu đóng gói.
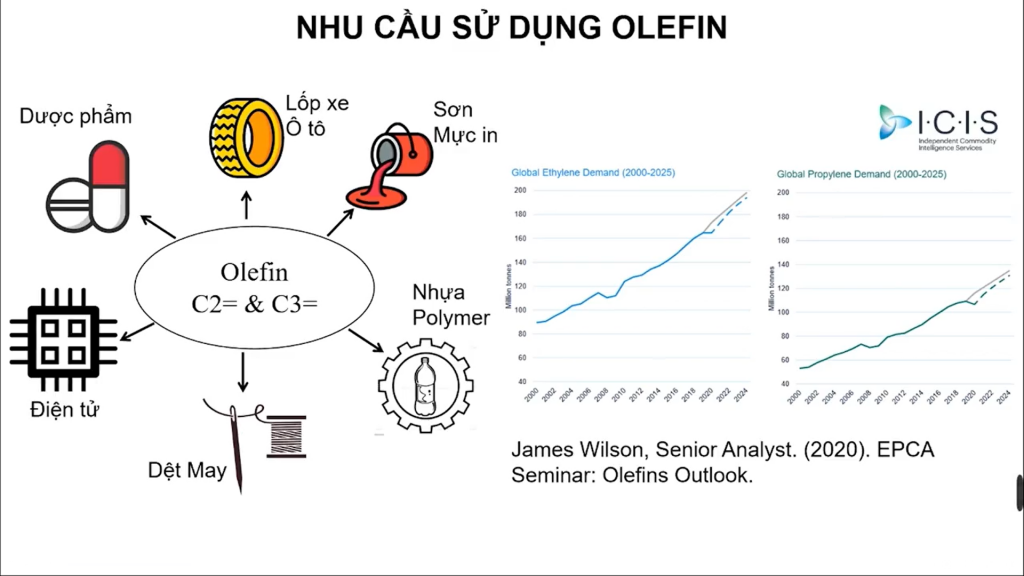
Propylene là nguyên liệu chính sản xuất polypropylene. Vật liệu này được ứng dụng rộng rãi trong công nghiệp ô tô, dệt may và đồ gia dụng.
Các olefin còn là nguyên liệu quan trọng trong tổng hợp hóa chất. Chúng tham gia phản ứng cộng để tạo ra nhiều hợp chất hữu cơ có giá trị.
Ứng dụng olefin trong đời sống
Các sản phẩm từ olefin xuất hiện khắp nơi trong cuộc sống. Từ chai nước, túi đựng thực phẩm đến quần áo, đồ chơi trẻ em đều chứa polymer olefin.
Trong y tế, olefin được dùng làm nguyên liệu sản xuất thuốc và thiết bị y tế. Các ống truyền dịch, găng tay y tế thường được làm từ polymer olefin.
Olefin còn góp phần tạo ra các chất tẩy rửa, mỹ phẩm và phụ gia thực phẩm. Điều này cho thấy tầm quan trọng của chúng trong đời sống hàng ngày.
FAQ: Câu hỏi thường gặp về olefin
Các câu hỏi thường gặp về olefin giúp học sinh hiểu rõ hơn về đặc điểm và tính chất của nhóm chất này. Tôi sẽ giải đáp chi tiết từng câu hỏi dựa trên kinh nghiệm giảng dạy nhiều năm.
Sự khác biệt giữa olefin và alkene?
Olefin và alkene thực chất là cùng một nhóm chất. Olefin là tên gọi thương mại phổ biến trong công nghiệp, còn alkene là tên gọi khoa học.
Cả hai đều chỉ các hydrocarbon không no có chứa liên kết đôi C=C. Chúng có công thức tổng quát CnH2n.
Trong giảng dạy, tôi thường ví von olefin như “biệt danh” của alkene trong ngành công nghiệp hóa dầu.
Tại sao olefin lại có hoạt tính cao?
Hoạt tính cao của olefin xuất phát từ cấu trúc phân tử đặc biệt. Liên kết π trong liên kết đôi C=C rất dễ bị phá vỡ.
Điều này khiến olefin dễ dàng tham gia các phản ứng cộng, trùng hợp và oxi hóa. Tôi hay ví liên kết π như “cánh cửa mở” cho các phản ứng hóa học.
Đây cũng là lý do olefin được sử dụng rộng rãi làm nguyên liệu trong công nghiệp tổng hợp hữu cơ.
Cách nhận biết olefin trong phòng thí nghiệm?
Phương pháp đơn giản nhất là dùng dung dịch brom màu nâu đỏ. Olefin làm mất màu dung dịch brom.
Một cách khác là dùng dung dịch KMnO4 loãng màu tím. Olefin khử KMnO4 thành MnO2 màu nâu.
Trong quá trình giảng dạy, tôi luôn nhấn mạnh với học sinh cần quan sát kỹ sự thay đổi màu sắc. Đây là dấu hiệu nhận biết chính xác nhất.
Kiến thức về olefin công thức là nền tảng quan trọng trong hóa học hữu cơ. Olefin có cấu tạo đặc trưng với liên kết đôi C=C và công thức tổng quát CnH2n. Các phản ứng cộng và trùng hợp của olefin tạo nên nhiều sản phẩm có giá trị trong công nghiệp như nhựa, cao su tổng hợp. Việc nắm vững cấu tạo và tính chất của olefin giúp ứng dụng hiệu quả trong sản xuất và đời sống.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

