Hiểu rõ natri đihiđrophotphat công thức và ứng dụng trong đời sống
Natri đihiđrophotphat công thức Na2HPO4 là muối vô cơ quan trọng trong công nghiệp. Hợp chất này có cấu tạo đặc biệt với 2 ion Na+ và ion HPO42-. Các tính chất lý hóa độc đáo giúp nó trở thành nguyên liệu thiết yếu trong sản xuất thực phẩm và dược phẩm.
Natri đihiđrophotphat công thức
Natri đihiđrophotphat có công thức hóa học là NaH2PO4. Đây là một muối axit được tạo thành từ phản ứng giữa natri hiđroxit và axit photphoric.
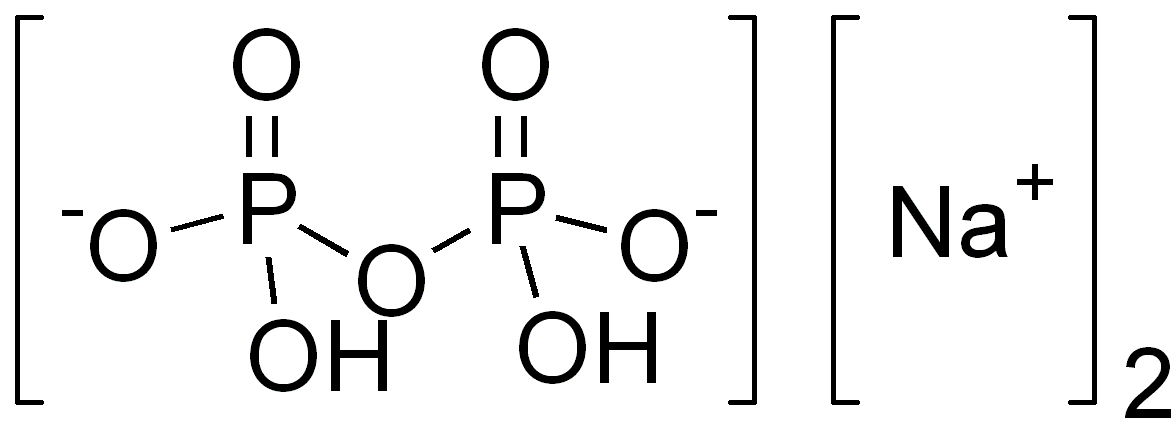
Công thức cấu tạo của natri đihiđrophotphat công thức có thể được viết chi tiết như sau:
Na+ + H2PO4-
Trong đó:
- Na+: Ion natri mang điện tích dương
- H2PO4-: Ion đihiđrophotphat mang điện tích âm
Khi hòa tan trong nước, muối này sẽ điện li theo phương trình:
NaH2PO4 → Na+ + H2PO4-
Tôi thường giải thích cho học sinh hiểu đơn giản rằng đây giống như một “gia đình” gồm “bố Na+” và “con H2PO4-“. Khi gặp nước, họ tách ra nhưng vẫn giữ nguyên bản chất.
Một số tính chất quan trọng của muối này:
- Là chất rắn màu trắng
- Tan tốt trong nước
- Có tính axit yếu
- pH dung dịch < 7
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng tạo muối này bằng cách cho từ từ dung dịch NaOH vào dung dịch H3PO4 đậm đặc.
Cấu tạo và tính chất của Na2HPO4
Na2HPO4 là muối natri hiđrophotphat, một hợp chất vô cơ quan trọng trong công nghiệp và đời sống. Tôi sẽ phân tích chi tiết về cấu tạo và các tính chất đặc trưng của hợp chất này.
Cấu tạo phân tử Na2HPO4
Na2HPO4 tính chất được quyết định bởi cấu trúc phân tử độc đáo của nó. Trong phân tử có 2 ion Na+ và 1 ion HPO42-. Ion HPO42- có cấu trúc tứ diện với nguyên tử photpho ở tâm.
Theo kinh nghiệm giảng dạy của tôi, học sinh thường nhớ cấu trúc này bằng cách hình dung một chiếc ô có 4 cạnh. Nguyên tử P nằm ở tâm và 4 nguyên tử O ở 4 đỉnh.
Tính chất vật lý của Na2HPO4
Natri đihiđrophotphat cấu tạo dạng tinh thể màu trắng, không mùi. Chất này tan tốt trong nước nhưng không tan trong cồn.
Ở nhiệt độ phòng, Na2HPO4 tồn tại dưới dạng tinh thể ngậm 12 phân tử nước. Khi nung nóng đến 48°C, số phân tử nước giảm xuống còn 7.
Tính chất hóa học đặc trưng
Natri đihiđrophotphat hóa trị thể hiện qua các phản ứng đặc trưng. Khi tác dụng với natri hiđroxit có công thức hóa học là, nó tạo thành muối Na3PO4.
Na2HPO4 có tính bazơ yếu do ion HPO42- có khả năng nhận proton H+. Trong dung dịch nước, nó tạo môi trường kiềm nhẹ với pH khoảng 9.
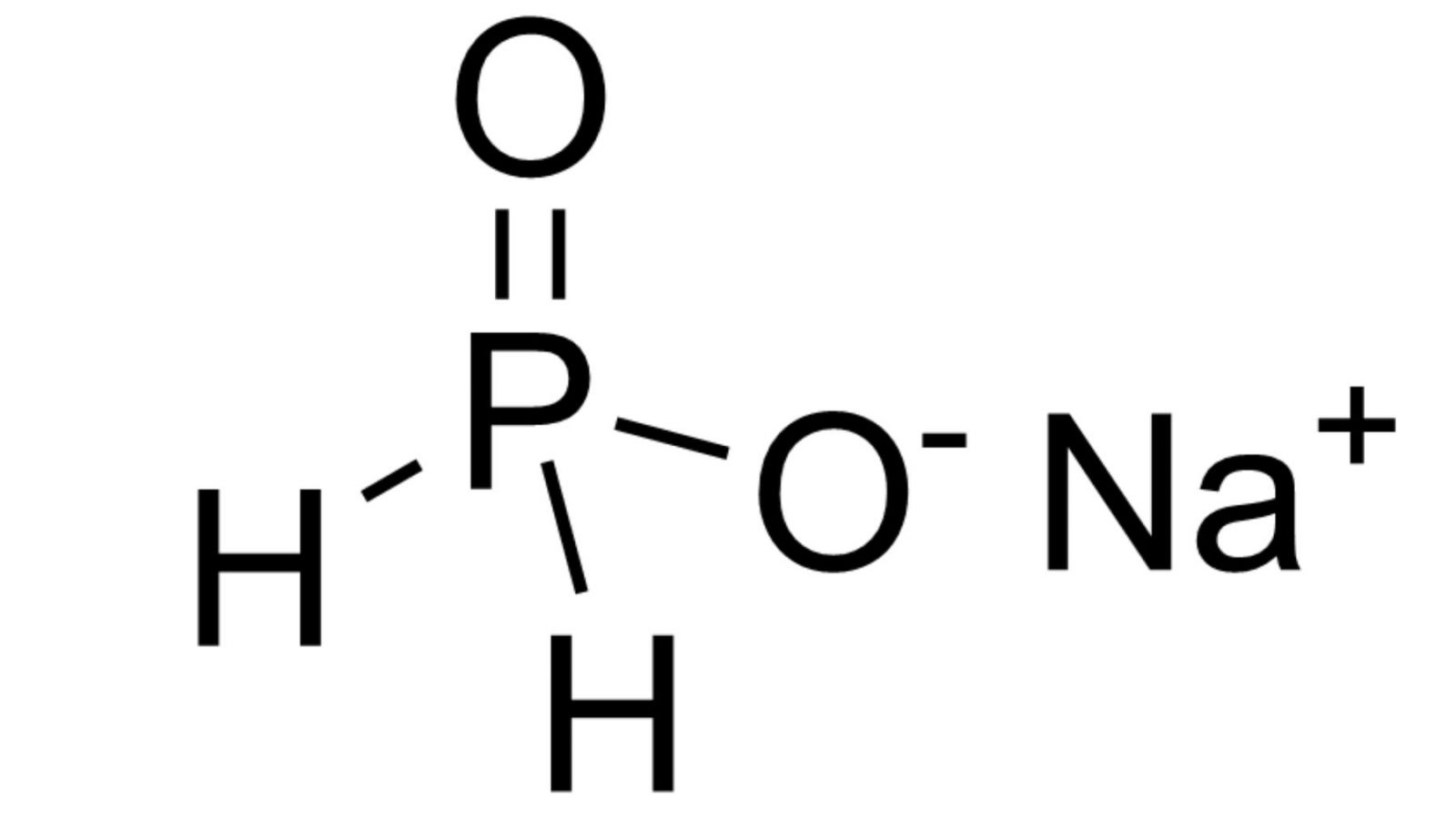
Trong phòng thí nghiệm, tôi thường dùng Na2HPO4 làm dung dịch đệm photphat. Nó giúp duy trì pH ổn định khi thêm axit hoặc bazơ.
Phương pháp điều chế Na2HPO4 trong phòng thí nghiệm và công nghiệp
Natri hiđrophotphat là một muối vô cơ quan trọng, được sử dụng rộng rãi trong công nghiệp và đời sống. Việc điều chế Na2HPO4 cần tuân thủ quy trình chặt chẽ để đảm bảo hiệu suất và độ tinh khiết.
Trong công nghiệp, quá trình điều chế thường được thực hiện qua phản ứng trung hòa giữa axit photphoric và natri cacbonat. Phương pháp này cho phép sản xuất với quy mô lớn và chi phí hợp lý.
Với kinh nghiệm 20 năm giảng dạy, tôi nhận thấy việc nắm vững các phản ứng natri đihiđrophotphat giúp học sinh hiểu sâu hơn về bản chất của quá trình điều chế.
Các phương trình phản ứng điều chế
Phương trình phản ứng chính trong điều chế Na2HPO4:
H3PO4 + 2NaOH → Na2HPO4 + 2H2O
Phản ứng này diễn ra ở nhiệt độ phòng, tạo ra muối Na2HPO4 và nước. Hiệu suất phản ứng có thể đạt tới 95% trong điều kiện tối ưu.
Ngoài ra còn có phương pháp điều chế từ công thức supephotphat kép thông qua phản ứng:
Ca(H2PO4)2 + 2Na2CO3 → Na2HPO4 + CaCO3 + CO2 + H2O
Quy trình thực hiện
Quy trình điều chế Na2HPO4 trong phòng thí nghiệm gồm các bước:
Bước 1: Chuẩn bị dung dịch H3PO4 85% và dung dịch NaOH 2M.
Bước 2: Cho từ từ dung dịch NaOH vào H3PO4 trong điều kiện khuấy đều.
Bước 3: Kiểm tra pH dung dịch đạt 8,5-9,0.
Bước 4: Lọc, kết tinh và sấy khô sản phẩm ở 60°C.
Một lưu ý quan trọng là cần kiểm soát chặt chẽ nhiệt độ và pH trong suốt quá trình phản ứng để thu được sản phẩm tinh khiết nhất.
Ứng dụng quan trọng của Natri đihiđrophotphat
Na2HPO4 ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp và đời sống. Hợp chất này đóng vai trò thiết yếu nhờ tính chất đệm pH và khả năng tương tác với protein.
Ứng dụng trong công nghiệp thực phẩm
Natri photphat trong thực phẩm có vai trò quan trọng như một chất điều chỉnh độ acid. Tôi thường giải thích cho học sinh rằng nó giống như “người điều phối” giúp thực phẩm luôn giữ được độ pH ổn định.
Trong sản xuất phô mai, Na2HPO4 giúp protein sữa không bị đông tụ quá mức. Điều này tương tự như natri propionat là gì – một chất bảo quản thực phẩm phổ biến khác.
Na2HPO4 còn được sử dụng làm chất nhũ hóa trong các sản phẩm thịt chế biến. Nó giúp giữ nước và tạo độ mềm mịn cho sản phẩm.
Ứng dụng trong y học và dược phẩm
Na2HPO4 là thành phần quan trọng trong dung dịch đệm phosphat sinh lý. Dung dịch này duy trì pH ổn định cho các chế phẩm dược phẩm.

Trong phòng thí nghiệm y học, Na2HPO4 được dùng để điều chế dung dịch đệm. Tôi thường ví von nó như “người bảo vệ” giúp các phản ứng sinh hóa diễn ra ổn định.
Hợp chất này cũng được sử dụng trong sản xuất thuốc viên nén. Nó có tác dụng tương tự như natri oleat công thức – giúp tăng độ tan của thuốc.
Các ứng dụng khác
Trong công nghiệp giặt tẩy, Na2HPO4 là thành phần của bột giặt. Nó có khả năng làm mềm nước và tăng hiệu quả tẩy rửa.
Na2HPO4 còn được dùng trong xử lý nước thải công nghiệp. Hợp chất này giúp kết tủa các ion kim loại nặng độc hại.
Trong nông nghiệp, Na2HPO4 được sử dụng làm phân bón cung cấp photpho. Nó giúp cải thiện năng suất cây trồng một cách hiệu quả.
Độ an toàn và lưu ý khi sử dụng Na2HPO4
Na2HPO4 là một phụ gia thực phẩm được sử dụng phổ biến trong công nghiệp chế biến. Chất này có độc tính thấp khi sử dụng đúng liều lượng cho phép.
Tương tự như Natri panmitat là gì, Na2HPO4 độc tính chỉ xuất hiện khi sử dụng quá liều hoặc lạm dụng trong thời gian dài.
Natri đihiđrophotphat công thức cần được bảo quản trong điều kiện khô ráo, tránh ánh nắng trực tiếp và nhiệt độ cao để đảm bảo chất lượng sử dụng.
Giới hạn cho phép trong thực phẩm
Theo quy định của FDA, giới hạn sử dụng Na2HPO4 trong thực phẩm là 0.5-3% tùy từng loại sản phẩm. Mức này được đánh giá là an toàn cho người tiêu dùng.
Các nhà sản xuất cần tuân thủ nghiêm ngặt định mức này để đảm bảo chất lượng sản phẩm. Việc kiểm soát hàm lượng Na2HPO4 giúp tránh các tác dụng phụ không mong muốn.
Tôi thường khuyên học sinh ghi nhớ con số 3% là ngưỡng tối đa cho phép khi sử dụng Na2HPO4 trong thực phẩm.
Tác động đến sức khỏe

Na2HPO4 có thể gây một số tác dụng phụ nếu sử dụng quá mức cho phép. Các triệu chứng thường gặp bao gồm buồn nôn, đau bụng và tiêu chảy.
Người có vấn đề về thận nên hạn chế sử dụng thực phẩm chứa Na2HPO4. Lượng photphat dư thừa có thể gây áp lực lên chức năng thận.
Qua kinh nghiệm giảng dạy, tôi nhận thấy việc hiểu rõ tác động của Na2HPO4 giúp học sinh có cái nhìn toàn diện về an toàn thực phẩm.
FAQ: Câu hỏi thường gặp về Natri đihiđrophotphat
Natri đihiđrophotphat là một muối vô cơ quan trọng trong công nghiệp và đời sống. Dưới đây là một số câu hỏi thường gặp về hợp chất này.
Sự khác biệt giữa Na2HPO4 và NaH2PO4?
Natri hydrophotphat Na2HPO4 và NaH2PO4 có sự khác biệt cơ bản về cấu trúc và tính chất. Na2HPO4 chứa 2 nguyên tử Na+ và 1 ion HPO42-, trong khi NaH2PO4 chỉ có 1 Na+ và 1 ion H2PO4-.
Điều này dẫn đến sự khác biệt về độ pH khi hòa tan trong nước. Na2HPO4 cho dung dịch kiềm yếu pH khoảng 9, còn NaH2PO4 cho dung dịch axit yếu pH khoảng 4,5.
Natri đihiđrophotphat có thay thế được bằng các muối khác không?
Trong nhiều ứng dụng, muối natri hidrophotphat có công thức là Na2HPO4 có thể thay thế bằng các muối photphat khác như kali photphat K3PO4.
Tuy nhiên cần lưu ý về độ tan và pH của muối thay thế. Ví dụ như xenlulozơ trinitrat công thức không thể thay thế do có tính chất hoàn toàn khác.
Cách bảo quản Na2HPO4 đúng cách?
Na2HPO4 cần được bảo quản trong điều kiện khô ráo, tránh ẩm. Nên đựng trong lọ thủy tinh kín có nắp đậy chặt.
Nhiệt độ bảo quản thích hợp từ 15-25°C. Tránh để muối tiếp xúc trực tiếp với không khí ẩm vì dễ hút ẩm và vón cục.
Thời hạn sử dụng khoảng 2 năm nếu bảo quản đúng cách. Nên kiểm tra định kỳ về độ ẩm và sự vón cục của muối.
Kiến thức về natri đihiđrophotphat công thức giúp người học nắm vững cấu tạo, tính chất và ứng dụng quan trọng của hợp chất này. Na2HPO4 là muối vô cơ phổ biến trong công nghiệp thực phẩm và dược phẩm. Việc tuân thủ giới hạn cho phép và quy trình sử dụng đúng cách đảm bảo an toàn cho người tiêu dùng. Các phương pháp điều chế trong phòng thí nghiệm và công nghiệp tạo nền tảng cho sản xuất muối natri photphat.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

