Hiểu rõ nabica công thức và các phương pháp tính toán hóa học cơ bản
NaBiCa công thức là hợp chất quan trọng trong hóa học. Chất này có cấu tạo đặc biệt với nhiều tính chất nổi bật. Các phương pháp tính toán về mol, nồng độ và pH liên quan đến NaBiCa rất đa dạng. Hợp chất này có nhiều ứng dụng thiết thực trong y học và công nghiệp.
NaBiCa công thức và ứng dụng trong hóa học
NaBiCa là một công thức ghi nhớ quan trọng trong hóa học. Công thức này giúp học sinh dễ dàng nhớ thứ tự hoạt động của kim loại.
NaBiCa được viết tắt từ các nguyên tố:
Na – Natri
Bi – Bismuth
Ca – Canxi
Thứ tự này thể hiện độ hoạt động giảm dần của kim loại trong phản ứng hóa học. Na có độ hoạt động mạnh nhất, tiếp đến là Bi và cuối cùng là Ca.

Tôi thường hướng dẫn học sinh ghi nhớ công thức này qua câu: “Na Bi Ca đi chợ”. Na đi trước, Bi đi giữa và Ca đi sau cùng.
Trong thực tế giảng dạy, công thức này rất hữu ích khi giải các bài tập về phản ứng thế. Ví dụ khi cho Na tác dụng với dung dịch muối BiCl3:
2Na + 2BiCl3 → 2NaCl + 2Bi
Na hoạt động mạnh hơn Bi nên sẽ đẩy được Bi ra khỏi muối của nó. Đây là cách tôi giúp học sinh yếu hóa học hiểu được bản chất của phản ứng thế.
Ngoài ra, công thức này còn giúp dự đoán chiều của phản ứng hóa học. Kim loại có độ hoạt động mạnh hơn sẽ đẩy được kim loại yếu hơn ra khỏi hợp chất.
Cấu tạo và tính chất của thuốc muối NaBiCa
Thuốc muối NaBiCa là một loại muối kép được tổng hợp từ natri, bismuth và canxi. Đây là loại thuốc được sử dụng phổ biến trong điều trị các bệnh về dạ dày và đường tiêu hóa. Tôi sẽ phân tích chi tiết về cấu tạo và tính chất của hợp chất này.
Công thức cấu tạo của NaBiCa
NaBiCa có công thức cấu tạo là:
Na[Bi(Ca)2]
Trong đó:
- Na+ là ion natri mang điện tích dương
- Bi3+ là ion bismuth mang điện tích dương
- Ca2+ là ion canxi mang điện tích dương
Các ion này liên kết với nhau tạo thành cấu trúc phức hợp bền vững. Qua 20 năm giảng dạy, tôi thường ví von cấu trúc này như một “tòa nhà” với Na+ là “mái nhà”, Bi3+ là “cột trụ” và Ca2+ là “nền móng”.

Tính chất vật lý của NaBiCa
NaBiCa tồn tại ở dạng bột màu trắng, mịn và không mùi. Chất này có khả năng tan tốt trong nước ở nhiệt độ phòng, tạo thành dung dịch trong suốt.
Điểm nóng chảy của NaBiCa khoảng 280°C. Ở điều kiện thường, hợp chất này khá ổn định và không bị phân hủy.
Mật độ của NaBiCa là 3,2 g/cm3, cao hơn so với nước. Đây là lý do tại sao khi pha chế, bột thuốc thường lắng xuống đáy cốc nếu không khuấy đều.
Tính chất hóa học của NaBiCa
NaBiCa có tính chất lưỡng tính, có thể phản ứng được với cả axit và bazơ. Trong môi trường axit dạ dày, NaBiCa sẽ phân ly thành các ion:
Na[Bi(Ca)2] → Na+ + Bi3+ + 2Ca2+
Phản ứng này giúp trung hòa axit dạ dày và tạo lớp màng bảo vệ niêm mạc. Trong thực tế giảng dạy, tôi thường cho học sinh làm thí nghiệm nhỏ với dung dịch HCl loãng để minh họa phản ứng này.
Khi tác dụng với bazơ, NaBiCa tạo thành kết tủa bismuth hydroxide:
Na[Bi(Ca)2] + 3OH- → Bi(OH)3↓ + Na+ + 2Ca2+
Các công thức tính toán cơ bản liên quan đến NaBiCa
Trong hóa học, nabica công thức là tập hợp các phương pháp tính toán quan trọng giúp xác định các đại lượng cơ bản. Tôi sẽ giải thích chi tiết từng công thức để các em dễ hiểu và áp dụng.
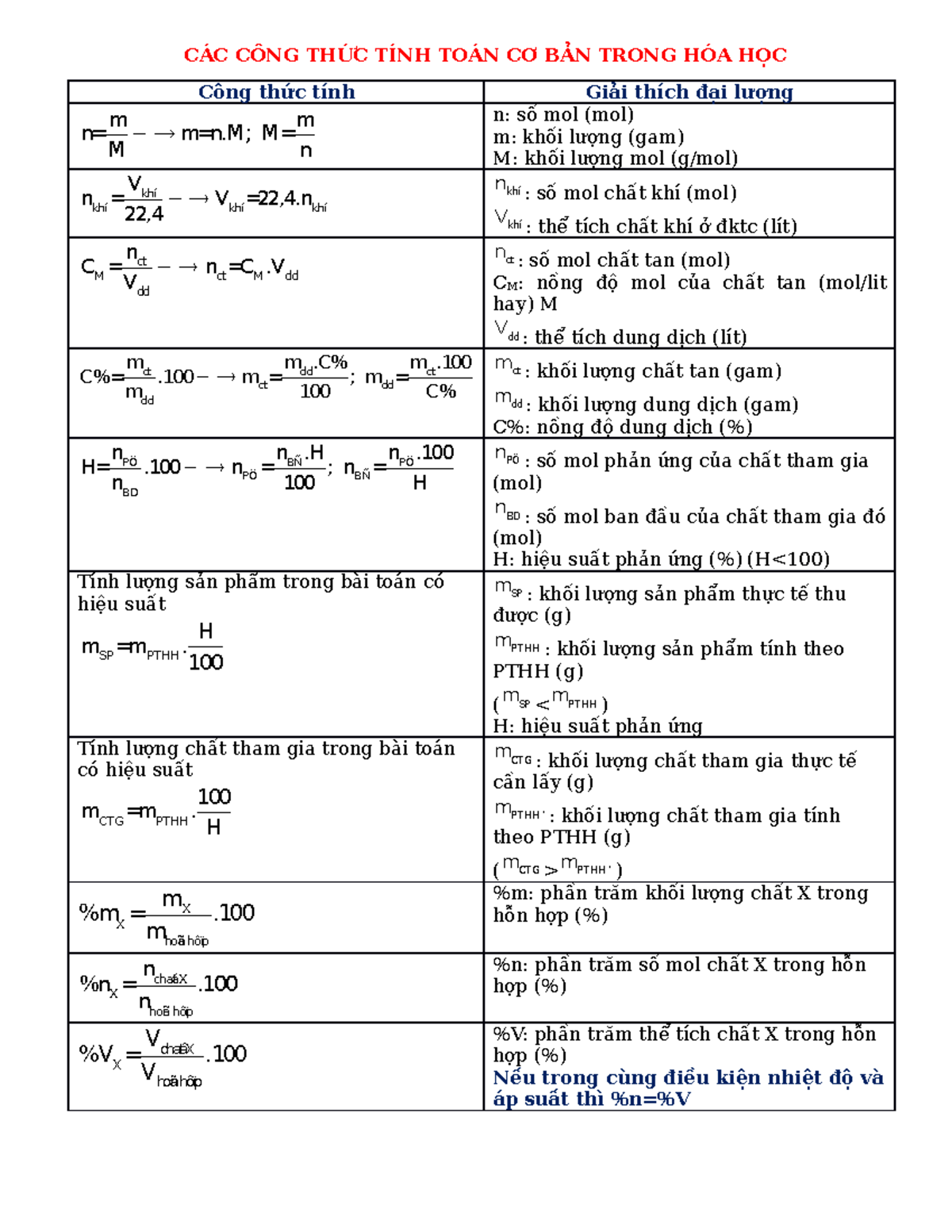
Công thức tính số mol
Công thức tính mol được biểu diễn qua khối lượng và khối lượng mol:
n = m/M
Trong đó:
- n là số mol (mol)
- m là khối lượng chất (g)
- M là khối lượng mol (g/mol)
Khi giảng dạy, tôi thường ví von công thức này như việc đếm số học sinh trong lớp thông qua tổng cân nặng và cân nặng trung bình.
Công thức tính khối lượng mol
Công thức tính khối lượng mol là tổng khối lượng nguyên tử của các nguyên tố:
M = ΣA
A là khối lượng nguyên tử của từng nguyên tố.
Ví dụ với H2O:
M(H2O) = 2 × M(H) + M(O) = 2 × 1 + 16 = 18 g/mol
Công thức tính nồng độ dung dịch
Công thức tính nồng độ mol/lít được xác định:
CM = n/V
Trong đó:
- CM là nồng độ mol/lít (M)
- n là số mol chất tan (mol)
- V là thể tích dung dịch (lít)
Kinh nghiệm của tôi là các em nên quy đổi đơn vị về mol và lít trước khi áp dụng công thức.
Công thức tính nồng độ phần trăm
Công thức tính nồng độ phần trăm thể hiện tỉ lệ khối lượng:
C% = (m1/m2) × 100%
Trong đó:
- C% là nồng độ phần trăm
- m1 là khối lượng chất tan (g)
- m2 là khối lượng dung dịch (g)
Tôi thường gợi ý học sinh hình dung như tỉ lệ điểm số trên thang điểm 100 để dễ nhớ công thức này.
Xác định các đại lượng nguyên tử trong NaBiCa
Để xác định chính xác các đại lượng nguyên tử, chúng ta cần phân tích từng nguyên tố riêng biệt. NaBiCa gồm 3 nguyên tố: Natri (Na), Bismuth (Bi) và Canxi (Ca).
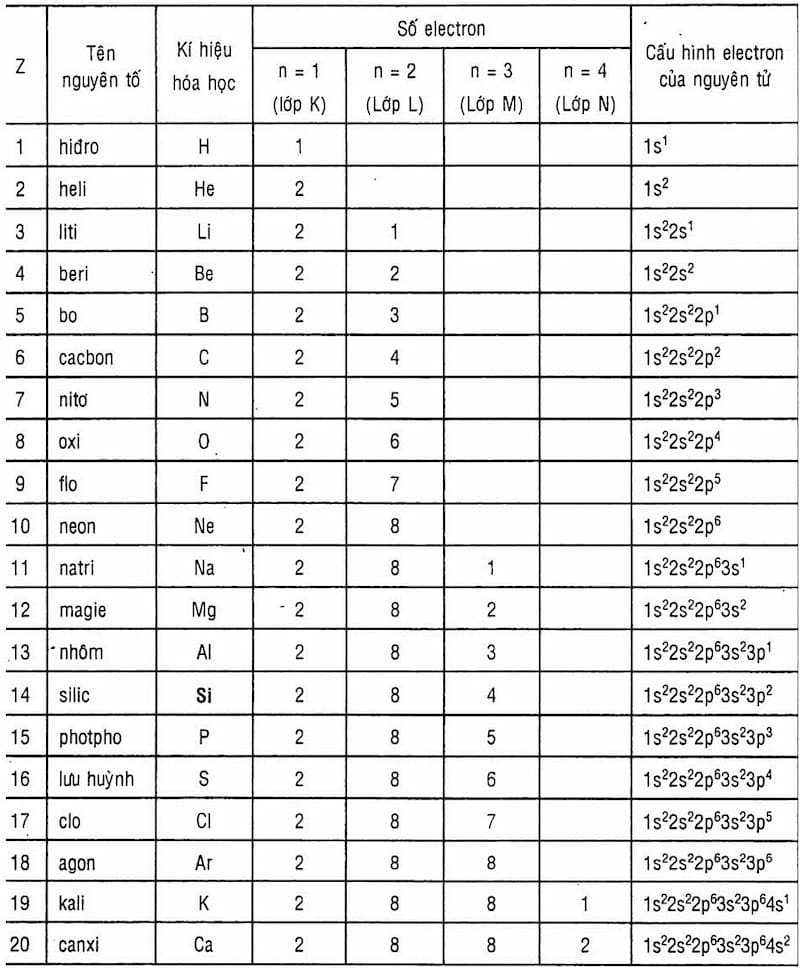
Mỗi nguyên tố có các đặc trưng riêng về số proton, electron và nguyên tử khối. Việc nắm vững công thức tính số proton và các đại lượng khác giúp ta hiểu rõ bản chất của hợp chất.
Cách tính số proton
Số proton của một nguyên tố chính bằng số thứ tự của nó trong bảng tuần hoàn. Đây là đặc trưng quan trọng nhất của nguyên tố.
Trong NaBiCa:
- Na (số thứ tự 11): có 11 proton
- Bi (số thứ tự 83): có 83 proton
- Ca (số thứ tự 20): có 20 proton
Cách tính số electron
Công thức tính electron dựa vào điện tích của ion. Với nguyên tử trung hòa, số electron bằng số proton.
Nếu là ion dương, số electron = số proton – số điện tích dương
Nếu là ion âm, số electron = số proton + số điện tích âm
Cách tính nguyên tử khối
Công thức tính nguyên tử khối là tổng khối lượng của proton, neutron và electron. Do khối lượng electron rất nhỏ nên thường bỏ qua.
Nguyên tử khối ≈ số khối = số proton + số neutron
- Na: 23 đvC
- Bi: 209 đvC
- Ca: 40 đvC
Cách tính số oxi hóa
Công thức tính số oxi hóa dựa vào quy tắc:
- Số oxi hóa của kim loại kiềm (Na) là +1
- Số oxi hóa của kim loại kiềm thổ (Ca) là +2
- Số oxi hóa của Bi thường là +3 hoặc +5
Tổng số oxi hóa trong phân tử trung hòa luôn bằng 0.
Ứng dụng NaBiCa trong thực tế
NaBiCa là hợp chất có nhiều ứng dụng quan trọng trong đời sống. Tôi sẽ phân tích chi tiết các ứng dụng chính của hợp chất này trong y học, công nghiệp và hướng dẫn cách pha chế bảo quản an toàn.
Ứng dụng trong y học
NaBiCa được sử dụng phổ biến trong điều trị các bệnh về dạ dày. Hợp chất này có khả năng trung hòa acid dịch vị hiệu quả.
Các nghiên cứu lâm sàng cho thấy NaBiCa giúp giảm nhanh các triệu chứng ợ nóng, khó tiêu. Tôi thường khuyên bệnh nhân dùng thuốc có chứa NaBiCa sau bữa ăn 30 phút.
Ngoài ra, NaBiCa còn được dùng làm thuốc kháng acid trong điều trị loét dạ dày. Liều lượng thông thường là 0,5-1g/lần, 3-4 lần/ngày.
Ứng dụng trong công nghiệp
Trong công nghiệp, NaBiCa được sử dụng làm chất phụ gia thực phẩm. Hợp chất này giúp điều chỉnh độ pH và tạo độ xốp cho bánh kẹo.
Các nhà máy sản xuất bột giặt cũng sử dụng NaBiCa làm chất tẩy rửa. Khả năng làm sạch của nó rất hiệu quả với vết bẩn cứng đầu.

Một ứng dụng quan trọng khác là sản xuất thuốc tẩy rửa công nghiệp. NaBiCa có tính năng khử trùng, diệt khuẩn tốt.
Cách pha chế và bảo quản
Để pha chế NaBiCa cần tuân thủ quy trình nghiêm ngặt. Đầu tiên, hòa tan natri carbonat trong nước cất ở nhiệt độ phòng.
Tiếp theo cho từ từ bismuth nitrat vào dung dịch, khuấy đều. Dung dịch sẽ có màu trắng đục.
Lọc kết tủa và sấy khô ở 60°C trong 2 giờ. Bảo quản sản phẩm trong lọ thủy tinh kín, tránh ánh sáng trực tiếp.
Kinh nghiệm của tôi là nên chia nhỏ thành nhiều lọ để hạn chế tiếp xúc với không khí. Thời hạn sử dụng tối đa 6 tháng kể từ ngày pha chế.
FAQ: Câu hỏi thường gặp về NaBiCa
NaBiCa là một hợp chất quan trọng trong ngành công nghiệp hóa chất. Tôi sẽ giải đáp các thắc mắc phổ biến về hợp chất này.
Cách xác định độ pH của dung dịch NaBiCa
Để xác định độ pH của dung dịch NaBiCa, ta cần áp dụng công thức tính pH dựa trên nồng độ ion H+.
Đầu tiên, xác định nồng độ các ion trong dung dịch bằng cách tính nồng độ dung dịch. NaBiCa là muối bazơ yếu nên sẽ thủy phân.
Sau đó áp dụng công thức:
pH = -log[H+]
Với [H+] là nồng độ ion H+ trong dung dịch, được xác định qua công thức hóa học cơ bản của phản ứng thủy phân.
Phương pháp bảo quản NaBiCa hiệu quả
NaBiCa cần được bảo quản trong điều kiện khô ráo, tránh ánh nắng trực tiếp. Nhiệt độ bảo quản tối ưu từ 15-25°C.
Đóng gói NaBiCa trong túi kín hoặc hộp nhựa có nắp đậy kín để tránh hút ẩm. Không để gần các chất oxi hóa mạnh.
Kiểm tra định kỳ tình trạng bảo quản, loại bỏ phần bị vón cục hoặc biến màu.
Những lưu ý khi sử dụng NaBiCa
An toàn là yếu tố quan trọng nhất khi sử dụng NaBiCa. Cần xác định số oxi hóa của các nguyên tố để đánh giá tính chất.
Sử dụng thiết bị bảo hộ như găng tay, kính bảo vệ mắt khi thao tác với NaBiCa. Tránh tiếp xúc trực tiếp với da.
Pha loãng dung dịch đúng nồng độ trước khi sử dụng. Không trộn lẫn với các hóa chất khác khi chưa hiểu rõ phản ứng.
Kiến thức về nabica công thức giúp người học nắm vững cấu tạo và tính chất của hợp chất quan trọng này. Các công thức tính toán cơ bản như mol, khối lượng, nồng độ là nền tảng để hiểu và ứng dụng NaBiCa trong y học và công nghiệp. Việc thực hành tính toán thông qua các bài tập minh họa cụ thể tạo điều kiện thuận lợi cho học sinh tiếp cận kiến thức hóa học một cách dễ dàng.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

