Công thức ete và các phương pháp điều chế trong hóa học hữu cơ
Ete công thức là một chủ đề quan trọng trong hóa học hữu cơ. Hợp chất này có cấu tạo đặc biệt với cầu nối oxi. Các phương pháp điều chế ete đa dạng với nhiều ứng dụng thiết thực. Bài viết phân tích chi tiết về cấu tạo, tính chất và phản ứng của ete.
Ete công thức và cấu tạo phân tử
Ete là hợp chất hữu cơ có công thức tổng quát R-O-R’, trong đó R và R’ là các gốc hidrocacbon. Ete công thức phân tử đơn giản nhất là CH3-O-CH3, còn gọi là đimetyl ete.
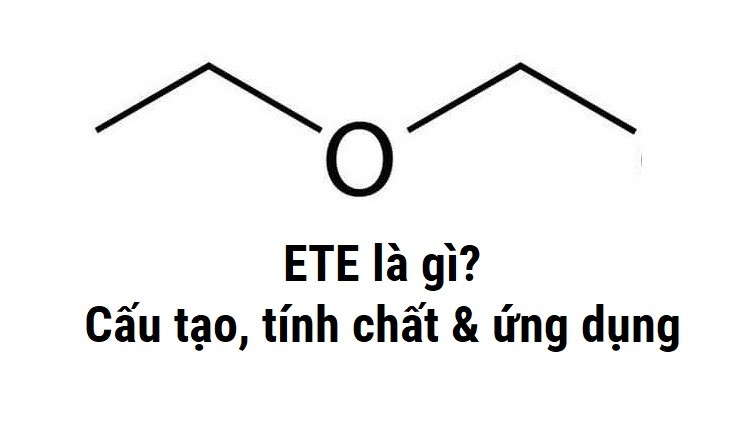
Về mặt cấu tạo, ete là gì? Đây là hợp chất có nguyên tử oxi liên kết với 2 nguyên tử cacbon bằng 2 liên kết đơn. Tôi thường ví von với học sinh rằng cấu trúc ete giống như chữ V úp ngược, với O ở đỉnh và 2 gốc R ở 2 đầu.
Cấu tạo ete có góc liên kết C-O-C xấp xỉ 110°. Điều này khiến phân tử có dạng góc cong, không phẳng. Trong quá trình giảng dạy, tôi thường dùng mô hình phân tử để minh họa góc này cho học sinh dễ hình dung.
Công thức tổng quát của ete:
R-O-R’
Trong đó:
- R, R’: Gốc hidrocacbon (có thể giống hoặc khác nhau)
- O: Nguyên tử oxi đóng vai trò cầu nối
Ví dụ một số ete thường gặp:
- Đimetyl ete: CH3-O-CH3
- Đietyl ete: CH3CH2-O-CH2CH3
- Metyl etyl ete: CH3-O-CH2CH3
Đặc biệt, khi giảng về ete tôi luôn nhấn mạnh với học sinh về tính đối xứng trong cấu trúc. Điều này giúp các em dễ dàng phân biệt ete với rượu và phenol.
Cách viết công thức cấu tạo và phân loại ete
Ete là một nhóm hợp chất hữu cơ quan trọng trong hóa học. Việc nắm vững công thức ete giúp học sinh dễ dàng nhận biết và phân biệt với các nhóm chất khác.
Công thức tổng quát của ete
Ete có công thức tổng quát là:
R-O-R’
Trong đó:
- R và R’ là các gốc hidrocacbon
- O là nguyên tử oxi đóng vai trò cầu nối
Ví dụ điển hình là pe công thức với R = R’ = C2H5, tạo thành C2H5-O-C2H5.
Quy tắc viết công thức ete
Khi viết công thức ete, cần tuân thủ các nguyên tắc sau:
Bước 1: Xác định 2 gốc hidrocacbon R và R’
Bước 2: Đặt nguyên tử oxi ở giữa 2 gốc
Bước 3: Kiểm tra lại số liên kết và độ bão hòa
Tôi thường hướng dẫn học sinh tưởng tượng nguyên tử O như chiếc cầu nối 2 bờ R và R’. Cách này giúp các em nhớ lâu hơn.
Phân loại các dạng ete thường gặp
Dựa vào cấu tạo phân tử, ete được chia thành 2 nhóm chính:
Ete đối xứng:
- Hai gốc R và R’ giống nhau
- Ví dụ: CH3-O-CH3 (đimetyl ete)
Ete không đối xứng:
- Hai gốc R và R’ khác nhau
- Ví dụ: CH3-O-C2H5 (etyl metyl ete)
Việc phân loại này giúp dự đoán được tính chất vật lý và hóa học của ete. Tôi thường khuyên học sinh ghi nhớ một số ví dụ tiêu biểu để áp dụng vào bài tập.
Phương pháp điều chế và phản ứng tạo ete
Ete là hợp chất hữu cơ quan trọng trong công nghiệp hóa chất. Phản ứng tạo ete thường diễn ra theo nhiều con đường khác nhau.
Tôi thường chia sẻ với học sinh rằng việc điều chế ete giống như nấu một món ăn. Chúng ta có nhiều cách để chế biến, nhưng cần chọn phương pháp phù hợp nhất.
Phản ứng tách nước của ancol
Phản ứng tách nước của ancol là phương pháp phổ biến nhất để điều chế ete. Phản ứng xảy ra ở nhiệt độ 140°C với xúc tác H2SO4 đặc.
Công thức phản ứng:
2R-OH → R-O-R + H2O
Trong đó:
- R-OH: Phân tử ancol
- R-O-R: Phân tử ete đối xứng
- H2O: Nước tách ra
Lưu ý quan trọng khi thực hiện phản ứng này là cần kiểm soát nhiệt độ chặt chẽ. Nếu nhiệt độ quá cao, ancol sẽ bị mất nước tạo anken.
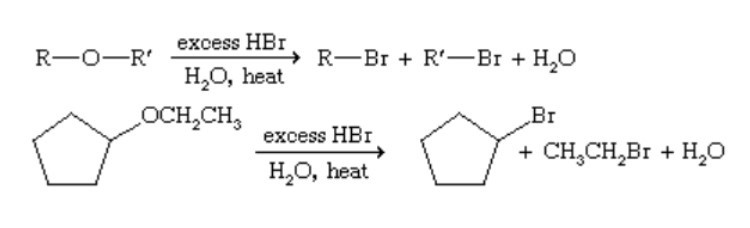
Phản ứng tổng hợp Williamson
Phản ứng Williamson là phương pháp điều chế ete không đối xứng. Phản ứng xảy ra giữa muối natri ancoholat với halogenua ankyl.
Phương trình phản ứng:
R-ONa + R’-X → R-O-R’ + NaX
Trong đó:
- R-ONa: Natri ancoholat
- R’-X: Halogenua ankyl
- R-O-R’: Ete không đối xứng
- NaX: Muối halogenua natri
Kinh nghiệm của tôi cho thấy học sinh thường nhầm lẫn giữa R và R’. Cần nhấn mạnh đây là 2 gốc ankyl khác nhau.
Các phương pháp điều chế khác
Ngoài hai phương pháp chính trên, ete công thức còn có thể được điều chế bằng nhiều cách khác:
Phản ứng của ancol với anken:
R-OH + CH2=CH2 → R-O-CH2-CH3
Phản ứng của phenol với diazonium:
C6H5OH + ArN2Cl → C6H5-O-Ar + N2 + HCl
Mỗi phương pháp đều có ưu nhược điểm riêng. Việc lựa chọn phương pháp phụ thuộc vào điều kiện thực tế và mục đích sử dụng.
Tính chất vật lý và hóa học của ete
Ete là một nhóm hợp chất hữu cơ quan trọng trong tính chất của ete thể hiện qua nhiều đặc điểm nổi bật. Chúng có cấu tạo phân tử gồm 2 gốc hydrocarbon nối với nhau qua nguyên tử oxy.
Tính chất vật lý đặc trưng
Ete có nhiệt độ sôi thấp hơn ancol có cùng khối lượng phân tử. Điều này là do liên kết hydro giữa các phân tử ete yếu hơn so với ancol.

Ete là chất lỏng không màu ở điều kiện thường, có mùi thơm dễ chịu. Tôi thường ví von với học sinh rằng mùi của ete giống như mùi trái cây chín.
Khả năng tan trong nước của ete kém, nhưng lại tan tốt trong dung môi hữu cơ. Đây là tính chất quan trọng để tách chiết các hợp chất hữu cơ trong phòng thí nghiệm.
Các phản ứng hóa học cơ bản
Ete trong hóa học tham gia các phản ứng đặc trưng sau:
Phản ứng cháy: Ete cháy trong không khí tạo CO2 và H2O. Phản ứng này tỏa nhiều nhiệt nên cần thận trọng khi thao tác với ete.
Phản ứng với axit HI đặc: Ete bị phân hủy tạo ancol và iodua ankyl. Đây là phản ứng định tính quan trọng để nhận biết ete.
Phản ứng oxi hóa: Ete bị oxi hóa chậm trong không khí tạo peroxit. Vì vậy không nên để ete tiếp xúc với không khí quá lâu.
So sánh với ancol đồng phân
Ete và ancol đồng phân có cùng công thức phân tử nhưng khác biệt về tính chất. Ete có nhiệt độ sôi thấp hơn, độ tan trong nước kém hơn ancol.
Về mặt hóa học, ete kém hoạt động hơn ancol. Ete không tham gia phản ứng thế H của nhóm OH như ancol.
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa ete và ancol. Cách phân biệt đơn giản là ete có mùi thơm đặc trưng và không tác dụng với Na kim loại.
Ứng dụng của ete trong đời sống và công nghiệp
Ete công thức R-O-R’ là hợp chất hữu cơ có nhiều ứng dụng quan trọng. Tôi thường ví von ete như một “người đa năng” trong gia đình hóa học với khả năng ứng dụng đa dạng.
Các ứng dụng của ete trải rộng từ y tế đến công nghiệp. Tính chất hóa học đặc biệt giúp ete trở thành chất không thể thiếu trong nhiều lĩnh vực.
Ete làm dung môi
Ete có khả năng hòa tan tốt nhiều chất hữu cơ như dầu mỡ, nhựa và cao su. Đặc tính này khiến ete trở thành dung môi lý tưởng trong phòng thí nghiệm.
Trong quá trình giảng dạy, tôi thường cho học sinh thí nghiệm hòa tan styrofoam trong ete. Học sinh rất thích thú khi thấy styrofoam “biến mất” trong dung môi.
Ete còn được sử dụng để chiết xuất tinh dầu từ thực vật. Phương pháp này giúp thu được tinh dầu nguyên chất, không bị biến đổi bởi nhiệt độ cao.
Ứng dụng trong y học
Ete đóng vai trò quan trọng trong ngành y. Điển hình nhất là diethyl ete – chất gây mê đầu tiên được sử dụng trong phẫu thuật từ thế kỷ 19.
Ngày nay, ete vẫn được dùng để pha chế một số loại thuốc. Tôi từng tham quan nhà máy dược phẩm và thấy ete được sử dụng trong quy trình sản xuất thuốc giảm đau.
Ứng dụng trong công nghiệp
Trong công nghiệp, ete được dùng làm dung môi để tổng hợp các hợp chất hữu cơ. Khả năng hòa tan tốt giúp ete trở thành “cầu nối” cho các phản ứng hóa học.
Ete còn là nguyên liệu quan trọng trong sản xuất chất dẻo, sơn và vecni. Tôi đã chứng kiến quy trình sản xuất sơn sử dụng ete làm dung môi pha loãng.
Một ứng dụng đặc biệt của ete là làm phụ gia trong xăng động cơ. MTBE (methyl tert-butyl ete) giúp tăng chỉ số octan, cải thiện hiệu suất động cơ.
FAQ: Câu hỏi thường gặp về ete
Ete là hợp chất hữu cơ phổ biến trong công nghiệp và đời sống. Tôi sẽ giải đáp một số thắc mắc thường gặp về nhóm chất này.
Sự khác biệt giữa ete và ancol
Ete và ancol có nhiều điểm khác biệt về cấu tạo phân tử. Ete có công thức của ete dạng R-O-R’, trong khi ancol có công thức R-OH.
Về tính chất vật lý, ete thường có nhiệt độ sôi thấp hơn ancol cùng khối lượng phân tử. Điều này do ete không tạo được liên kết hydro giữa các phân tử.
Về phản ứng hóa học, ete kém hoạt động hơn ancol. Ete chỉ tham gia phản ứng thế ở mạch cacbon, còn ancol có thể phản ứng ở nhóm -OH.
Độc tính và cách bảo quản ete
Ete là chất dễ bay hơi và rất dễ cháy nổ. Hơi ete nặng hơn không khí nên dễ tích tụ ở vùng thấp gây nguy hiểm.
Khi tiếp xúc với ete cần đeo găng tay, kính bảo hộ. Tránh hít phải hơi ete vì có thể gây choáng váng, mất ý thức.
Bảo quản ete trong bình kín, tránh ánh sáng trực tiếp. Không để gần nguồn lửa, tia lửa điện. Nơi bảo quản phải thông thoáng.
Phương pháp nhận biết ete
Ete có thể được nhận biết qua mùi thơm đặc trưng. Tuy nhiên cách này không an toàn và thiếu chính xác.
Phương pháp chuẩn là dùng phản ứng với dung dịch AgNO3/NH3. Ete không tạo kết tủa Ag, khác với ancol bậc 1 tạo kết tủa trắng Ag2O.
Có thể dùng phản ứng với Na kim loại. Ete không phản ứng với Na, trong khi ancol giải phóng khí H2.
Kiến thức về ete công thức giúp học sinh nắm vững cấu tạo phân tử và phương pháp điều chế ete trong phòng thí nghiệm. Các phản ứng tạo ete từ ancol và phương pháp Williamson là nền tảng quan trọng để hiểu về hợp chất hữu cơ này. Tính chất vật lý, hóa học đặc trưng và ứng dụng đa dạng của ete trong y học, công nghiệp đã khẳng định vai trò thiết yếu của nó trong đời sống.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

