Công thức tính nồng độ phần trăm kèm bài tập minh họa
Nồng độ phần trăm là thước đo không thể thiếu trong hóa học, cho biết tỉ lệ chất tan có trong dung dịch. Đây chính là thước đo quan trọng giúp chúng ta hiểu rõ thành phần của một hỗn hợp. Bài viết dưới đây sẽ cung cấp cho bạn công thức tính nồng độ phần trăm chuẩn xác và hướng dẫn từng bước giải các bài tập liên quan.
Công thức tính nồng độ phần trăm
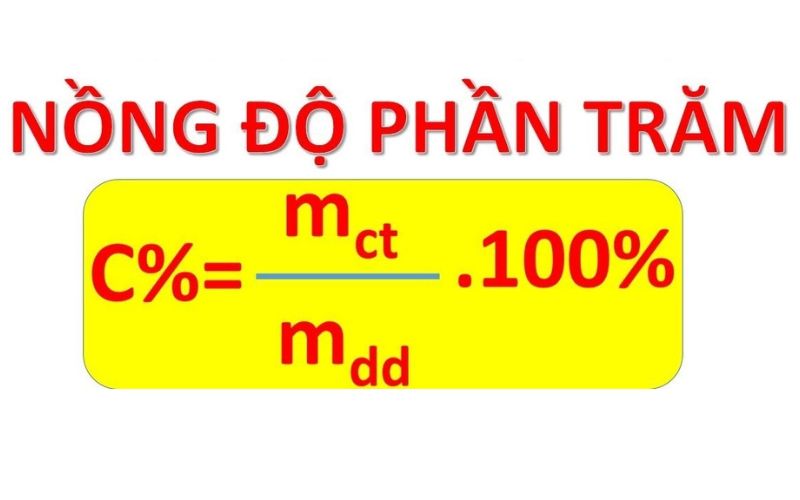
Nồng độ phần trăm của dung dịch (kí hiệu là C%) là một đại lượng cho biết số gam chất tan có trong 100 gam dung dịch. Công thức tính nồng độ phần trăm của dung dịch như sau:
C% = mct/mdd x 100%
Trong đó:
- C%: Nồng độ phần trăm
- mct: Khối lượng chất tan, biểu thị bằng gam
- mdd: Khối lượng dung dịch, biểu thị bằng gam
Mặt khác: mdd = mct + mdm ( mdm là khối lượng của dung môi)
Từ công thức trên ta có thể suy ra các công thức sau:
- Công thức tính khối lượng chất tan: mct = (C% x mdd)/100%
- Công thức tính khối lượng dung dịch: mdd = (mct x 100%)/C%
- Công thức tính khối lượng riêng của dung dịch: d = mdd/V (đơn vị: g/ml)
Quy trình giải bài toán tính nồng độ phần trăm
Để tính nồng độ phần trăm dung dịch sau phản ứng hóa học, bạn cần thực hiện theo các bước sau:
Bước 1: Xác định thành phần dung dịch: Điều quan trọng đầu tiên là xác định rõ những chất nào còn lại trong dung dịch sau khi phản ứng xảy ra, bao gồm cả chất dư.
Bước 2: Tính khối lượng dung dịch sau phản ứng theo phương pháp bảo toàn khối lượng (tổng khối lượng chất tham gia phản ứng = tổng khối lượng sản phẩm).
Bước 3: Tính khối lượng chất tan mà bạn muốn tìm nồng độ.
Bước 4: Tính nồng độ phần trăm: Áp dụng công thức C% = mct/mdd x 100% để tính nồng độ phần trăm của chất đó trong dung dịch.
Lưu ý: Khi thực hiện các bài toán này, bạn cần đọc kỹ đề bài, xác định rõ các chất tham gia và sản phẩm phản ứng để có thể tính toán chính xác.
Bài tập áp dụng công thức nồng độ phần trăm có lời giải
Dưới đây là một số bài tập có lời giải về công thức nồng độ phần trăm để các bạn học sinh tham khảo. Với những ví dụ minh họa cụ thể, bạn sẽ nhanh chóng nắm vững khái niệm này và tự tin áp dụng vào các bài toán khác.
Bài tập 1: Hòa tan 20 gam NaCl vào 60 gam nước. Tính nồng độ phần trăm của dung dịch?
Lời giải:
Khối lượng dung dịch là: mdd = mct + mdm = 20 + 60 = 80 g
Nồng độ phần trăm của dung dịch là:
Áp dụng công thức C% = mct/mdd x 100% = 20/80 x 100% = 25%
Bài tập 2: Hãy tính khối lượng của KCl có trong 300g dung dịch KCl có nồng độ 15%
Lời giải:
Áp dụng công thức c phần trăm: C% = mct/mdd x 100% ta có:
C% = (mKCl/300) x 100% = 15 (%)
⇒ mKCl = (15 x 300)/100 = 45 (gam)
Kết luận: Vậy trong 300g dung dịch KCl nồng độ 15% có chứa 45 gam KCl
Bài tập 3: Hòa tan 25 gam đường vào nước thu được dung dịch A có C% = 10%. Hãy:
a) Tính khối lượng của dung dịch A thu được.
b) Tính khối lượng nước cần cho sự pha chế trên
Lời giải:
a) Từ công thức tính C% ta có thể suy ra công thức tính khối lượng dung dịch như sau:
mdd = (mct x 100%)/C% = (25 x 100%)/10% = 250 (g)
Vậy khối lượng dung dịch A thu được là 250 gam
b) Áp dụng phương pháp bảo toàn khối lượng ta có:
mnước = mdd – mđường = 250 – 25 = 225 (g)
Kết luận: Vậy để có thể hoà tan 25 gam đường thì chúng ta phải cần 225 gam nước để tạo ra 250 gam dung dịch A
Bài tập 4: Cho 200g dung dịch NaOH 20% tác dụng vừa đủ với 100 gam dung dịch HCl sinh ra NaCl và H2O. Hãy tính nồng độ muối sinh ra sau phản ứng.
Lời giải:
Khối lượng NaOH là: mNaOH = (C% x mdd)/100% = (20 x 200)/100 = 40 (gam)
⇒ Số mol NaOH là: nNaOH = 40/40 = 1 (mol)
Ta có phương trình phản ứng: NaOH + HCl → NaCl + H2O
Theo PTHH: số mol NaCl = số mol NaOH = 1 mol
⇒ Muối thu được sau phản ứng là NaCl có khối lượng là: mNaCl = 1 x 58,5 = 58,5 gam
Phản ứng không sinh ra kết tủa hay chất khí nên khối lượng dung dịch sau phản ứng là:
mdd sau phản ứng = mdd NaOH + mdd HCl = 300 + 100 = 300 (gam)
Vậy nồng độ phần trăm của dung dịch muối thu được là:
⇒ C% ddNaCl = mNaCl/mdd sau phản ứng x 100% = 58,5/300 x 100% = 19,5 %

Bài tập 5: Hòa tan 50 gam đường vào 200ml nước (dH2O = 1 g/ml). Tính nồng độ phần trăm của dung dịch?
Lời giải:
Từ công thức tính khối lượng riêng của dung dịch: d = mdd/V ta có:
mH2O = 200.1 = 200 gam
Khối lượng dung dịch sau hòa tan là: mdd = 50+ 200 = 250 gam
Nồng độ phần trăm của dung dịch là:
Áp dụng công thức tính c phần trăm: C% = mct/mdd x 100% = 50/250 x 100% = 20%
Bài tập 6: Trộn 200 gam dung dịch HCl 7,3% với 300 gam dung dịch HCl 14,6%. Tính nồng độ phần trăm của dung dịch mới.
Lời giải:
mct1 = (7,3% x 200) / 100% = 14,6 gam
mct2 = (14,6% x 300) / 100% = 43,8 gam
mct mới = mct1 + mct2 = 14,6 + 43,8 = 58,4 gam
mdd mới = 200 + 300 = 500 gam
C% mới = (58,4/500) x 100% = 11,68%
Bài tập 8: Hòa tan hoàn toàn 16g CuSO₄ vào một lượng nước vừa đủ để được 250ml dung dịch. Tính nồng độ phần trăm của dung dịch thu được, biết khối lượng riêng của dung dịch là 1,2g/ml.
Lời giải:
Tính khối lượng dung dịch: mdd = Vdd . D = 250ml . 1,2g/ml = 300g
Áp dụng công thức tính nồng độ phần trăm: C% = (mct/mdd) . 100% = (16g/300g) . 100% = 5,33%
Kết luận: Nồng độ phần trăm của dung dịch CuSO₄ là 5,33%.
Bài tập 9: Cần pha thêm bao nhiêu gam nước vào 200g dung dịch NaOH 40% để thu được dung dịch NaOH 10%?
Lời giải:
Tính khối lượng NaOH ban đầu: mNaOH = 200g . 40% = 80g
Gọi x là khối lượng nước cần thêm. Ta có phương trình: 80g / (200g + x) = 10% => x = 600g
Kết luận: Cần pha thêm 600g nước.
Lời kết
Công thức tính nồng độ phần trăm là một kiến thức quan trọng mà các bạn học sinh cần nắm vững trong môn Hóa học. Với những thông tin được chia sẻ trong bài viết này, hy vọng bạn đọc đã nắm vững kiến thức và tự tin áp dụng vào việc giải quyết các bài toán hóa học và thành công trong các kỳ thi.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

