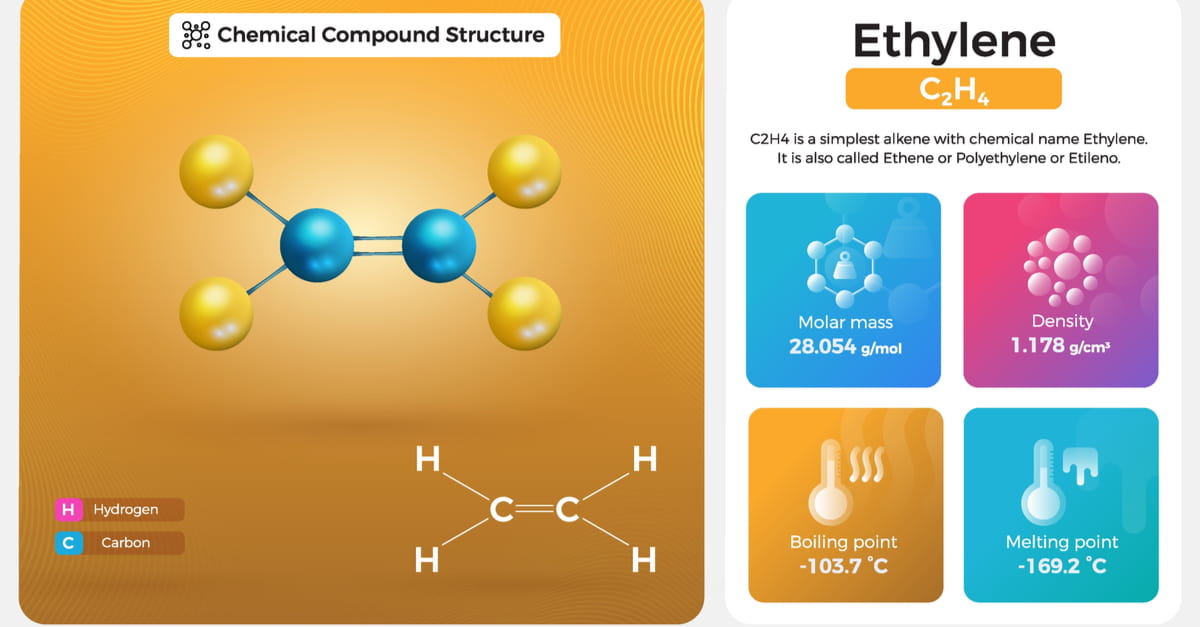
Công thức phân tử của etilen và cấu tạo phân tử C2H4 trong hóa học hữu cơ
Công thức phân tử của etilen C2H4 là nền tảng để hiểu cấu trúc phân tử này. Etilen có cấu tạo đặc biệt với liên kết đôi C=C và bốn nguyên tử hydro. Các tính chất hóa học độc đáo giúp etilen trở thành nguyên liệu quan trọng trong công nghiệp hóa chất.
Công thức phân tử của etilen là gì?
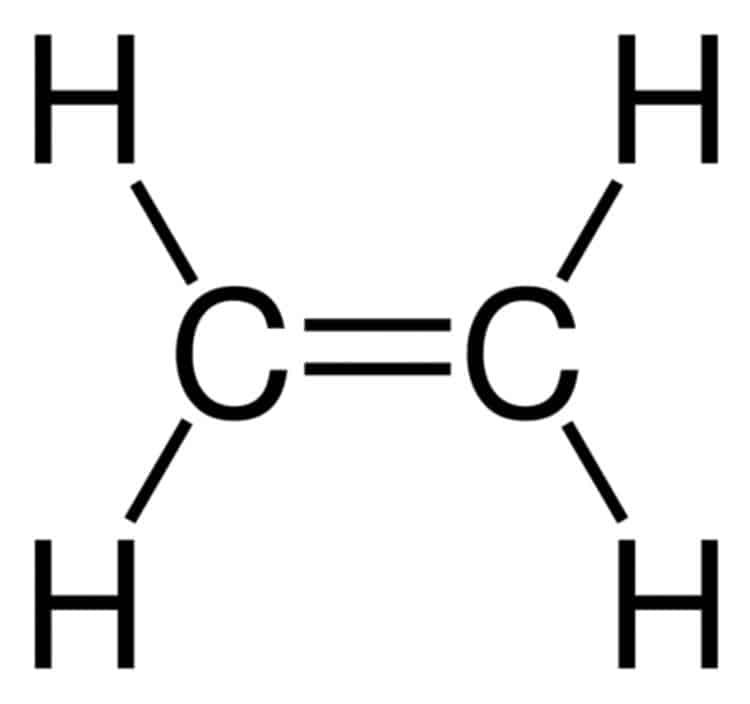
Etilen có công thức phân tử là C2H4. Đây là một hydrocacbon không no thuộc dãy olefin, có liên kết đôi C=C.
Trong phân tử etilen, các nguyên tử carbon và hydro được sắp xếp theo cấu trúc phẳng. Hai nguyên tử carbon liên kết với nhau bằng một liên kết đôi.
Mỗi nguyên tử carbon còn lại hai electron hóa trị tự do để liên kết với hai nguyên tử hydro. Điều này tạo nên cấu trúc đặc trưng của phân tử etilen.
Etilen là gì? Đó là một chất khí không màu, nhẹ hơn không khí và có mùi ngọt nhẹ. Nó đóng vai trò quan trọng trong công nghiệp hóa chất.
Trong tự nhiên, etilen được tạo ra từ quá trình chín của trái cây. Đó là lý do vì sao một quả táo chín có thể làm các quả khác chín nhanh hơn.
Trong giảng dạy, tôi thường ví von etilen như một “chất xúc tác tự nhiên”. Nó giúp học sinh dễ nhớ và hiểu được vai trò của hợp chất này.
Cấu tạo phân tử và liên kết hóa học của etilen
Cấu tạo etilen có công thức phân tử là C2H4, trong đó hai nguyên tử cacbon liên kết với nhau bằng liên kết đôi. Mỗi nguyên tử cacbon còn liên kết với hai nguyên tử hiđro bằng liên kết đơn.
Phân tử etilen có cấu trúc phẳng đặc trưng, tạo nên tính chất hóa học đặc biệt. Điều tương tự cũng xuất hiện ở công thức cấu tạo của axetilen với liên kết ba.
Các electron trong phân tử etilen phân bố đều trên mặt phẳng phân tử, tạo điều kiện thuận lợi cho các phản ứng cộng.
Cấu tạo không gian của phân tử etilen
Phân tử etilen có dạng phẳng với tất cả các nguyên tử nằm trên cùng một mặt phẳng. Đây là đặc điểm quan trọng giúp phân biệt với các hợp chất khác.
Các nguyên tử hiđro xếp đối xứng qua trục liên kết C=C. Cấu trúc này tạo nên sự cân bằng về điện tích trong phân tử.
Liên kết đôi C=C trong phân tử etilen
Liên kết đôi C=C gồm một liên kết σ (sigma) và một liên kết π (pi). Liên kết σ hình thành do sự xen phủ trực tiếp giữa các orbital sp2.
Liên kết π được tạo thành do sự xen phủ bên của các orbital p còn lại. Đặc điểm này làm cho liên kết π yếu hơn và dễ bị phá vỡ hơn liên kết σ.
Góc liên kết và độ dài liên kết trong etilen
Góc liên kết H-C-H trong etilen là 117°, gần với góc 120° lý tưởng của lai hóa sp2. Sự sai lệch nhỏ này do ảnh hưởng của liên kết π.
Độ dài liên kết C=C là 0,134 nm, ngắn hơn so với liên kết đơn C-C (0,154 nm). Điều này chứng tỏ liên kết đôi bền vững hơn liên kết đơn.
Các liên kết C-H có độ dài trung bình 0,108 nm và nằm trong mặt phẳng phân tử. Cấu trúc này tạo điều kiện thuận lợi cho các phản ứng cộng xảy ra.
Công thức cấu tạo và cách biểu diễn etilen
Etilen là một hydrocacbon không no đơn giản nhất trong dãy ankene. Công thức cấu tạo của etilen có dạng C2H4, trong đó hai nguyên tử cacbon liên kết với nhau bằng liên kết đôi.
Cấu trúc phân tử etilen khá đặc biệt và có nhiều điểm tương đồng với công thức phân tử của toluen về mặt liên kết hóa học. Tuy nhiên, etilen đơn giản hơn nhiều.
Công thức cấu tạo thu gọn của etilen
Công thức cấu tạo thu gọn của etilen được biểu diễn là: CH2=CH2
Trong đó:
– Dấu = thể hiện liên kết đôi giữa 2 nguyên tử cacbon
– Mỗi nguyên tử cacbon liên kết với 2 nguyên tử hydro
Đây là cách viết phổ biến nhất khi biểu diễn phân tử etilen trong các phương trình phản ứng hóa học.
Công thức electron và công thức không gian
Công thức electron của etilen cho thấy rõ sự phân bố electron trong phân tử:
H:C::C:H
H H
Về mặt không gian, phân tử etilen có dạng phẳng với góc liên kết xấp xỉ 120°. Các nguyên tử hydro nằm trong cùng mặt phẳng với hai nguyên tử cacbon.
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh thường nhớ tốt nhất khi hình dung etilen như một cánh bướm đang xòe ra, với hai nguyên tử cacbon là thân bướm và các nguyên tử hydro là cánh.
Tính chất hóa học đặc trưng của etilen C2H4
Etilen là một hydrocacbon không no có công thức phân tử C2H4. Phân tử etilen có liên kết đôi C=C nên rất hoạt động về mặt hóa học.
Tính chất etilen thể hiện qua các phản ứng cộng, trùng hợp và oxi hóa đặc trưng. Các phản ứng này có ý nghĩa quan trọng trong công nghiệp hóa chất.
Tương tự như công thức phân tử của đimetylamin, etilen C2H4 có cấu trúc phân tử đơn giản nhưng đóng vai trò quan trọng trong nhiều quá trình tổng hợp hữu cơ.
Phản ứng cộng của etilen
Phản ứng cộng là phản ứng đặc trưng của etilen do có liên kết đôi C=C. Khi phản ứng, liên kết đôi bị phá vỡ và tạo thành các sản phẩm bão hòa.
Etilen có thể tham gia phản ứng cộng với H2, Cl2, Br2, HCl, HBr và H2O. Phản ứng cộng nước tạo ra công thức rượu etylic là một ví dụ điển hình.
Trong quá trình giảng dạy, tôi thường ví von phản ứng cộng như việc “kết hôn” của etilen với các chất khác, giúp học sinh dễ nhớ và hiểu bài hơn.
Phản ứng trùng hợp tạo polyetylen
Phản ứng trùng hợp xảy ra khi nhiều phân tử etilen liên kết với nhau tạo thành polyetylen. Đây là phản ứng quan trọng trong công nghiệp sản xuất nhựa.
Công thức phản ứng trùng hợp:
nCH2=CH2 → [-CH2-CH2-]n
Polyetylen được ứng dụng rộng rãi để sản xuất túi nilon, chai nhựa và các vật dụng sinh hoạt khác.
Phản ứng oxi hóa etilen
Etilen dễ dàng bị oxi hóa bởi các chất oxi hóa như KMnO4, K2Cr2O7. Phản ứng với KMnO4 trong môi trường kiềm tạo thành etylen glycol.
Phương trình phản ứng:
3CH2=CH2 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH
Phản ứng oxi hóa etilen bằng KMnO4 còn được dùng để nhận biết liên kết đôi C=C trong phân tử hữu cơ thông qua màu tím của KMnO4 bị mất.
Ứng dụng quan trọng của etilen trong công nghiệp
Etilen trong hóa học đóng vai trò then chốt với nhiều ứng dụng công nghiệp quan trọng. Khí etilen là nguyên liệu đầu vào cho nhiều quá trình tổng hợp hóa học có giá trị.
Các ứng dụng chính của etilen tập trung vào 3 lĩnh vực: sản xuất polyetylen, tổng hợp etylen glicol và một số ứng dụng khác. Mỗi lĩnh vực đều mang lại giá trị kinh tế cao.
Sản xuất polyetylen
Polyetylen được tổng hợp từ etilen qua phản ứng trùng hợp. Quá trình này diễn ra dưới áp suất cao và có xúc tác.
Phản ứng tổng quát:
nCH2=CH2 → [-CH2-CH2-]n
Sản phẩm polyetylen có nhiều ứng dụng trong đời sống như làm túi nilon, chai nhựa, vật liệu bao gói. Đây là một trong những polymer được sử dụng phổ biến nhất hiện nay.
Tổng hợp etylen glicol
Etylen glicol công thức được tổng hợp từ etilen qua 2 giai đoạn. Đầu tiên, etilen phản ứng với nước tạo etilen oxit.
Sau đó etilen oxit thủy phân tạo etylen glicol:
CH2-CH2 + H2O → HOCH2CH2OH
O
Etylen glicol được sử dụng làm chất chống đông trong két nước làm mát động cơ và là nguyên liệu sản xuất polyeste.
Các ứng dụng khác
Etilen còn được dùng để tổng hợp nhiều hợp chất hữu cơ quan trọng. Nó tham gia phản ứng với clo tạo EDC làm nguyên liệu sản xuất PVC.
Trong nông nghiệp, etilen đóng vai trò hormone thực vật. Nó thúc đẩy quá trình chín của hoa quả và rụng lá.
Trong công nghiệp hàn, etilen kết hợp với oxi tạo ngọn lửa có nhiệt độ cao. Ngọn lửa này được dùng để cắt và hàn kim loại hiệu quả.
FAQ: Câu hỏi thường gặp về etilen
Etilen là một chất khí quan trọng trong công nghiệp hóa chất với công thức phân tử của etilen là C2H4. Dưới đây là một số câu hỏi phổ biến về tính chất và đặc điểm của etilen.
Etilen có độc không?
Etilen không gây độc tính cấp tính cho con người. Tuy nhiên, việc hít phải nồng độ cao có thể gây choáng váng và khó thở.
Khi tiếp xúc lâu dài với etilen ở nồng độ thấp cũng không gây ảnh hưởng nghiêm trọng đến sức khỏe. Điều này đã được chứng minh qua nhiều nghiên cứu độc tính.
Etilen có thể tự bốc cháy không?
Etilen là chất khí dễ cháy nhưng không tự bốc cháy ở điều kiện thường. Nhiệt độ tự bốc cháy của etilen là 450°C.
Khi tiếp xúc với nguồn lửa hoặc tia lửa điện, etilen sẽ cháy mạnh tạo thành CO2 và H2O. Vì vậy cần bảo quản cẩn thận, tránh xa nguồn nhiệt.
Làm thế nào để nhận biết etilen?
Etilen là chất khí không màu, có mùi ngọt nhẹ đặc trưng. Có thể nhận biết etilen qua các phản ứng hóa học:
Cho etilen tác dụng với dung dịch brom, màu nâu đỏ của brom sẽ mất. Đây là phản ứng đặc trưng của alkene.
Etilen làm mất màu dung dịch KMnO4 loãng, chuyển từ tím sang không màu. Phản ứng này giúp phân biệt etilen với các khí khác.
Chúng ta đã tìm hiểu chi tiết về công thức phân tử của etilen C2H4 và cấu trúc phân tử đặc biệt của nó với liên kết đôi C=C. Etilen là một trong những hợp chất quan trọng nhất của ngành công nghiệp hóa dầu với các phản ứng cộng, trùng hợp tạo polyetylen và oxi hóa đặc trưng. Các ứng dụng đa dạng trong sản xuất nhựa, dung môi và hóa chất công nghiệp đã khẳng định vai trò then chốt của etilen trong đời sống.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

