Nắm kỹ công thức oxit axit và các phản ứng hóa học quan trọng
Công thức oxit axit là kiến thức nền tảng trong chương trình hóa học phổ thông. Các phản ứng của oxit axit với nước, bazơ và oxit bazơ tạo thành muối có vai trò quan trọng. Bài viết trình bày chi tiết cách viết công thức, tính chất và ứng dụng của oxit axit trong thực tế.
Công thức oxit axit
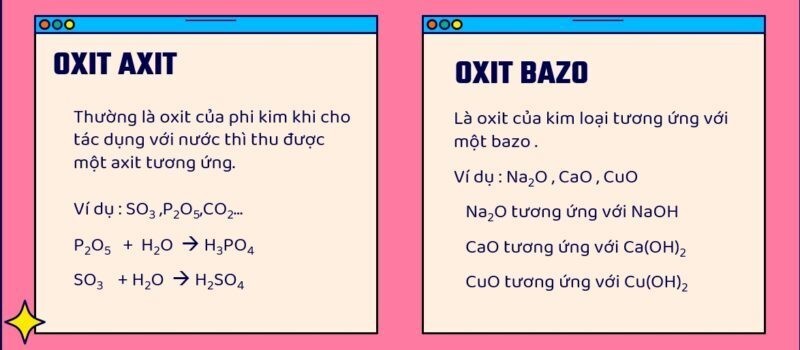
Oxit axit là hợp chất của phi kim với oxi, khi tác dụng với nước tạo thành axit. Đây là kiến thức quan trọng trong chương trình hóa học phổ thông.
Công thức oxit axit có dạng tổng quát là:
ExOy (trong đó E là phi kim, x và y là số nguyên dương)
Cách xác định công thức oxit axit rất đơn giản. Tôi thường hướng dẫn học sinh theo 3 bước:
Bước 1: Xác định hóa trị của phi kim trong oxit
- Phi kim thường có nhiều hóa trị khác nhau
- Hóa trị càng cao thì tính axit càng mạnh
Bước 2: Áp dụng quy tắc hóa trị
- Tổng hóa trị dương = Tổng hóa trị âm
- Oxi luôn có hóa trị -2
Bước 3: Rút gọn tỉ lệ số nguyên nhỏ nhất
Ví dụ minh họa:
SO3: Lưu huỳnh có hóa trị +6, Oxi có hóa trị -2
(+6) + 3(-2) = 0 → Công thức đúng là SO3
Một số oxit axit phổ biến:
CO2 (Cacbon đioxit)
SO2 (Lưu huỳnh đioxit)
SO3 (Lưu huỳnh trioxit)
N2O5 (Đinitơ pentaoxit)
P2O5 (Điphotpho pentaoxit)
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh thường nhầm lẫn giữa oxit axit và oxit bazơ. Cách phân biệt đơn giản là oxit axit chỉ được tạo bởi phi kim với oxi.
Khái niệm và đặc điểm của oxit axit trong hóa học
Oxit axit là những hợp chất của oxi với phi kim, tạo thành axit khi tác dụng với nước. Chúng có vai trò quan trọng trong nhiều phản ứng hóa học và ứng dụng thực tiễn.
Các oxit axit thường tồn tại ở dạng khí hoặc rắn, có tính axit mạnh và dễ tan trong nước. Chúng có thể phản ứng với bazơ tạo thành muối và nước.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về CO2 – một oxit axit quen thuộc có trong nước ngọt. Khi hòa tan vào nước, CO2 tạo thành axit cacbonic làm nước có vị chua nhẹ.
Oxit axit là gì và cách nhận biết
Oxit axit được hình thành từ sự kết hợp của oxi với các nguyên tố phi kim như C, N, S, P. Chúng có thể được tạo ra từ quá trình đốt cháy phi kim trong oxi.
Để nhận biết oxit axit, ta có thể dựa vào khả năng làm đổi màu quỳ tím thành màu đỏ. Điều này tương tự như công thức hóa học của phân urê khi phân hủy sẽ tạo ra CO2.
Một cách nhận biết khác là quan sát phản ứng với nước tạo dung dịch có tính axit. Tương tự như công thức chung của amin, oxit axit cũng có những đặc trưng riêng về cấu tạo.

Cấu tạo phân tử của oxit axit
Phân tử oxit axit có cấu tạo đặc trưng với nguyên tử oxi liên kết với phi kim theo tỉ lệ nhất định. Số oxi thường nhiều hơn số nguyên tử phi kim.
Liên kết trong oxit axit chủ yếu là liên kết cộng hóa trị có cực. Điều này giải thích khả năng phản ứng mạnh của chúng với nước và bazơ.
Ví dụ điển hình là SO3 với cấu tạo hình tam giác phẳng, trong đó nguyên tử S ở trung tâm liên kết với 3 nguyên tử O xung quanh.
Danh pháp và cách gọi tên oxit axit
Tên oxit axit được đặt theo quy tắc: “Oxit + tên phi kim”. Với phi kim có nhiều oxit, ta thêm số oxi La Mã trong ngoặc đơn.
Một số oxit axit phổ biến:
- CO2: Cacbon đioxit hoặc oxit cacbon (IV)
- SO2: Lưu huỳnh đioxit hoặc oxit lưu huỳnh (IV)
- N2O5: Đinitơ pentaoxit hoặc oxit nitơ (V)
Việc nắm vững cách gọi tên giúp học sinh dễ dàng nhận biết và phân biệt các oxit axit khác nhau trong hóa học.
Hướng dẫn viết công thức oxit axit đúng cách
Oxit axit là hợp chất của phi kim với oxi. Việc nắm vững cách viết công thức oxit axit giúp học sinh dễ dàng tiếp cận kiến thức hóa học.
Tương tự như công thức axit glutamic, việc viết công thức oxit axit cần tuân theo quy tắc nhất định. Mỗi oxit axit đều có công thức riêng phản ánh bản chất hóa học của nó.
Nguyên tắc viết công thức oxit axit
Nguyên tắc cơ bản là phi kim luôn đứng trước oxi trong công thức. Hóa trị của oxi luôn là II, còn phi kim có thể thay đổi theo từng trường hợp.
Số oxi trong phân tử phụ thuộc vào hóa trị của phi kim. Ví dụ với lưu huỳnh hóa trị VI, công thức oxit axit sẽ là SO3.

Khi tác dụng với nước, oxit axit tạo thành axit tương ứng như công thức của axit oleic. Đây là tính chất quan trọng để nhận biết oxit axit.
Các bước xác định công thức oxit axit
Bước 1: Xác định phi kim và hóa trị của nó trong hợp chất.
Bước 2: Viết kí hiệu phi kim trước, oxi sau theo nguyên tắc hóa trị bằng nhau.
Bước 3: Tối giản các chỉ số phân tử nếu có thể.
Bước 4: Kiểm tra lại tổng hóa trị dương và âm phải bằng 0.
Ví dụ minh họa cách viết công thức
Lấy ví dụ với photpho hóa trị V, ta có các bước:
- Viết P trước, O sau
- Hóa trị P là V, O là II
- Cần 5/2 nguyên tử O để cân bằng hóa trị
- Nhân đôi để được số nguyên: P2O5
Tương tự với crom hóa trị VI:
- Viết Cr trước, O sau
- Hóa trị Cr là VI, O là II
- Cần 3 nguyên tử O để cân bằng
- Công thức cuối: CrO3
Tính chất và phản ứng hóa học của oxit axit
Oxit axit là những hợp chất quan trọng trong hóa học, thường được tạo thành từ phi kim với oxi. Chúng có vai trò đặc biệt trong nhiều quá trình công nghiệp như sản xuất công thức bột ngọt và công thức axit oxalic.
Tính chất vật lý của oxit axit
Ở điều kiện thường, oxit axit tính chất vật lý đa dạng. Một số tồn tại ở dạng khí như SO2, CO2, NO2. Số khác là chất rắn như P2O5, SiO2.
Các oxit axit thường có màu sắc đặc trưng. SO2 không màu, NO2 màu nâu đỏ. Điều thú vị là chúng thường có mùi hắc như SO3.
Phản ứng với nước tạo axit
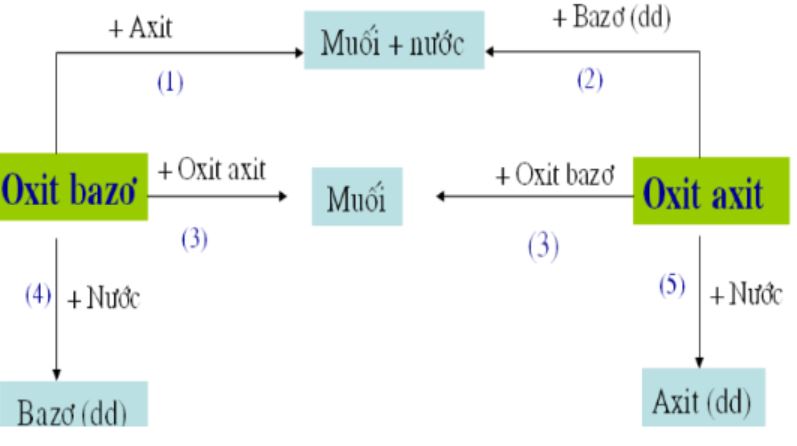
Oxit axit tác dụng với nước tạo thành axit tương ứng. Đây là phản ứng quan trọng trong công nghiệp sản xuất axit.
Ví dụ phản ứng điển hình:
SO3 + H2O → H2SO4
CO2 + H2O → H2CO3
P2O5 + 3H2O → 2H3PO4
Phản ứng với bazơ và oxit bazơ
Oxit axit tác dụng với bazơ và oxit axit tác dụng với oxit bazơ tạo muối. Các phản ứng này thường xảy ra nhanh và hoàn toàn.
Phương trình phản ứng với bazơ
Phản ứng với bazơ tạo muối và nước:
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2KOH → K2SO3 + H2O
Quá trình này được ứng dụng trong sản xuất công thức ete và nhiều hợp chất hữu cơ khác.
Phương trình phản ứng với oxit bazơ
Phản ứng với oxit bazơ chỉ tạo muối:
CO2 + CaO → CaCO3
SO3 + Na2O → Na2SO4
Phản ứng này đơn giản hơn so với phản ứng với bazơ vì không tạo nước.
Ứng dụng của oxit axit trong thực tế
Oxit axit đóng vai trò quan trọng trong nhiều lĩnh vực khác nhau. Các công thức hóa học của oxit axit như SO2, CO2, NO2 thường xuất hiện trong công nghiệp và đời sống.
Vai trò trong công nghiệp hóa chất
Trong sản xuất công nghiệp, oxit axit là nguyên liệu không thể thiếu để tạo ra nhiều sản phẩm quan trọng. Chẳng hạn như công thức criolit Na3AlF6 được điều chế từ oxit nhôm Al2O3.
SO3 được sử dụng làm nguyên liệu sản xuất axit sunfuric – một hóa chất công nghiệp thiết yếu. Quá trình này tạo ra axit lactic là gì và các axit quan trọng khác.
Trong ngành dược phẩm, oxit axit tham gia vào quá trình tổng hợp thuốc. Ví dụ như công thức của paracetamol cần đến sự tham gia của NO2.
Ứng dụng trong đời sống hàng ngày
CO2 là oxit axit phổ biến nhất trong cuộc sống. Nó được dùng làm chất tạo bọt trong nước giải khát và làm lạnh thực phẩm.
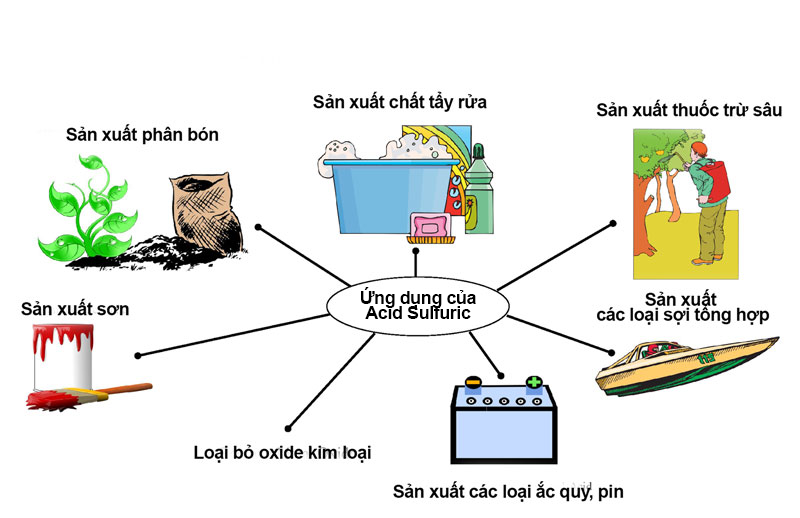
SO2 có tác dụng bảo quản thực phẩm, diệt khuẩn trong sản xuất rượu vang. Tôi thường khuyên học sinh tìm hiểu thêm về ứng dụng này.
Ngoài ra, oxit axit còn được sử dụng trong sản xuất phân bón, thuốc tẩy và các sản phẩm tẩy rửa. Điều này cho thấy tầm quan trọng của chúng trong đời sống.
FAQ: Câu hỏi thường gặp về oxit axit
Oxit axit là một chủ đề quan trọng trong chương trình hóa học phổ thông. Tôi sẽ giải đáp những thắc mắc phổ biến nhất về công thức oxit axit và cách phân biệt chúng.
Phân biệt oxit axit và oxit bazơ
Oxit axit và oxit bazơ có những đặc điểm khác biệt rõ rệt về cấu tạo và tính chất. Oxit axit thường được tạo thành từ phi kim với oxi, có tính axit và tác dụng với bazơ tạo muối.
Oxit bazơ được tạo thành từ kim loại với oxi, có tính bazơ và tác dụng với axit tạo muối. Ví dụ SO3 là oxit axit còn CaO là oxit bazơ.
Một cách dễ nhớ là oxit của phi kim thường là oxit axit, còn oxit của kim loại thường là oxit bazơ.
Cách nhớ công thức oxit axit hiệu quả
Để nhớ công thức oxit axit, ta cần nắm quy tắc: Số oxi trong phân tử thường bằng hoá trị của phi kim cộng thêm 1-2 đơn vị.
Ví dụ với lưu huỳnh có hoá trị 4, ta có SO3 (số oxi = 3). Với photpho có hoá trị 5, ta có P2O5 (số oxi = 5).
Một mẹo tôi thường chia sẻ với học sinh là vẽ sơ đồ tư duy kết nối phi kim với số oxi tương ứng.
Các lỗi thường gặp khi viết công thức oxit axit
Lỗi phổ biến nhất là viết sai số oxi trong phân tử. Nhiều học sinh nhầm lẫn giữa hoá trị của phi kim với số oxi.
Một số em quên quy tắc viết chỉ số dưới khi có nhiều nguyên tử. Thay vì viết P2O5 lại viết thành PO5 hoặc P2O.
Để tránh sai sót, cần kiểm tra kỹ 3 yếu tố: Phi kim có mặt trong phân tử, số oxi phù hợp và cách viết chỉ số.
Việc nắm vững các công thức oxit axit giúp học sinh hiểu rõ bản chất và tính chất của nhóm chất này. Oxit axit có vai trò quan trọng trong phản ứng với nước tạo axit và phản ứng trung hòa với bazơ. Các phương trình phản ứng đặc trưng và ứng dụng thực tế của oxit axit là kiến thức nền tảng trong chương trình hóa học phổ thông. Học sinh cần ghi nhớ cách viết công thức, quy tắc đặt tên và các phản ứng hóa học cơ bản của oxit axit.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

