Công thức Lewis là gì? Cách viết công thức Lewis dễ hiểu và chi tiết nhất
Bài viết dưới đây hướng dẫn chi tiết cách viết công thức Lewis theo chương trình mới, không chỉ giúp bạn nắm vững kiến thức lý thuyết mà còn thực hành viết được công thức Lewis của nhiều hợp chất phổ biến. Bài viết sẽ trang bị cho bạn những kỹ năng cần thiết để hiểu rõ cấu trúc electron, từ đó áp dụng hiệu quả vào việc học tập và nghiên cứu hóa học.
Công thức Lewis là gì?
Công thức Lewis là công thức biểu diễn cấu tạo phân tử qua các liên kết và các electron hóa trị riêng. Khi thay mỗi cặp electron dùng chung trong công thức electron bằng một gạch nối (-) ta được công thức Lewis.
Các cách viết công thức Lewis
Dưới đây là các cách viết công thức Lewis cho các bạn học sinh:
Cách 1: Viết công thức Lewis dựa vào công thức electron
Bước đầu tiên, bạn cần viết công thức electron, thể hiện tất cả các electron liên kết và electron tự do của các nguyên tử trong phân tử. Sau khi đã có công thức electron, bạn tiến hành thay thế mỗi cặp electron dùng chung giữa hai nguyên tử bằng một gạch nối (–), đại diện cho một liên kết cộng hóa trị.
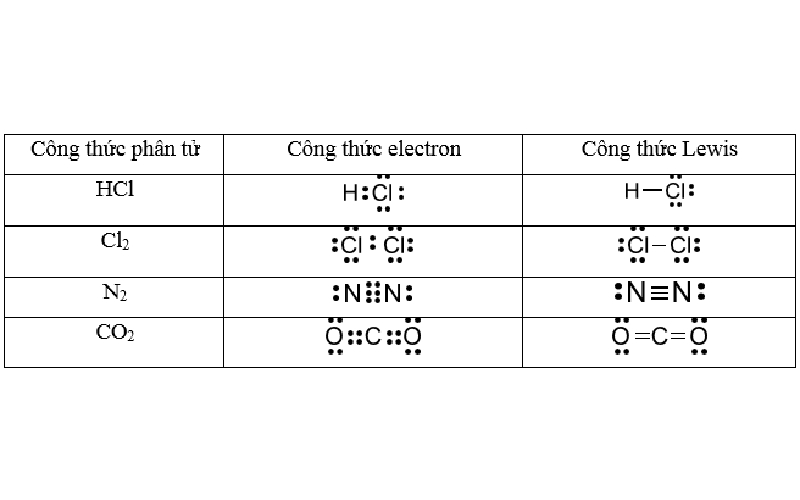
Khi hoàn tất, bạn sẽ có công thức Lewis, thể hiện rõ các liên kết giữa các nguyên tử trong phân tử và các cặp electron không tham gia liên kết.
Cách 2: Xác định công thức Lewis khi biết công thức phân tử
Bước 1: Tính tổng số electron hóa trị
Cộng tổng số electron hóa trị của tất cả các nguyên tử trong phân tử.
Bước 2: Xác định nguyên tử trung tâm và vẽ khung
Chọn nguyên tử có độ âm điện thấp hơn làm trung tâm và vẽ các liên kết đơn với các nguyên tử xung quanh.
Bước 3: Hoàn thiện octet
Tính số electron còn lại sau khi hình thành các liên kết đơn, sau đó hoàn thiện octet cho các nguyên tử xung quanh (trừ hydro). Nếu còn electron dư, thêm chúng vào nguyên tử trung tâm.
Bước 4: Điều chỉnh liên kết
Nếu nguyên tử trung tâm chưa đạt octet, chuyển cặp electron chưa liên kết thành liên kết đôi hoặc ba.
Ví dụ
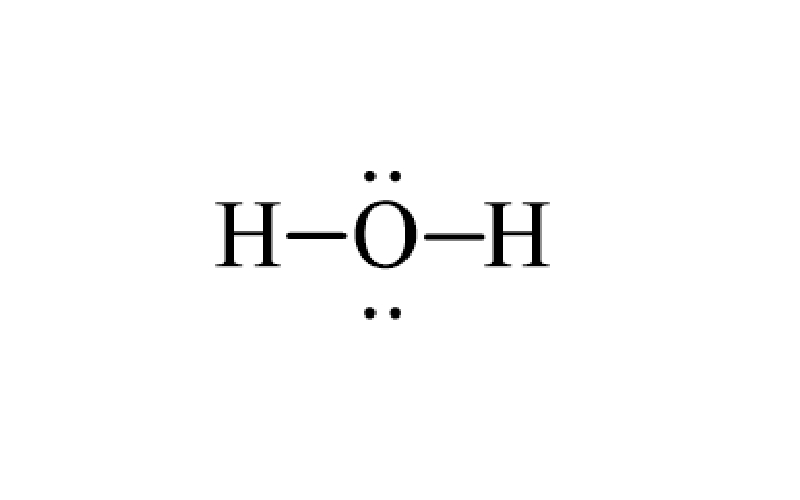
Viết công thức Lewis của phân tử H2O như sau:
Bước 1: Tính tổng số electron hóa trị
Oxy (O) có 6 electron hóa trị, và mỗi nguyên tử hydro (H) có 1 electron hóa trị. Trong phân tử H₂O, có 1 nguyên tử O và 2 nguyên tử H.
Tổng số electron hóa trị = 6 + (1 × 2) = 8 electron.
Bước 2: Xác định nguyên tử trung tâm và vẽ khung
Oxy (O) là nguyên tử trung tâm vì nó cần nhiều electron hơn để đạt octet, trong khi hydro chỉ cần 2 electron.
Vẽ các liên kết đơn giữa nguyên tử O và hai nguyên tử H:
H – O – H
Bước 3: Tính số electron hóa trị chưa tham gia liên kết
Tổng số electron = 8, trong đó 4 electron đã tham gia vào 2 liên kết đơn (2 liên kết, mỗi liên kết dùng 2 electron).
Số electron chưa tham gia liên kết = 8 – 4 = 4 electron.
Bước 4: Hoàn thiện octet cho nguyên tử O bằng cách bổ sung 4 electron dưới dạng 2 cặp electron tự do xung quanh O.
Như vậy, công thức Lewis của H₂O là:
Công thức Lewis của một số chất thường gặp
Dưới đây là cách viết công thức Lewis của một số chất thường gặp
Công thức của CO2
Từ công thức electron của CO₂, ta thấy mỗi nguyên tử oxy liên kết với nguyên tử carbon bằng 2 cặp electron, hay còn gọi là liên kết đôi. Thay 2 cặp electron dùng chung giữa C và O bằng hai gạch nối “=”, ta được công thức Lewis của CO₂ như hình sau:
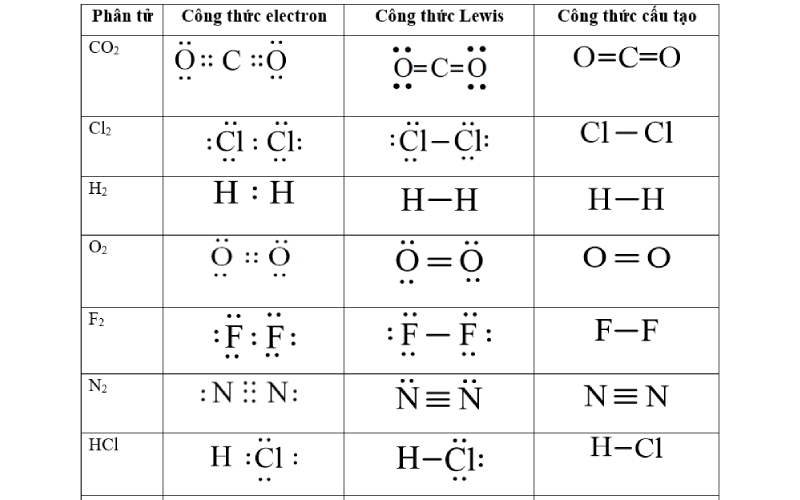
Công thức của Cl2
Mỗi nguyên tử clo (Cl) có 7 electron hóa trị. Trong phân tử Cl₂, hai nguyên tử clo sẽ chia sẻ 1 cặp electron để mỗi nguyên tử đều đạt đủ 8 electron (theo quy tắc octet). Như vậy, giữa hai nguyên tử Cl có một cặp electron dùng chung. Thay cặp electron chung giữa hai nguyên tử Cl bằng một gạch nối “–”.
Công thức của H2
Mỗi nguyên tử hydro (H) có 1 electron hóa trị. Trong phân tử H₂, hai nguyên tử hydro sẽ chia sẻ 1 cặp electron để mỗi nguyên tử đều đạt đủ 2 electron (đúng với quy tắc của hydro). Thay cặp electron dùng chung giữa hai nguyên tử H bằng một gạch nối “–”.
Công thức của O2
Mỗi nguyên tử oxy (O) có 6 electron hóa trị. Trong phân tử O₂, hai nguyên tử oxy liên kết với nhau bằng 2 cặp electron, tức là mỗi nguyên tử oxy chia sẻ 2 electron với nguyên tử oxy còn lại. Thay 2 cặp electron dùng chung giữa hai nguyên tử O bằng hai gạch nối “=”.
Công thức của F2
Mỗi nguyên tử F có 7 electron hóa trị. Trong phân tử F₂, có 2 nguyên tử F, và chúng sẽ chia sẻ 1 cặp electron để mỗi nguyên tử đều đạt đủ 8 electron (theo quy tắc octet). Thay cặp electron dùng chung giữa hai nguyên tử F bằng một gạch nối “–”.
Công thức của N2
Mỗi nguyên tử nitơ (N) có 5 electron hóa trị. Trong phân tử N₂, có 2 nguyên tử nitơ, và chúng sẽ chia sẻ 3 cặp electron để mỗi nguyên tử đạt được quy tắc octet. Thay 3 cặp electron dùng chung giữa hai nguyên tử N bằng ba gạch nối.
Công thức của HCl
Nguyên tử hydro (H) có 1 electron hóa trị.
Nguyên tử clo (Cl) có 7 electron hóa trị.
Trong phân tử HCl, tổng số electron hóa trị = 1 (từ H) + 7 (từ Cl) = 8 electron.
Nguyên tử H sẽ liên kết với nguyên tử Cl bằng cách chia sẻ 1 cặp electron. Thay cặp electron dùng chung giữa H và Cl bằng một gạch nối “–” để biểu thị liên kết đơn.
Lời kết
Công thức Lewis là một công cụ quan trọng trong hóa học, giúp chúng ta hiểu rõ hơn về cấu trúc và liên kết của các phân tử. Bằng cách sử dụng công thức này, chúng ta có thể dễ dàng xác định cách các nguyên tử liên kết với nhau, từ đó suy ra tính chất hóa học và phản ứng của chúng.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

