Học thuộc công thức hóa học của thuốc tím KMnO4 và ứng dụng thực tế
Công thức hóa học của thuốc tím KMnO4 là hợp chất vô cơ phổ biến trong đời sống. Chất này có màu tím đặc trưng và tính oxi hóa mạnh. Bài viết phân tích chi tiết cấu tạo, tính chất và cách sử dụng thuốc tím an toàn. Các ứng dụng quan trọng của KMnO4 trong y tế và công nghiệp được trình bày đầy đủ.
Công thức hóa học của thuốc tím là gì?
Thuốc tím có công thức hóa học của thuốc tím là KMnO4 (Kali permanganat). Đây là một hợp chất vô cơ phổ biến trong phòng thí nghiệm và đời sống.
Cấu tạo của KMnO4 gồm ion K+ và ion permanganat MnO4-. Trong đó mangan có hóa trị +7, là hóa trị cao nhất của nguyên tố này.
Thuốc tím có dạng tinh thể màu tím đậm, dễ tan trong nước tạo dung dịch màu tím đặc trưng. Khi pha loãng, dung dịch có màu hồng tím nhạt.
Trong quá trình giảng dạy, tôi thường ví von KMnO4 như một “siêu anh hùng” trong thế giới hóa học. Nó có khả năng oxi hóa mạnh mẽ và được ứng dụng rộng rãi.
Một lưu ý quan trọng khi sử dụng thuốc tím là cần pha loãng đúng nồng độ. Nồng độ thường dùng để sát trùng là 0,01-0,1%. Nồng độ cao có thể gây bỏng da.
Tôi thường nhắc học sinh ghi nhớ công thức KMnO4 qua câu: “Kali Mangan Oxi bốn – Tím đậm như màu hoàng hôn”. Cách này giúp các em nhớ lâu và hiệu quả hơn.
Cấu tạo và tính chất của thuốc tím KMnO4
Thuốc tím là một hợp chất vô cơ có công thức hóa học KMnO4 (kali permanganat). Đây là chất rắn màu tím đậm với tính oxi hóa mạnh, thường được sử dụng làm chất khử trùng.
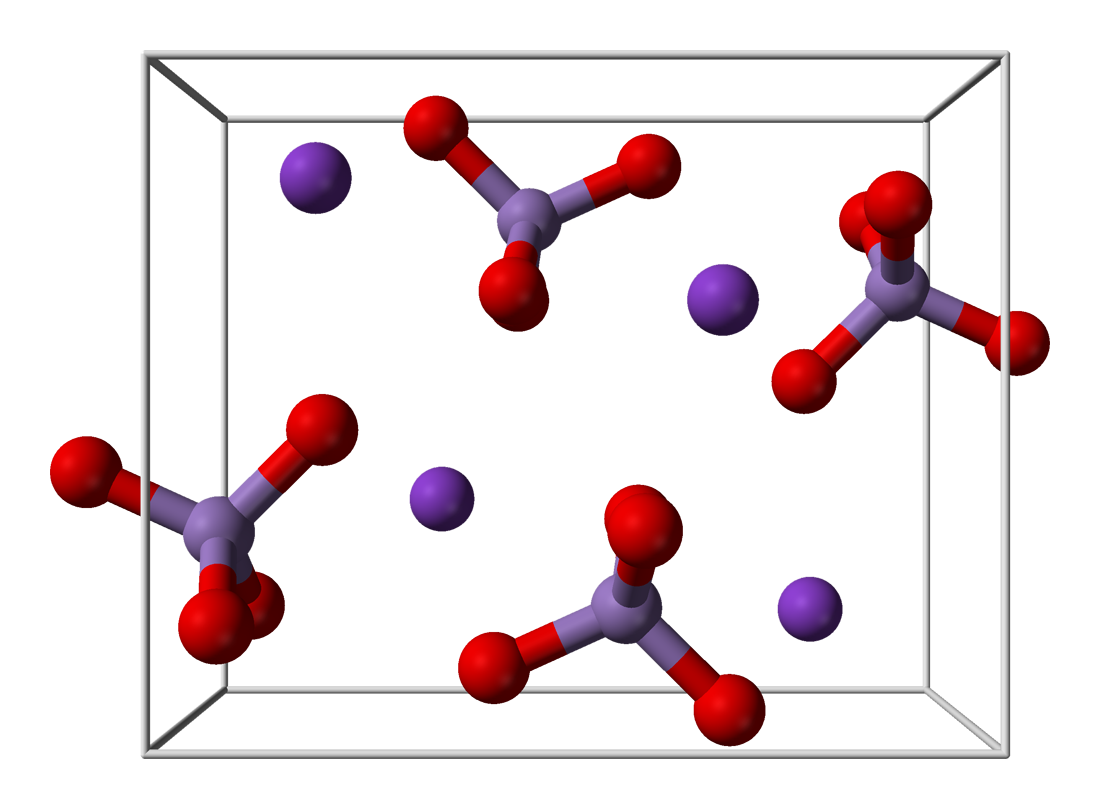
Cấu trúc phân tử của kali permanganat
Phân tử KMnO4 có cấu trúc ion gồm K+ và MnO4-. Ion permanganat MnO4- có dạng tứ diện với mangan ở tâm và 4 nguyên tử oxi ở 4 đỉnh.
Liên kết Mn-O trong ion MnO4- là liên kết cộng hóa trị có độ dài trung bình 1.629 Å. Góc liên kết O-Mn-O xấp xỉ 109.5°, tạo nên cấu trúc tứ diện đều.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc ô được mở ra với mangan ở giữa và 4 nguyên tử oxi tạo thành 4 cạnh đều nhau.
Tính chất vật lý của thuốc tím

Kali permanganat tồn tại ở dạng tinh thể màu tím đậm ánh kim với khối lượng riêng 2.7 g/cm3.
Chất này tan tốt trong nước tạo dung dịch màu tím đặc trưng. Độ tan của nó tăng theo nhiệt độ, từ 6.4g/100ml ở 20°C lên đến 25g/100ml ở 65°C.
Khi nhiệt độ tăng cao trên 240°C, KMnO4 sẽ phân hủy thành K2MnO4, MnO2 và O2. Đây là phản ứng tôi thường làm thí nghiệm minh họa cho học sinh.
Tính chất hóa học đặc trưng
KMnO4 là chất oxi hóa mạnh trong cả môi trường axit, trung tính và bazơ. Tương tự như công thức hóa học của quỳ tím, nó có khả năng đổi màu đặc trưng.
Trong môi trường axit, KMnO4 bị khử thành ion Mn2+ không màu:
MnO4- + 8H+ + 5e- → Mn2+ + 4H2O
Trong môi trường trung tính hoặc bazơ yếu, nó bị khử thành MnO2 màu nâu:
MnO4- + 2H2O + 3e- → MnO2 + 4OH-
Những phản ứng này rất quan trọng trong phân tích định tính và định lượng các chất khử trong dung dịch.
Hướng dẫn pha và sử dụng thuốc tím an toàn
Thuốc tím KMnO4 là hóa chất có tính oxy hóa mạnh, được sử dụng phổ biến trong khử trùng và sát khuẩn. Tuy nhiên, việc sử dụng không đúng cách có thể gây nguy hiểm.

Để sử dụng thuốc tím hiệu quả và an toàn, cần nắm rõ cách pha thuốc tím đúng nồng độ cùng các lưu ý quan trọng trong quá trình sử dụng và bảo quản.
Cách pha thuốc tím đúng nồng độ
Nồng độ thuốc tím phù hợp để sát khuẩn là 0,01-0,1%. Để pha được dung dịch này, cần:
Bước 1: Chuẩn bị dụng cụ sạch như cốc thủy tinh, que khuấy và nước sạch.
Bước 2: Cho 1-2 viên thuốc tím vào 1 lít nước, khuấy đều cho tan hoàn toàn.
Bước 3: Kiểm tra màu dung dịch – màu hồng nhạt là phù hợp để sử dụng, màu tím đậm cần pha loãng thêm.
Lưu ý khi sử dụng thuốc tím
Thuốc tím có thể gây bỏng da và niêm mạc nếu nồng độ quá cao. Dựa trên kinh nghiệm 20 năm giảng dạy, tôi khuyến cáo:
Không để thuốc tím tiếp xúc trực tiếp với da, mắt và niêm mạc.
Sử dụng găng tay cao su khi pha và sử dụng thuốc tím.
Rửa sạch ngay bằng nước nếu vô tình để thuốc tím dính vào da.
Bảo quản thuốc tím đúng cách
Thuốc tím cần được bảo quản trong hộp kín, tránh ánh nắng trực tiếp và nhiệt độ cao. Đặt ở nơi khô ráo, thoáng mát và xa tầm tay trẻ em.
Không để thuốc tím gần các chất dễ cháy vì có thể gây phản ứng nguy hiểm. Kiểm tra định kỳ và loại bỏ thuốc tím đã biến màu hoặc vón cục.
Công thức hóa học của thuốc tím KMnO4 cần được ghi nhớ để hiểu rõ tính chất và cách sử dụng an toàn của hóa chất này.
Ứng dụng của thuốc tím trong đời sống và công nghiệp
Thuốc tím hóa học là một trong những hóa chất quan trọng với nhiều ứng dụng đa dạng. Tôi sẽ phân tích chi tiết các ứng dụng chính của KMnO4 trong các lĩnh vực khác nhau.
Thuốc tím trong y tế và khử trùng
KMnO4 được sử dụng rộng rãi trong y tế nhờ khả năng sát khuẩn mạnh. Tôi thường khuyên học sinh pha loãng thuốc tím với nồng độ 0.01% để rửa vết thương nhẹ.
Trong bệnh viện, dung dịch KMnO4 1-3% được dùng để khử trùng dụng cụ y tế. Tính chất oxy hóa mạnh giúp tiêu diệt vi khuẩn, nấm và virus hiệu quả.
Ngoài ra, thuốc tím còn được sử dụng để điều trị một số bệnh ngoài da như chốc lở, nấm.
Ứng dụng trong phân tích hóa học
KMnO4 là chất chuẩn độ quan trọng trong phân tích định lượng. Tôi thường dùng nó để xác định hàm lượng Fe2+ trong mẫu nước.
Phản ứng chuẩn độ với KMnO4 có điểm cuối rõ ràng nhờ màu tím đặc trưng. Điều này giúp việc xác định kết quả trở nên chính xác.
Trong phòng thí nghiệm, KMnO4 còn được dùng để kiểm tra độ tinh khiết của nhiều hợp chất hữu cơ.
Các ứng dụng khác của KMnO4
Trong công nghiệp, công thức thuốc tím KMnO4 được ứng dụng để tẩy trắng giấy và vải sợi. Nó cũng được dùng để xử lý nước thải công nghiệp.

KMnO4 có vai trò quan trọng trong việc loại bỏ sắt và mangan trong nước sinh hoạt. Quá trình này giúp cải thiện chất lượng nước đáng kể.
Trong nông nghiệp, dung dịch KMnO4 loãng được phun để diệt nấm bệnh trên cây trồng. Tuy nhiên cần tuân thủ nồng độ để tránh ảnh hưởng đến cây.
FAQ: Câu hỏi thường gặp về thuốc tím
Thuốc tím là một hợp chất hóa học phổ biến trong đời sống. Tôi thường nhận được nhiều câu hỏi từ học sinh về tính chất và cách sử dụng an toàn của nó. Dưới đây là những thông tin quan trọng mà bạn cần biết về thuốc tím hóa trị và công thức KMnO4.
Thuốc tím có độc không?
Thuốc tím có tính độc ở nồng độ cao. Khi tiếp xúc trực tiếp với da, nó có thể gây bỏng rát và để lại vết thâm tím.
Tôi đã từng chứng kiến một số trường hợp học sinh bị bỏng do tiếp xúc với thuốc tím đậm đặc trong phòng thí nghiệm. Vì vậy cần hết sức thận trọng khi sử dụng.
Nồng độ thuốc tím an toàn là bao nhiêu?
Nồng độ thuốc tím an toàn để sát khuẩn thông thường là 0.01% – 0.02%. Đây là nồng độ tôi thường hướng dẫn học sinh pha để thực hành.
Với nồng độ này, thuốc tím vẫn đảm bảo hiệu quả sát khuẩn mà không gây kích ứng da. Tuyệt đối không dùng dung dịch thuốc tím quá 1%.
Cách xử lý khi bị thuốc tím bắn vào mắt
Bước 1: Rửa mắt ngay lập tức bằng nước sạch trong 15-20 phút.
Bước 2: Giữ mí mắt mở và để nước chảy từ trong ra ngoài.
Bước 3: Đến cơ sở y tế gần nhất để được thăm khám và điều trị.
Kinh nghiệm của tôi là luôn chuẩn bị sẵn bình rửa mắt khẩn cấp trong phòng thí nghiệm để xử lý các tình huống tương tự.
Kiến thức về công thức hóa học của thuốc tím KMnO4 là nền tảng quan trọng trong chương trình hóa học phổ thông. Thuốc tím có cấu trúc phân tử đặc biệt và tính chất hóa học đa dạng, tạo nên nhiều ứng dụng thiết thực trong y tế và công nghiệp. Việc nắm vững cách pha chế và sử dụng thuốc tím đúng cách giúp phát huy tối đa công dụng và đảm bảo an toàn cho người sử dụng.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

