Tìm hiểu công thức hóa học của sắt 3 clorua và ứng dụng thực tế
Công thức hóa học của sắt 3 clorua FeCl3 đóng vai trò quan trọng trong nhiều ngành công nghiệp. Hợp chất này có màu nâu đỏ đặc trưng và tính chất hóa học đa dạng. Các phản ứng của nó được ứng dụng rộng rãi trong xử lý nước và sản xuất công nghiệp.
Công thức hóa học của sắt 3 clorua
Sắt 3 clorua có công thức hóa học của sắt 3 clorua là FeCl3. Đây là một hợp chất vô cơ phổ biến trong phòng thí nghiệm và công nghiệp.
Trong phân tử FeCl3, sắt có hóa trị +3 và clo có hóa trị -1. Mỗi nguyên tử sắt liên kết với 3 nguyên tử clo tạo thành liên kết ion bền vững.
Công thức sắt 3 clorua FeCl3 có cấu tạo dạng tinh thể màu nâu đen hoặc dung dịch màu vàng nâu. Khi tan trong nước, nó tạo thành dung dịch có tính axit do xảy ra phản ứng thủy phân:
FeCl3 + 3H2O ⇌ Fe(OH)3 + 3HCl
Trong quá trình giảng dạy, tôi thường nhắc học sinh ghi nhớ số nguyên tử clo bằng cách liên hệ với hóa trị của sắt. Vì sắt có hóa trị +3 nên cần 3 nguyên tử clo để cân bằng điện tích.
Một mẹo nhỏ để phân biệt với sắt 2 clorua (FeCl2) là màu sắc đặc trưng. FeCl3 có màu nâu đen còn FeCl2 có màu xanh lục nhạt.

Cấu tạo và đặc điểm phân tử FeCl3
FeCl3 là một hợp chất vô cơ có tên gọi là sắt (III) clorua. Đây là một trong những hợp chất quan trọng của sắt được ứng dụng rộng rãi.
Về cấu tạo phân tử, FeCl3 có dạng phẳng tam giác với ion Fe3+ ở tâm và 3 ion Cl- ở 3 đỉnh. Góc liên kết Cl-Fe-Cl là 120° tạo nên cấu trúc đối xứng.
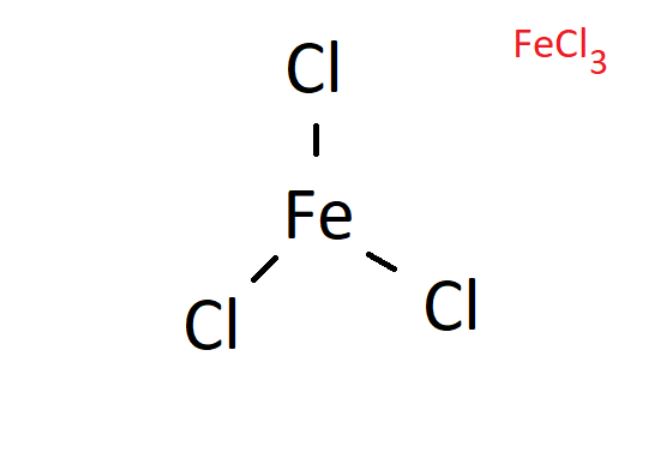
Trong phân tử FeCl3, liên kết giữa Fe và Cl là liên kết ion-cộng hóa trị. Điều này giải thích tại sao FeCl3 dễ dàng phân ly trong nước tạo thành dung dịch màu vàng nâu đặc trưng.
Khi nghiên cứu về các hợp chất của sắt, chúng ta cũng cần tìm hiểu thêm về công thức sắt 3 oxit để có cái nhìn toàn diện về các dạng hợp chất của sắt.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc FeCl3 như một chiếc quạt ba cánh, với Fe là trục quạt và 3 nguyên tử Cl như 3 cánh quạt xòe đều. Cách hình dung này giúp học sinh dễ nhớ và hiểu rõ cấu trúc phân tử.
Về đặc điểm vật lý, FeCl3 tồn tại ở dạng tinh thể màu nâu đen hoặc dạng ngậm nước màu vàng nâu. Hợp chất này có tính hút ẩm mạnh và tan rất tốt trong nước.
Tính chất vật lý và hóa học của sắt III clorua
Sắt III clorua là một hợp chất vô cơ quan trọng, được sử dụng rộng rãi trong công nghiệp và phòng thí nghiệm. Tôi sẽ phân tích chi tiết các tính chất đặc trưng của nó.

Tính chất vật lý đặc trưng
Sắt III clorua màu gì là câu hỏi thường gặp từ học sinh. FeCl3 khan có màu nâu đen, dạng tinh thể. Khi hút ẩm, nó chuyển sang màu vàng nâu.
Điểm nóng chảy của FeCl3 là 306°C và điểm sôi là 315°C. Chất này tan rất tốt trong nước, tạo dung dịch màu vàng nâu đặc trưng.
Trong quá trình giảng dạy, tôi thường ví von FeCl3 như “chàng trai nghiện nước” – rất dễ hút ẩm và tan trong nước.
Các phản ứng hóa học quan trọng
Phản ứng của FeCl3 với các chất khác rất đa dạng và thú vị. Với bazơ, nó tạo kết tủa Fe(OH)3 màu nâu đỏ:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Với kim loại hoạt động hơn Fe, phản ứng thế xảy ra mạnh mẽ:
2FeCl3 + Cu → 2FeCl2 + CuCl2
Kinh nghiệm của tôi là luôn nhắc học sinh chú ý số oxi hóa của Fe thay đổi từ +3 về +2.
Sự phân ly trong dung dịch nước
Sắt 3 clorua trong nước phân ly theo từng giai đoạn:
FeCl3 ⇄ Fe3+ + 3Cl-
Fe3+ + H2O ⇄ FeOH2+ + H+
FeOH2+ + H2O ⇄ Fe(OH)2+ + H+
Do phản ứng thủy phân mạnh, dung dịch có tính axit (pH < 7). Đây là lý do FeCl3 được dùng làm chất đông tụ trong xử lý nước.
Phương pháp điều chế và sản xuất FeCl3
Công thức hóa học của sắt 3 clorua là FeCl3, một hợp chất vô cơ quan trọng trong công nghiệp và nghiên cứu. Có hai phương pháp chính để tạo ra hợp chất này với quy mô và mục đích sử dụng khác nhau.

Điều chế trong phòng thí nghiệm
Phương pháp phổ biến nhất là cho sắt phản ứng trực tiếp với khí clo ở nhiệt độ cao. Phản ứng diễn ra theo phương trình:
2Fe + 3Cl2 → 2FeCl3
Một phương pháp khác là cho dung dịch axit clohidric tác dụng với sắt(III) oxit:
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý điều kiện nhiệt độ và nồng độ axit để phản ứng xảy ra hoàn toàn.
Quy trình sản xuất công nghiệp
Trong công nghiệp, FeCl3 được sản xuất bằng cách cho dung dịch axit clohidric tác dụng với quặng sắt. Phương trình phản ứng tổng quát:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Sau đó, FeCl2 được oxi hóa thành FeCl3 bằng clo:
2FeCl2 + Cl2 → 2FeCl3
Quy trình này được kiểm soát chặt chẽ về nhiệt độ và áp suất để đảm bảo hiệu suất cao. Sản phẩm thường được tinh chế qua quá trình kết tinh để đạt độ tinh khiết cần thiết.
Ứng dụng của sắt III clorua trong đời sống và công nghiệp
Sắt III clorua là một hợp chất vô cơ quan trọng với nhiều ứng dụng thiết thực. Hợp chất này có khả năng tạo kết tủa công thức của sắt 3 hiđroxit khi gặp môi trường bazơ. Đặc tính này giúp nó trở thành chất xử lý hiệu quả trong nhiều lĩnh vực.
Ứng dụng trong xử lý nước
Sắt III clorua đóng vai trò chất keo tụ chính trong các nhà máy xử lý nước thải. Khi hòa tan trong nước, nó tạo thành các ion Fe3+ có khả năng hấp phụ các chất bẩn.
Quá trình này giúp loại bỏ các chất ô nhiễm, kim loại nặng và vi sinh vật gây bệnh. Hiệu quả xử lý có thể đạt tới 95% với liều lượng phù hợp.

Theo nghiên cứu của Viện Công nghệ Môi trường, sắt III clorua còn giúp khử màu và mùi hiệu quả trong nước thải công nghiệp dệt nhuộm.
Ứng dụng trong công nghiệp
Trong ngành điện tử, dung dịch sắt III clorua được dùng để ăn mòn đồng trên mạch in. Quá trình này tạo ra các đường mạch điện chính xác.
Ngành công nghiệp dược phẩm sử dụng hợp chất này làm chất xúc tác trong tổng hợp nhiều loại thuốc. Nó tham gia vào phản ứng oxi hóa khử quan trọng.
Các nhà máy sản xuất pin cũng cần sắt III clorua để tạo lớp phủ bảo vệ điện cực. Lớp phủ này giúp tăng tuổi thọ và hiệu suất pin.
Các ứng dụng khác
Trong phòng thí nghiệm, sắt III clorua là thuốc thử quan trọng để phát hiện ion phenolat. Phản ứng tạo màu tím đặc trưng giúp định tính các hợp chất phenol.
Ngành công nghiệp dệt may sử dụng hợp chất này làm chất cầm màu. Nó giúp các phẩm màu bám chắc vào sợi vải và không bị phai màu khi giặt.
Các cơ sở sản xuất gốm sứ dùng sắt III clorua tạo men màu nâu đỏ đặc trưng. Màu sắc này bền vững qua nhiều chu kỳ nung ở nhiệt độ cao.
FAQ: Câu hỏi thường gặp về sắt III clorua
Tôi sẽ giải đáp những thắc mắc phổ biến về hợp chất sắt III clorua mà học sinh thường gặp phải.
- Công thức hóa học của sắt 3 clorua là gì?
Sắt III clorua có công thức hóa học là FeCl3. Đây là một hợp chất vô cơ gồm ion Fe3+ và 3 ion Cl-.
- Cách viết công thức FeCl3 theo quy tắc hóa học?
Khi viết công thức, ion Fe3+ được viết trước và ion Cl- viết sau. Số 3 được viết dưới dạng chỉ số dưới để thể hiện tỉ lệ ion clo.
- Sắt 3 clorua tên gọi khác trong hóa học?
Ngoài tên thông thường là sắt III clorua, hợp chất này còn được gọi là ferric chloride hoặc iron(III) chloride trong tiếng Anh.
- Sắt III clorua có màu gì?
Ở dạng khan, FeCl3 có màu nâu đen. Khi hòa tan trong nước tạo dung dịch màu vàng nâu đặc trưng.
- Tại sao FeCl3 có tính oxi hóa mạnh?
Do ion Fe3+ có khả năng nhận electron để chuyển thành Fe2+, làm cho FeCl3 trở thành chất oxi hóa mạnh trong nhiều phản ứng hóa học.
Kiến thức về công thức hóa học của sắt 3 clorua đóng vai trò quan trọng trong chương trình hóa học phổ thông. FeCl3 là một hợp chất vô cơ với cấu tạo đặc biệt và tính chất đa dạng. Hợp chất này có nhiều ứng dụng thiết thực trong xử lý nước, công nghiệp và đời sống. Việc nắm vững cấu tạo, tính chất và phương pháp điều chế FeCl3 giúp học sinh tiếp cận tốt hơn với môn hóa học.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

