Kiến thức về công thức hóa học của sắt 2 hiđroxit và tính chất ứng dụng
Công thức hóa học của sắt 2 hiđroxit là một chất quan trọng trong hóa học vô cơ. Hợp chất này tồn tại dưới dạng kết tủa màu trắng xanh đặc trưng. Fe(OH)2 tham gia nhiều phản ứng hóa học cơ bản và ứng dụng rộng rãi trong công nghiệp.
Công thức hóa học của sắt 2 hiđroxit
Sắt (II) hiđroxit là một hợp chất vô cơ có màu xanh lục nhạt, tồn tại dưới dạng kết tủa keo.
Công thức hóa học của sắt 2 hiđroxit là Fe(OH)2. Trong đó:
- Fe: nguyên tử sắt có hóa trị II
- OH: gốc hiđroxit
- Chỉ số 2: số gốc hiđroxit liên kết với 1 nguyên tử sắt
Fe(OH)2 được tạo thành khi cho dung dịch bazơ mạnh tác dụng với muối sắt (II). Phương trình phản ứng điển hình:
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý Fe(OH)2 rất dễ bị oxi hóa. Khi để ngoài không khí, Fe(OH)2 sẽ chuyển từ màu xanh lục nhạt sang màu nâu đỏ do bị oxi hóa thành Fe(OH)3.
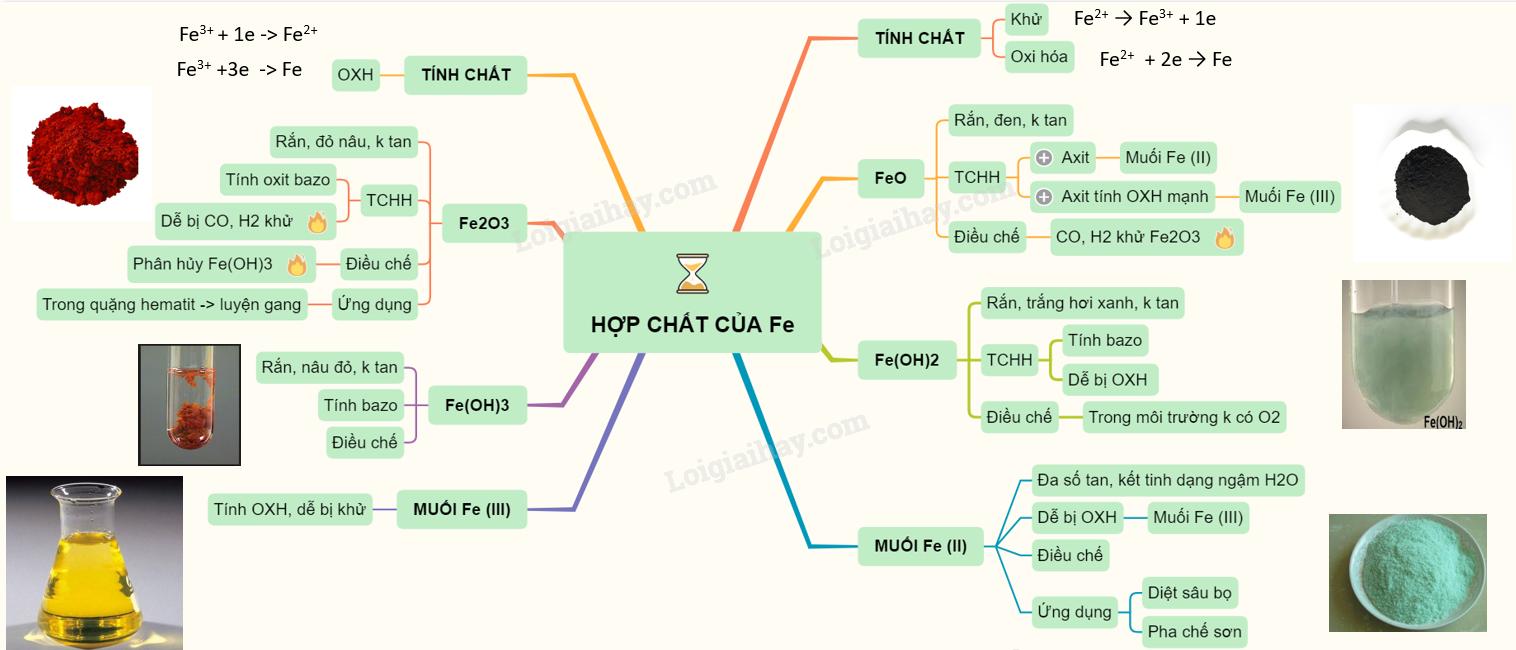
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Đây là phản ứng quan trọng giải thích hiện tượng gỉ sắt trong thực tế. Học sinh cần nắm vững để giải các bài tập về phản ứng oxi hóa – khử.
Cấu tạo và đặc điểm của Fe(OH)2 trong tự nhiên
Fe(OH)2 hay sắt II hidroxit là một hợp chất vô cơ quan trọng trong công nghiệp và đời sống. Hợp chất này có cấu tạo gồm ion Fe2+ liên kết với 2 nhóm OH-.
Tương tự như công thức canxi hidroxit là gì, Fe(OH)2 được tạo thành từ phản ứng của ion kim loại với ion hidroxit. Quá trình này diễn ra theo phương trình:
Fe2+ + 2OH- → Fe(OH)2
Cấu trúc phân tử Fe(OH)2
Trong phân tử Fe(OH)2, ion Fe2+ nằm ở trung tâm và liên kết với 2 nhóm OH- ở hai phía. Mỗi nhóm OH- gồm một nguyên tử O và một nguyên tử H.
Liên kết giữa Fe2+ và OH- là liên kết ion, còn liên kết O-H là liên kết cộng hóa trị có cực. Góc liên kết O-H-O là 104,5°.
Màu sắc và trạng thái vật lý của Fe(OH)2
Fe(OH)2 tồn tại ở dạng kết tủa màu trắng xanh khi mới tạo thành. Khi tiếp xúc với không khí, Fe(OH)2 dễ bị oxi hóa.
Quá trình oxi hóa làm Fe(OH)2 chuyển dần sang màu xanh rêu rồi nâu đỏ do tạo thành Fe(OH)3. Phản ứng diễn ra theo phương trình:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Độ tan của Fe(OH)2 trong nước và dung môi
Fe(OH)2 tan trong nước không tốt, độ tan chỉ khoảng 1,5 x 10-4 g/100ml nước ở 25°C. Độ tan này giảm khi nhiệt độ tăng.
Fe(OH)2 tan tốt trong dung dịch axit do phản ứng trung hòa tạo muối sắt (II) và nước. Ví dụ với axit HCl:
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Phương pháp điều chế và phản ứng tạo thành Fe(OH)2
Công thức hóa học của sắt 2 hiđroxit là Fe(OH)2, một hợp chất màu trắng xanh có tính bazơ. Fe(OH)2 được tạo thành qua nhiều phương pháp khác nhau.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ Fe(OH)2 qua màu sắc đặc trưng của nó. Khi mới tạo thành, kết tủa có màu trắng hơi xanh rất dễ nhận biết.
Phản ứng giữa muối sắt (II) với bazơ
Phương pháp phổ biến nhất để điều chế Fe(OH)2 là cho dung dịch muối sắt (II) tác dụng với dung dịch bazơ. Công thức sắt 2 sunfat thường được sử dụng làm muối sắt (II) đầu vào.
Phản ứng tạo Fe(OH)2 diễn ra theo phương trình:
FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
Kết tủa Fe(OH)2 màu trắng xanh tạo thành sẽ lắng xuống đáy bình phản ứng.
Phản ứng giữa sắt kim loại với nước
Fe(OH)2 có thể được tạo thành khi cho sắt kim loại tác dụng với nước ở nhiệt độ cao. Phản ứng này thường được thực hiện ở 700-800°C.
Phương trình phản ứng:
3Fe + 4H2O → Fe3O4 + 4H2 (t°)
Fe3O4 + H2O + H2 → 3Fe(OH)2
Các phương pháp điều chế khác
Fe(OH)2 còn được điều chế bằng phản ứng giữa công thức sắt 3 clorua với dung dịch kiềm trong môi trường khử.
Một phương pháp khác là điện phân dung dịch muối sắt (II) với điện cực sắt. Quá trình này tạo ra Fe(OH)2 tại catot theo phương trình:
Fe2+ + 2OH- → Fe(OH)2↓
Tuy nhiên Fe(OH)2 rất dễ bị oxi hóa trong không khí thành Fe(OH)3 nên cần bảo quản trong môi trường không có oxi.
Tính chất hóa học của Fe(OH)2
Fe(OH)2 là một bazơ yếu với nhiều tính chất hóa học đặc trưng. Tính chất Fe(OH)2 thể hiện rõ qua các phản ứng với axit, bazơ và khả năng oxi hóa khử. Công thức của sắt 2 hiđroxit là Fe(OH)2 – một chất rắn màu trắng xanh, ít tan trong nước.
Tính chất bazơ
Fe(OH)2 thể hiện tính bazơ yếu qua phản ứng với các axit mạnh. Khi tác dụng với dung dịch axit, Fe(OH)2 tạo thành muối sắt (II) và nước:
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý Fe(OH)2 không phản ứng với dung dịch bazơ. Điều này giúp phân biệt Fe(OH)2 với các hiđroxit lưỡng tính như công thức hóa học của sắt 3 oxit là.
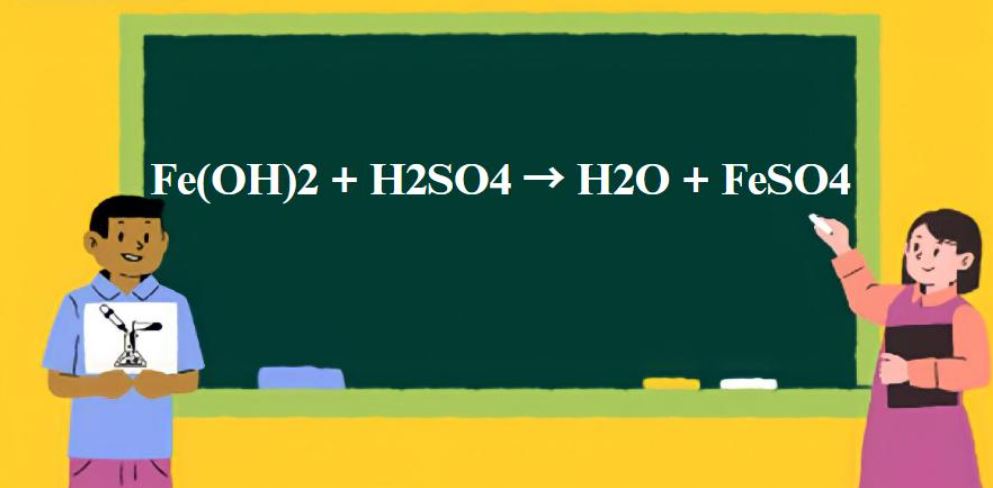
Phản ứng oxi hóa – khử
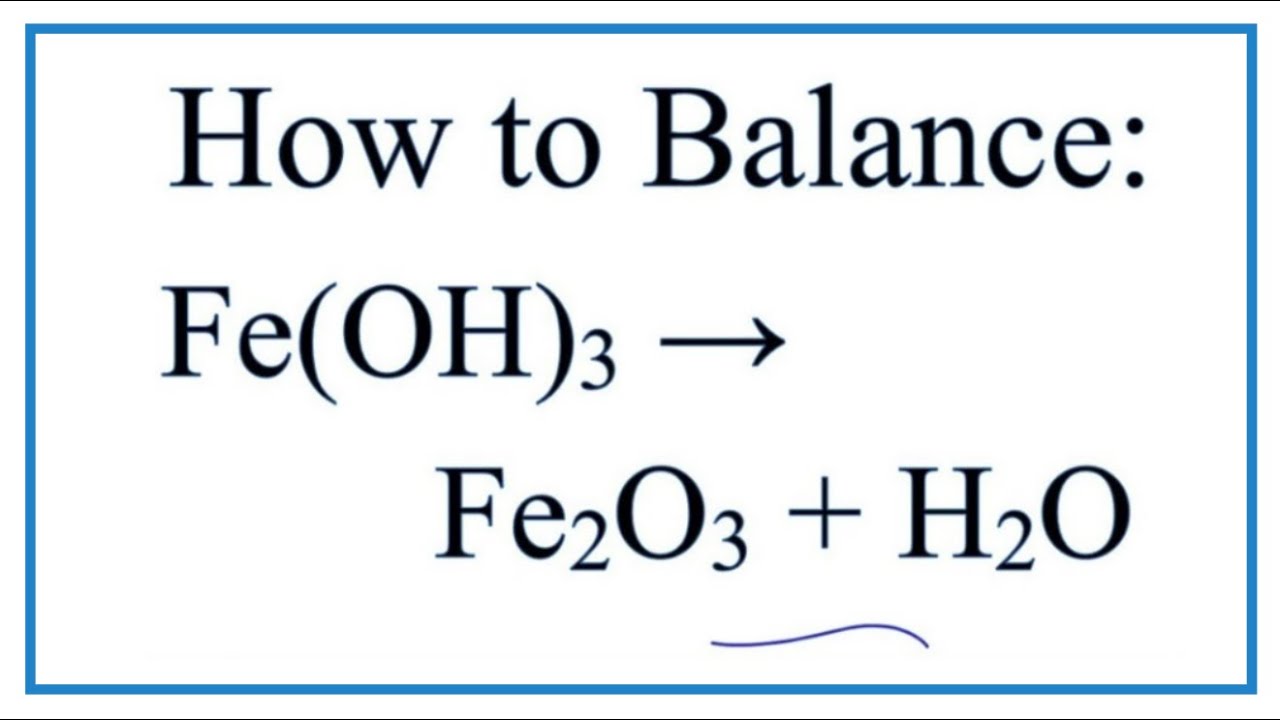
Fe(OH)2 dễ bị oxi hóa bởi oxi không khí thành công thức của sắt 3 hiđroxit. Phản ứng xảy ra theo phương trình:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Khi để dung dịch Fe(OH)2 ngoài không khí, màu trắng xanh ban đầu sẽ chuyển dần sang màu nâu đỏ. Đây là dấu hiệu nhận biết phản ứng oxi hóa đã xảy ra.
Phản ứng với axit
Fe(OH)2 tác dụng với các axit tạo thành muối sắt (II) tương ứng. Phản ứng xảy ra nhanh và hoàn toàn:
Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
Fe(OH)2 + 2CH3COOH → Fe(CH3COO)2 + 2H2O
Các muối sắt (II) tạo thành thường có màu xanh nhạt. Phản ứng này được ứng dụng trong phòng thí nghiệm để điều chế muối sắt (II).
Ứng dụng của Fe(OH)2 trong đời sống và công nghiệp
Fe(OH)2 là một hợp chất quan trọng với nhiều ứng dụng thiết thực. Hợp chất này được sử dụng rộng rãi trong công nghiệp và xử lý môi trường.
Xử lý nước thải
Fe(OH)2 đóng vai trò then chốt trong việc làm sạch nước thải công nghiệp. Hợp chất này có khả năng hấp phụ và kết tủa các ion kim loại nặng độc hại.
Khi thêm Fe(OH)2 vào nước thải, nó sẽ phản ứng với các ion kim loại tạo thành kết tủa. Quá trình này giúp loại bỏ hiệu quả các chất ô nhiễm như asen, chì và cadimi.
Theo nghiên cứu của Viện Công nghệ Môi trường, hiệu suất xử lý có thể đạt tới 95% đối với một số kim loại nặng.
Sản xuất sắt oxit từ
Oxit sắt từ có công thức là Fe3O4 được sản xuất từ Fe(OH)2 qua phản ứng oxi hóa. Quá trình này diễn ra khi nung nóng Fe(OH)2 trong điều kiện thiếu không khí.
Fe3O4 là nguyên liệu quan trọng trong sản xuất nam châm vĩnh cửu và vật liệu từ tính. Nó cũng được dùng làm chất màu trong sơn chống gỉ.
Các ứng dụng khác
Fe(OH)2 còn được sử dụng trong quá trình tuyển nổi quặng. Quặng pirit có công thức là FeS2 thường được tách chiết bằng phương pháp này.
Trong ngành dược phẩm, Fe(OH)2 là nguyên liệu sản xuất thuốc bổ sung sắt. Nó được chuyển hóa thành các dạng muối sắt dễ hấp thu.
Tôi thường ví von Fe(OH)2 như một “người lính” đa năng trong công nghiệp – vừa có thể làm sạch môi trường, vừa tạo ra các sản phẩm hữu ích khác.
FAQ: Câu hỏi thường gặp về Fe(OH)2
Các câu hỏi thường gặp về công thức hóa học của sắt 2 hiđroxit sẽ được giải đáp chi tiết dưới đây. Tôi đã tổng hợp từ kinh nghiệm giảng dạy và nghiên cứu nhiều năm.
Fe(OH)2 có độc không?
Fe(OH)2 không gây độc cấp tính cho cơ thể. Tuy nhiên khi tiếp xúc trực tiếp có thể gây kích ứng da và niêm mạc.
Nếu vô tình nuốt phải một lượng nhỏ Fe(OH)2 thì cơ thể sẽ chuyển hóa thành các ion Fe2+ và OH-.
Làm thế nào để bảo quản Fe(OH)2?
Fe(OH)2 cần được bảo quản trong bình kín, tránh tiếp xúc với không khí. Điều này giúp ngăn phản ứng oxi hóa thành Fe(OH)3.
Nhiệt độ bảo quản tốt nhất là 15-25°C trong môi trường khô ráo, thoáng mát.
Tránh để gần các chất oxi hóa mạnh và axit để đảm bảo an toàn khi sử dụng.
Fe(OH)2 có tác dụng với những chất nào?
Fe(OH)2 phản ứng mạnh với các axit tạo muối sắt (II) và nước. Ví dụ phản ứng với HCl:
Fe(OH)2 + 2HCl → FeCl2 + 2H2O
Fe(OH)2 còn bị oxi hóa bởi O2 trong không khí thành Fe(OH)3 màu nâu đỏ:
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
Ngoài ra Fe(OH)2 cũng tác dụng với dung dịch NH4Cl tạo kết tủa màu xanh.
Kiến thức về công thức hóa học của sắt 2 hiđroxit giúp các em nắm vững cấu tạo và tính chất của hợp chất quan trọng này. Fe(OH)2 là một bazơ yếu có màu trắng xanh, ít tan trong nước và dễ bị oxi hóa trong không khí. Hợp chất này được điều chế từ phản ứng giữa muối sắt (II) với bazơ và có nhiều ứng dụng thiết thực trong xử lý nước thải và sản xuất công nghiệp.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

