Kiến thức về công thức hóa học của oxi và phản ứng oxi hóa khử
Công thức hóa học của oxi đóng vai trò quan trọng trong mọi phản ứng oxi hóa khử. Oxi tồn tại phổ biến trong không khí dưới dạng phân tử hai nguyên tử. Phân tử này tham gia vào các quá trình hô hấp và đốt cháy nhiên liệu. Các phản ứng oxi hóa khử diễn ra thường xuyên trong tự nhiên và đời sống.
Công thức hóa học của oxi là O2
Oxi là một trong những nguyên tố phổ biến nhất trong tự nhiên. Công thức hóa học của oxi là O2 – một phân tử lưỡng nguyên tử.
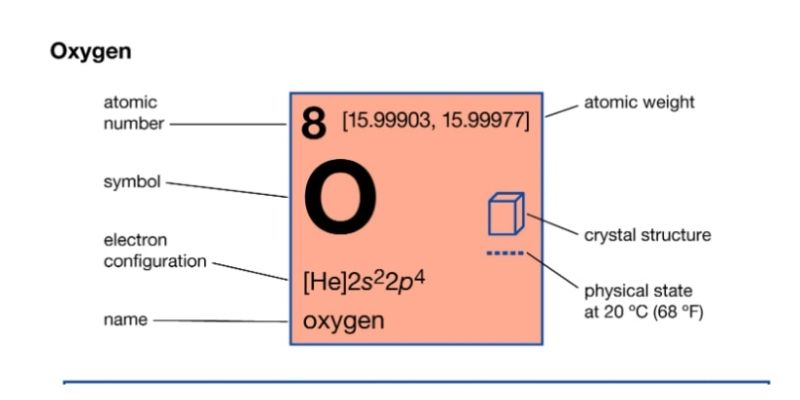
Trong không khí, công thức hóa học của oxygen O2 chiếm khoảng 21% thể tích. Phân tử oxi gồm 2 nguyên tử oxi liên kết với nhau bằng liên kết cộng hóa trị kép.
Công thức hoá học của oxi O2 thể hiện đặc điểm quan trọng của phân tử. Số 2 ở dưới biểu thị số nguyên tử oxi trong một phân tử. Điều này giúp phân biệt với ozon O3.
Trong quá trình giảng dạy, tôi thường ví von O2 như một cặp song sinh không thể tách rời. Hai nguyên tử oxi luôn đi cùng nhau tạo thành phân tử bền vững.
Một mẹo nhỏ để nhớ: Oxi là “người bạn đôi” – luôn tồn tại theo cặp. Khác với các nguyên tố như natri Na hay clo Cl2, oxi trong tự nhiên không tồn tại ở dạng đơn nguyên tử O.
Cấu tạo và tính chất của phân tử oxi trong tự nhiên
Công thức hóa học của khí oxi là O2 – một phân tử gồm 2 nguyên tử oxi liên kết với nhau. Đây là dạng phổ biến nhất của oxi trong tự nhiên và chiếm khoảng 21% thể tích không khí.
Oxi là nguyên tố hóa học thuộc nhóm VIA, có số hiệu nguyên tử 8 và khối lượng nguyên tử 16. Công thức oxi là gì thường được học sinh thắc mắc và câu trả lời đơn giản là O2 ở điều kiện thường.
Cấu tạo phân tử oxi
Phân tử oxi có cấu tạo đối xứng với liên kết cộng hóa trị không cực. Hai nguyên tử oxi liên kết với nhau bằng liên kết đôi.
Trong phân tử O2, mỗi nguyên tử oxi đóng góp 6 electron hóa trị. Hai nguyên tử chia sẻ 4 electron để tạo thành liên kết đôi bền vững.
Các dạng tồn tại của oxi trong tự nhiên
Oxi tồn tại chủ yếu ở dạng khí O2 trong công thức hóa học của không khí. Ngoài ra còn có dạng ozon O3 trong tầng bình lưu.
Oxi cũng tồn tại dưới dạng công thức oxy già H2O2 – một chất lỏng không màu có tính oxi hóa mạnh. Trong các hợp chất, oxi thường có số oxi hóa -2.
Vai trò của oxi trong sự sống
Oxi đóng vai trò thiết yếu trong quá trình hô hấp của sinh vật. Nó tham gia vào phản ứng oxi hóa glucose tạo ra năng lượng cho cơ thể.
Thực vật sử dụng oxi trong quá trình quang hợp để tạo ra glucose và giải phóng oxi. Đây là nguồn cung cấp oxi chính cho khí quyển.
Oxi còn tham gia vào nhiều quá trình chuyển hóa quan trọng khác trong cơ thể sinh vật như tổng hợp protein, phân hủy chất thải.
Phản ứng oxi hóa – khử và ứng dụng trong thực tế
Phản ứng oxi hóa khử là một trong những phản ứng hóa học quan trọng nhất. Nó diễn ra thường xuyên trong tự nhiên và đời sống.
Để hiểu rõ về phản ứng này, chúng ta sẽ tìm hiểu từ khái niệm cơ bản đến các ứng dụng thực tế.
Khái niệm về phản ứng oxi hóa khử
Phản ứng oxi hóa khử là gì? Đó là phản ứng trong đó có sự chuyển electron giữa các chất.
Trong phản ứng này luôn xảy ra đồng thời hai quá trình:
- Oxi hóa: Chất nhường electron
- Khử: Chất nhận electron
Ví dụ điển hình là phản ứng giữa kẽm và axit nitric có công thức hóa học là. Kẽm bị oxi hóa thành ion Zn2+ và nhường electron cho H+ để tạo thành H2.
Cách xác định số oxi hóa
Số oxi hóa là điện tích giả định của nguyên tử khi tham gia liên kết. Đây là cơ sở để xác định chất oxi hóa hay khử.

Quy tắc xác định số oxi hóa:
- Số oxi hóa của nguyên tố tự do bằng 0
- Tổng số oxi hóa trong phân tử trung hòa bằng 0
- Số oxi hóa của ion bằng điện tích của ion đó
Việc nắm vững các quy tắc này giúp dễ dàng cân bằng phương trình phản ứng oxi hóa khử.
Các dạng phản ứng oxi hóa khử phổ biến
Phản ứng tự oxi hóa khử xảy ra khi một chất vừa bị oxi hóa vừa bị khử. Điển hình là phản ứng phân hủy công thức hoá học của protein.
Phản ứng đơn giản là phản ứng giữa kim loại với phi kim. Ví dụ: Fe + Cl2 → FeCl2.
Phản ứng phức tạp thường xảy ra trong dung dịch với nhiều tác nhân tham gia. Chẳng hạn phản ứng giữa KMnO4 và HCl.
Ứng dụng của phản ứng oxi hóa khử
Trong công nghiệp, phản ứng này được ứng dụng để điều chế kim loại từ quặng. Quá trình luyện gang thép là một ví dụ tiêu biểu.
Trong đời sống, pin và ắc quy hoạt động dựa trên nguyên lý oxi hóa là gì – chuyển hóa năng lượng hóa học thành điện năng.
Trong y học, nhiều thuốc sát trùng như oxy già H2O2 hoạt động dựa trên cơ chế oxi hóa khử để tiêu diệt vi khuẩn.
Cách cân bằng phương trình oxi hóa khử
Phương trình oxi hóa khử là phương trình mô tả quá trình chuyển electron giữa các chất. Để cân bằng chính xác, ta có thể áp dụng 2 phương pháp chính.
Trước khi đi vào các phương pháp, cần hiểu rõ số oxi hóa là gì. Đây là con số quy ước thể hiện điện tích của nguyên tử trong phân tử hay ion.
Công thức hóa học của oxi thường là O2 ở điều kiện thường. Oxi đóng vai trò quan trọng trong các phản ứng oxi hóa khử.
Phương pháp thăng bằng electron
Phương pháp này dựa trên nguyên tắc số electron nhường bằng số electron nhận. Tôi thường hướng dẫn học sinh 3 bước:
Bước 1: Xác định chất oxi hóa và chất khử qua sự thay đổi số oxi hóa.
Bước 2: Viết nửa phương trình oxi hóa và khử.
Bước 3: Nhân hệ số để số electron nhường và nhận bằng nhau.
Phương pháp ion – electron
Phương pháp này phù hợp với môi trường axit và bazơ. Tôi thường liên hệ với công thức hóa học của cacbonic để minh họa.

Trong môi trường axit, ta cần cân bằng H+ và H2O.
Trong môi trường bazơ, ta cân bằng OH- và H2O.
Bài tập và ví dụ minh họa
Ví dụ 1: Fe + CuSO4 → FeSO4 + Cu
Áp dụng phương pháp thăng bằng electron:
Fe → Fe2+ + 2e (oxi hóa)
Cu2+ + 2e → Cu (khử)
Cân bằng: Fe + Cu2+ → Fe2+ + Cu
Ví dụ 2: Phản ứng tạo công thức xà phòng cũng là một ứng dụng của phản ứng oxi hóa khử.
Qua 20 năm giảng dạy, tôi nhận thấy việc thực hành nhiều bài tập sẽ giúp nắm vững phương pháp cân bằng.
FAQ: Câu hỏi thường gặp về oxi và phản ứng oxi hóa khử
Oxi là nguyên tố hóa học quan trọng trong tự nhiên và đời sống. Tôi thường nhận được nhiều câu hỏi từ học sinh về cách viết công thức oxi và các phản ứng liên quan.
Khi học về oxi, các em cần nắm rõ công thức hóa học của oxi là O2. Đây là dạng phân tử oxi thường gặp nhất trong không khí.
Câu hỏi 1: Oxi có thể tham gia phản ứng với những chất nào?
- Oxi phản ứng được với hầu hết kim loại và phi kim tạo thành oxit. Ví dụ như phản ứng với công thức xăng là gì tạo thành CO2 và H2O.
Câu hỏi 2: Tại sao carbohydrate công thức hóa học thường chứa nhiều oxi?
- Vì carbohydrate được tạo thành từ quá trình quang hợp, sử dụng CO2 và H2O làm nguyên liệu.
Câu hỏi 3: cấu tạo phân tử glucose có liên quan gì đến oxi?
- Glucose có công thức C6H12O6, chứa 6 nguyên tử oxi trong phân tử.
Câu hỏi 4: Oxi có tác dụng gì với công thức hóa học của bazơ?
- Oxi có thể oxi hóa một số bazơ tạo thành muối và nước. Ví dụ: 2NaOH + O2 → 2Na2O + H2O.
Câu hỏi 5: Làm sao phân biệt được phản ứng oxi hóa khử?
- Dựa vào sự thay đổi số oxi hóa của các nguyên tố trong phản ứng.
Kiến thức về công thức hóa học của oxi O2 là nền tảng quan trọng trong môn hóa học. Phân tử oxi có cấu tạo đặc biệt và đóng vai trò thiết yếu trong sự sống. Các phản ứng oxi hóa khử diễn ra phổ biến trong tự nhiên và công nghiệp, được ứng dụng rộng rãi trong đời sống. Việc nắm vững cách cân bằng phương trình oxi hóa khử giúp giải quyết nhiều bài toán hóa học phức tạp.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

