Ghi nhớ công thức hóa học của natri oxit và các tính chất quan trọng
Công thức hóa học của natri oxit đóng vai trò quan trọng trong ngành công nghiệp hóa chất. Hợp chất này tham gia vào nhiều phản ứng hóa học đặc trưng. Natri oxit còn được ứng dụng rộng rãi trong sản xuất xà phòng và thủy tinh. Các tính chất đặc biệt của nó tạo nên giá trị thực tiễn to lớn.
Công thức hóa học của natri oxit
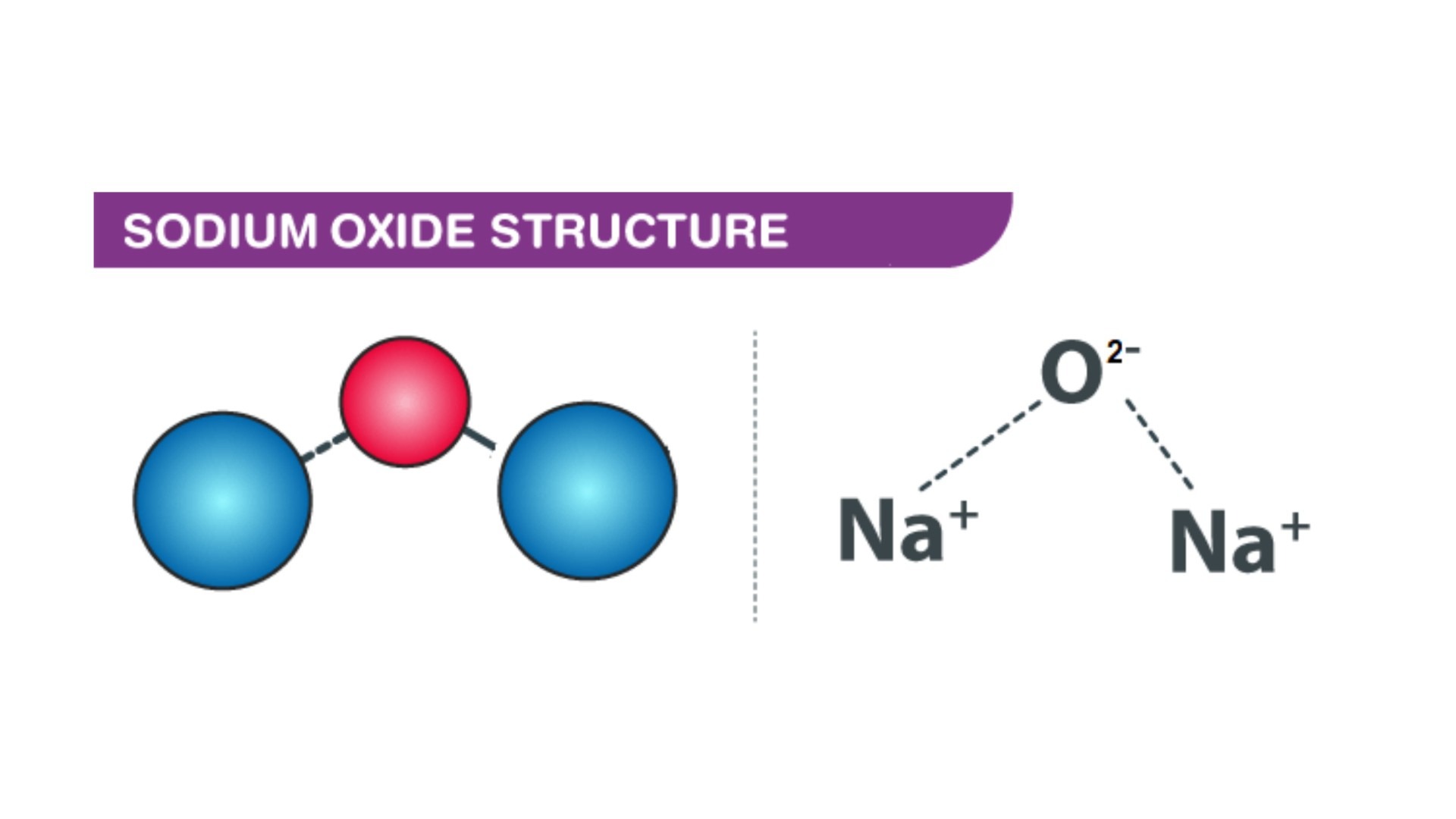
Natri oxit có công thức hóa học của natri oxit là Na2O. Đây là một hợp chất ion được tạo thành từ ion Na+ và O2-.
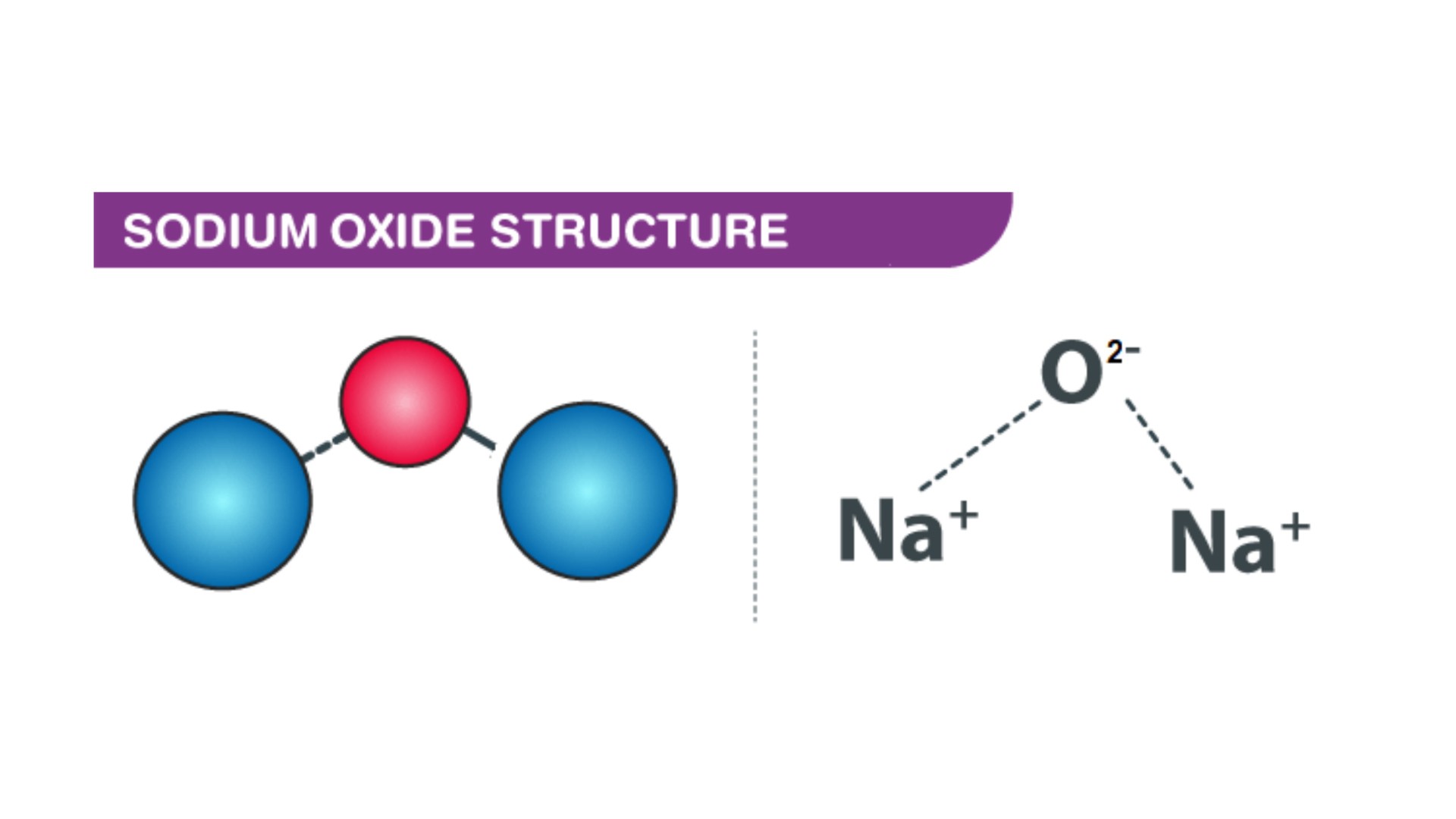
Để dễ nhớ công thức natri oxit, bạn cần nắm được quy tắc viết công thức. Natri (Na) có hóa trị I, còn oxi (O) có hóa trị II. Do đó cần 2 nguyên tử Na để cân bằng với 1 nguyên tử O.
Công thức Na2O được viết theo quy tắc:
- Na mang điện tích +1
- O mang điện tích -2
- Tổng điện tích phải bằng 0: (+1 × 2) + (-2 × 1) = 0
Trong quá trình giảng dạy, tôi thường ví von Na2O như một “cặp đôi hoàn hảo”. Hai anh Na luôn đi cùng nhau để cân bằng với một cô O. Cách ghi nhớ này giúp học sinh dễ nhớ và thú vị hơn.
Natri oxit là một chất rắn màu trắng, có tính bazơ mạnh và phản ứng mạnh với nước tạo thành dung dịch NaOH. Phương trình phản ứng:
Na2O + H2O → 2NaOH
Khi tiếp xúc với không khí ẩm, Na2O cũng phản ứng tạo thành NaOH. Vì vậy cần bảo quản Na2O trong điều kiện khô ráo, tránh ẩm.
Cấu tạo và tính chất của natri oxit trong tự nhiên
Natri oxit là hợp chất vô cơ có công thức hóa học Na2O. Đây là một trong những oxit kim loại điển hình và phổ biến trong công nghiệp hóa chất.
Cấu tạo phân tử natri oxit
Natri oxit có cấu tạo tinh thể ion với các ion Na+ và O2-. Mỗi ion O2- được bao quanh bởi 4 ion Na+ theo dạng tứ diện.
Liên kết trong phân tử có tính ion mạnh, tương tự như công thức hóa học của oxi khi tạo hợp chất với kim loại kiềm.
Sự tồn tại của natri oxit trong tự nhiên
Natri oxit trong tự nhiên hiếm khi tồn tại ở dạng tự do. Nó thường xuất hiện dưới dạng muối natri carbonat hoặc natri silicat.
Quá trình tổng hợp natri oxit diễn ra khi cho natri kim loại phản ứng trực tiếp với oxi không khí ở nhiệt độ cao.
Trong công nghiệp, natri oxit được điều chế bằng phương pháp nhiệt phân Na2O2 ở 400-500°C.
Tính chất vật lý của natri oxit
Na2O là chất rắn màu trắng, có cấu trúc tinh thể. Nhiệt độ nóng chảy của nó là 1132°C.
Natri oxit tan mạnh trong nước và giải phóng nhiều nhiệt, tương tự như Công thức của nhôm oxit.
Khối lượng riêng của natri oxit là 2,27 g/cm3 ở điều kiện tiêu chuẩn.
Tính chất hóa học cơ bản
Natri oxit là một oxit bazơ điển hình, có khả năng phản ứng mạnh với nước tạo dung dịch kiềm mạnh NaOH.
Phản ứng với axit tạo muối và nước:
Na2O + 2HCl → 2NaCl + H2O
Với CO2 tạo muối carbonat:
Na2O + CO2 → Na2CO3
Trong 20 năm giảng dạy, tôi thường nhắc học sinh ghi nhớ tính chất bazơ mạnh của Na2O qua phản ứng với nước – một phản ứng quan trọng trong công nghiệp sản xuất xút.
Các phản ứng hóa học quan trọng của natri oxit
Natri oxit là một hợp chất vô cơ có tính bazơ mạnh. Hợp chất này tham gia nhiều phản ứng hóa học quan trọng với nước, axit và oxit axit.
Phản ứng với nước tạo natri hidroxit
Natri oxit tác dụng với nước tạo thành dung dịch công thức của natri hiđroxit theo phương trình:
Na2O + H2O → 2NaOH
Phản ứng này xảy ra mạnh mẽ và tỏa nhiều nhiệt. Khi tiến hành thí nghiệm, cần cho từ từ natri oxit vào nước và khuấy đều.
Trong quá trình giảng dạy, tôi thường nhắc học sinh phải đeo găng tay và kính bảo hộ khi làm thí nghiệm với natri oxit.
Phản ứng với các loại axit
Natri oxit phản ứng với axit tạo muối và nước. Ví dụ với công thức hóa học của axit nitric:
Na2O + 2HNO3 → 2NaNO3 + H2O
Đây là phản ứng trung hòa điển hình giữa oxit bazơ và axit. Phản ứng xảy ra nhanh và hoàn toàn.

Để giúp học sinh nhớ, tôi thường so sánh phản ứng này với việc “trung hòa” cơn giận của hai người bạn.
Phản ứng với các oxit axit
Natri oxit phản ứng với oxit axit tạo thành muối. Phản ứng với CO2:
Na2O + CO2 → Na2CO3
Phản ứng với SO3:
Na2O + SO3 → Na2SO4
Các phản ứng này có ý nghĩa quan trọng trong công nghiệp sản xuất muối natri.
Phương pháp điều chế và ứng dụng của natri oxit
Natri oxit là hợp chất vô cơ quan trọng trong công nghiệp hóa chất. Hợp chất này có công thức hóa học Na2O và thuộc nhóm oxit bazơ.
Các phương pháp điều chế natri oxit
Phương pháp phổ biến nhất để điều chế natri oxit điều chế là cho natri kim loại tác dụng với oxi không khí ở nhiệt độ cao. Phản ứng xảy ra theo phương trình:
4Na + O2 → 2Na2O
Một phương pháp khác là nhiệt phân natri peroxyt ở 400-500°C:
2Na2O2 → 2Na2O + O2
Trong phòng thí nghiệm, có thể điều chế Na2O bằng cách cho công thức của natri cacbonat phản ứng với cacbon ở nhiệt độ cao.
Ứng dụng trong công nghiệp
Natri oxit ứng dụng rộng rãi trong sản xuất thủy tinh và gốm sứ. Hợp chất này giúp hạ thấp nhiệt độ nóng chảy của hỗn hợp.
Na2O còn được dùng làm chất xúc tác trong nhiều quá trình tổng hợp hữu cơ. Nó tham gia phản ứng với công thức hóa học của natri sunfat tạo muối.
Ứng dụng trong đời sống
Na2O là nguyên liệu quan trọng trong sản xuất xà phòng và chất tẩy rửa. Khi hòa tan trong nước tạo dung dịch kiềm mạnh.
Trong y học, natri oxit được sử dụng để điều chế một số dược phẩm. Nó cũng có mặt trong các sản phẩm làm sạch công nghiệp.
Lưu ý về độc tính và an toàn
Natri oxit độc tính cao khi tiếp xúc trực tiếp với da và niêm mạc. Cần tránh hít phải bụi Na2O vì gây kích ứng đường hô hấp.
Khi làm việc với Na2O phải mang đầy đủ thiết bị bảo hộ như găng tay, kính bảo vệ mắt. Bảo quản trong bình kín tránh ẩm.
Trường hợp bị bỏng do Na2O cần rửa ngay bằng nhiều nước sạch và đến cơ sở y tế gần nhất để được điều trị kịp thời.
FAQ: Câu hỏi thường gặp về natri oxit
Natri oxit là hợp chất quan trọng trong công nghiệp hóa chất. Tôi sẽ giải đáp một số thắc mắc phổ biến về chất này, giúp bạn hiểu rõ hơn về cách sử dụng và bảo quản an toàn.
Cách bảo quản natri oxit an toàn
Natri oxit cần được bảo quản trong điều kiện khô ráo, tránh tiếp xúc với không khí và độ ẩm. Tương tự như công thức hóa học của canxi oxit, natri oxit rất dễ hút ẩm.
Đóng gói natri oxit trong các bình kín, có nắp đậy chắc chắn. Nhiệt độ bảo quản tốt nhất là dưới 30°C.
Tránh để gần các acid, chất dễ cháy và công thức hóa học của kali nitrat vì có thể gây phản ứng nguy hiểm.
Sự khác biệt giữa natri oxit và natri peroxit
Natri oxit (Na2O) là oxit bazơ, trong khi natri peroxit (Na2O2) chứa thêm một nguyên tử oxi. Giống như diphotpho pentaoxit là gì, cả hai đều là chất rắn màu trắng.
Natri peroxit có tính oxi hóa mạnh hơn natri oxit. Khi tác dụng với nước, natri peroxit giải phóng oxi.
Natri oxit tạo dung dịch bazơ mạnh khi tan trong nước, trong khi natri peroxit tạo thêm H2O2.
Xử lý khi tiếp xúc với natri oxit
Nếu da tiếp xúc với natri oxit, rửa ngay bằng nhiều nước sạch trong 15-20 phút. Tránh chà xát vùng bị bỏng.
Khi mắt tiếp xúc, mở mắt và rửa bằng nước sạch liên tục. Đưa ngay đến cơ sở y tế gần nhất.
Nếu hít phải bụi natri oxit, di chuyển nạn nhân ra nơi thoáng khí và theo dõi tình trạng hô hấp.
Việc nắm vững công thức hóa học của natri oxit giúp học sinh hiểu rõ bản chất và tính chất của hợp chất quan trọng này. Natri oxit có vai trò thiết yếu trong nhiều ngành công nghiệp và đời sống hàng ngày. Các phản ứng hóa học đặc trưng với nước và axit tạo nên những ứng dụng đa dạng trong thực tế. Tuy nhiên, cần tuân thủ nghiêm ngặt các quy tắc an toàn khi tiếp xúc với natri oxit do tính ăn mòn mạnh của nó.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

