Hiểu sâu công thức hóa học của natri cromat và ứng dụng thực tế
Công thức hóa học của natri cromat là một kiến thức quan trọng trong chương trình hóa học phổ thông. Hợp chất này có nhiều ứng dụng thiết thực trong công nghiệp và đời sống. Bài viết phân tích chi tiết về cấu tạo, tính chất và cách sử dụng an toàn của natri cromat.
Công thức hóa học của natri cromat
Công thức hóa học của natri cromat là Na2CrO4. Đây là một hợp chất vô cơ thuộc nhóm muối cromat.
Na2CrO4 được cấu tạo từ:
- 2 nguyên tử Natri (Na+)
- 1 gốc cromat (CrO4^2-)
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức natri cromat là gì bằng cách phân tích hóa trị. Natri có hóa trị +1, gốc cromat có hóa trị -2. Do đó cần 2 nguyên tử Na+ để cân bằng điện tích với 1 gốc CrO4^2-.
Na2CrO4 tồn tại ở dạng tinh thể màu vàng, dễ tan trong nước. Khi hòa tan, muối này tạo thành dung dịch màu vàng đặc trưng do sự có mặt của ion CrO4^2-.
Một cách đơn giản để nhớ công thức này là liên hệ với các muối cromat khác. Các muối cromat thường có dạng M2CrO4 (với M là kim loại kiềm) hoặc MCrO4 (với M là kim loại hóa trị 2).
Cấu tạo và đặc điểm của natri cromat Na2CrO4
Natri cromat là chất vô cơ có công thức hóa học Na2CrO4, được tạo thành từ ion Na+ và ion CrO42-. Đây là một muối quan trọng của axit cromic H2CrO4, thường được sử dụng trong công nghiệp và phòng thí nghiệm.
Cấu trúc phân tử của natri cromat
Na2CrO4 là gì? Đó là hợp chất có cấu trúc ion, trong đó 2 ion Na+ liên kết với 1 ion CrO42-. Ion cromat CrO42- có dạng tứ diện với nguyên tử Cr ở tâm và 4 nguyên tử O ở 4 đỉnh.
Liên kết trong phân tử Na2CrO4 chủ yếu là liên kết ion giữa Na+ và CrO42-. Trong ion cromat, liên kết giữa Cr và O là liên kết cộng hóa trị có cực.

Tính chất vật lý của natri cromat
Các tính chất vật lý của natri cromat phụ thuộc vào cấu trúc và liên kết trong phân tử. Chất này có nhiều đặc điểm nổi bật về màu sắc và độ tan.
Màu sắc và trạng thái
Natri cromat màu vàng sáng đặc trưng ở nhiệt độ phòng. Chất này tồn tại ở dạng tinh thể rắn với cấu trúc tinh thể hình thoi.
Màu vàng của natri cromat là do sự hấp thụ ánh sáng của ion CrO42-. Khi hòa tan trong nước, dung dịch cũng có màu vàng đặc trưng.
Độ tan trong nước và dung môi
Natri cromat tan trong nước rất tốt, tạo thành dung dịch trong suốt màu vàng. Độ tan của nó trong nước ở 20°C là khoảng 873g/L.
Trong các dung môi hữu cơ như ethanol, natri cromat ít tan hơn. Độ tan của nó tăng theo nhiệt độ, điều này rất thuận lợi cho việc tinh chế và tái kết tinh.
Tính chất hóa học của natri cromat và các phản ứng đặc trưng
Natri cromat là một hợp chất vô cơ có công thức Na2CrO4, tồn tại dưới dạng tinh thể màu vàng. Đây là một chất có tính oxi hóa mạnh và thường được sử dụng trong công nghiệp điện phân, nhuộm vải.
Các phản ứng của natri cromat thường liên quan đến ion CrO42- và có nhiều điểm tương đồng với công thức hóa học của kali đicromat. Tôi sẽ phân tích chi tiết từng loại phản ứng đặc trưng.
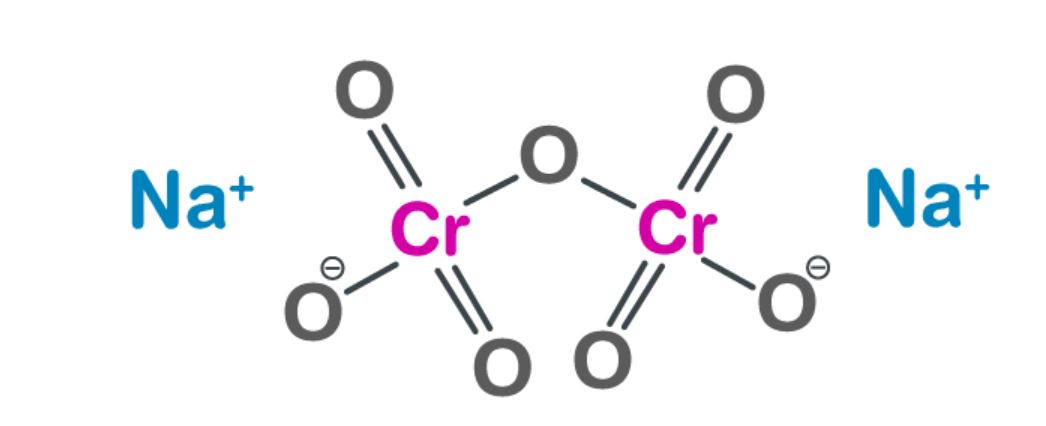
Phản ứng với axit
Khi tác dụng với axit, tính chất hóa học của natri cromat thể hiện rõ qua sự chuyển màu từ vàng sang da cam. Ion cromat CrO42- chuyển thành ion đicromat Cr2O72-.
Phương trình phản ứng tổng quát:
2CrO42- + 2H+ → Cr2O72- + H2O
Trong quá trình giảng dạy, tôi thường cho học sinh quan sát thí nghiệm này để ghi nhớ sự thay đổi màu sắc đặc trưng.
Phản ứng với bazơ
Natri cromat phản ứng với bazơ theo chiều ngược lại so với phản ứng với axit. Ion đicromat Cr2O72- chuyển thành ion cromat CrO42-.
Phương trình phản ứng:
Cr2O72- + 2OH- → 2CrO42- + H2O
Đây là phản ứng thuận nghịch, phụ thuộc vào pH của môi trường. Ở pH < 7 tạo ion đicromat, pH > 7 tạo ion cromat.
Phản ứng oxi hóa khử
Ion CrO42- trong natri cromat có tính oxi hóa mạnh trong môi trường axit. Crom (VI) sẽ bị khử thành crom (III).
Ví dụ phản ứng với KI:
2CrO42- + 16H+ + 6I- → 2Cr3+ + 3I2 + 8H2O
Phản ứng với H2S:
2CrO42- + 10H+ + 3H2S → 2Cr3+ + 3S + 8H2O
Các phản ứng oxi hóa khử thường đi kèm với sự thay đổi màu sắc rõ rệt từ vàng sang xanh lục.
Ứng dụng và công dụng của natri cromat trong đời sống
Natri cromat công dụng đa dạng trong nhiều lĩnh vực khác nhau. Hợp chất này có công thức hóa học Na2CrO4 với màu vàng đặc trưng. Tương tự như công thức hóa học của natri clorua, natri cromat cũng là một muối vô cơ quan trọng.
Ứng dụng trong công nghiệp
Natri cromat ứng dụng rộng rãi trong ngành công nghiệp nhuộm và thuộc da. Hợp chất này giúp cố định màu nhuộm trên vải sợi bền hơn.

Trong công nghiệp mạ điện, natri cromat đóng vai trò chất phụ gia quan trọng. Nó tạo lớp phủ bảo vệ chống ăn mòn cho bề mặt kim loại.
Ngành sản xuất gỗ sử dụng natri cromat để bảo quản gỗ. Hợp chất này ngăn chặn vi sinh vật phá hoại và kéo dài tuổi thọ của sản phẩm gỗ.
Ứng dụng trong phòng thí nghiệm
Trong phân tích định tính, natri cromat là thuốc thử phát hiện ion bạc và chì. Phản ứng tạo kết tủa màu đỏ gạch đặc trưng.
Các phòng thí nghiệm sử dụng natri cromat làm chất chuẩn độ. Đặc biệt trong phân tích định lượng các ion kim loại.
Natri cromat còn là nguyên liệu tổng hợp nhiều hợp chất crom khác. Ví dụ như kali dicromat và axit cromic.
Lưu ý an toàn khi sử dụng
Natri cromat là hóa chất độc hại cần thận trọng khi sử dụng. Tiếp xúc trực tiếp có thể gây kích ứng da, mắt và đường hô hấp.
Cần trang bị đầy đủ bảo hộ lao động như găng tay, kính bảo vệ mắt. Làm việc trong môi trường thông thoáng hoặc tủ hút.
Tuyệt đối không để natri cromat tiếp xúc với thực phẩm và nước uống. Bảo quản trong thùng kín, tránh xa tầm với của trẻ em.
FAQ: Câu hỏi thường gặp về natri cromat
Natri cromat là hợp chất vô cơ thường được sử dụng trong công nghiệp. Tuy nhiên, nhiều người còn băn khoăn về độ an toàn và cách bảo quản chất này.
Natri cromat có độc không?
Natri cromat độc không là câu hỏi được nhiều người quan tâm. Câu trả lời là có – natri cromat rất độc.
Khi tiếp xúc trực tiếp, natri cromat có thể gây kích ứng da, mắt và đường hô hấp nghiêm trọng.
Theo Cơ quan Quốc tế Nghiên cứu Ung thư (IARC), natri cromat được xếp vào nhóm 1 – chất gây ung thư cho con người.
Cách bảo quản natri cromat an toàn
Natri cromat cần được bảo quản trong điều kiện khô ráo, thoáng mát và tránh ánh nắng trực tiếp.
Đựng trong các thùng chứa kín bằng thủy tinh hoặc nhựa chuyên dụng. Tuyệt đối không để gần các chất dễ cháy.
Khi làm việc với natri cromat, phải trang bị đầy đủ bảo hộ lao động như găng tay, kính bảo vệ mắt và khẩu trang.
Trong 20 năm giảng dạy, tôi luôn nhấn mạnh với sinh viên: Chỉ thao tác với natri cromat trong tủ hút và có sự giám sát của giáo viên.
Việc nắm vững công thức hóa học của natri cromat giúp học sinh hiểu rõ cấu tạo và tính chất của hợp chất quan trọng này. Natri cromat là muối có màu vàng, dễ tan trong nước và có nhiều ứng dụng trong công nghiệp thuộc da, nhuộm vải. Tuy nhiên, đây là chất độc hại nên cần tuân thủ nghiêm ngặt các quy tắc an toàn khi sử dụng và bảo quản trong phòng thí nghiệm.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

