Hiểu sâu công thức hóa học của natri clorua và ứng dụng trong đời sống
Công thức hóa học của natri clorua là nền tảng để hiểu về muối ăn trong tự nhiên. Natri clorua tạo nên cấu trúc tinh thể đặc biệt với liên kết ion bền vững. Hợp chất này đóng vai trò quan trọng trong đời sống và công nghiệp hiện đại.
Công thức hóa học của natri clorua
Natri clorua có công thức hóa học là NaCl. Đây là hợp chất ion được tạo thành từ ion Na+ và ion Cl-.
Trong tự nhiên, công thức natri clorua NaCl tồn tại phổ biến dưới dạng muối ăn. Hợp chất này có cấu tạo tinh thể lập phương tâm diện.
Cấu tạo của NaCl gồm:
- Na+: Ion natri mang điện tích dương
- Cl-: Ion clorua mang điện tích âm
- Tỉ lệ ion Na+ và Cl- là 1:1
Khi viết công thức NaCl, ta cần lưu ý:
- Viết Na trước vì là kim loại kiềm
- Viết Cl sau vì là phi kim halogen
- Không cần chỉ số phụ vì tỉ lệ ion là 1:1
Trong quá trình giảng dạy, tôi thường ví von NaCl như một cặp đôi hoàn hảo. Ion Na+ và Cl- luôn đi cùng nhau với số lượng bằng nhau để tạo thành tinh thể muối ăn trung hòa điện.
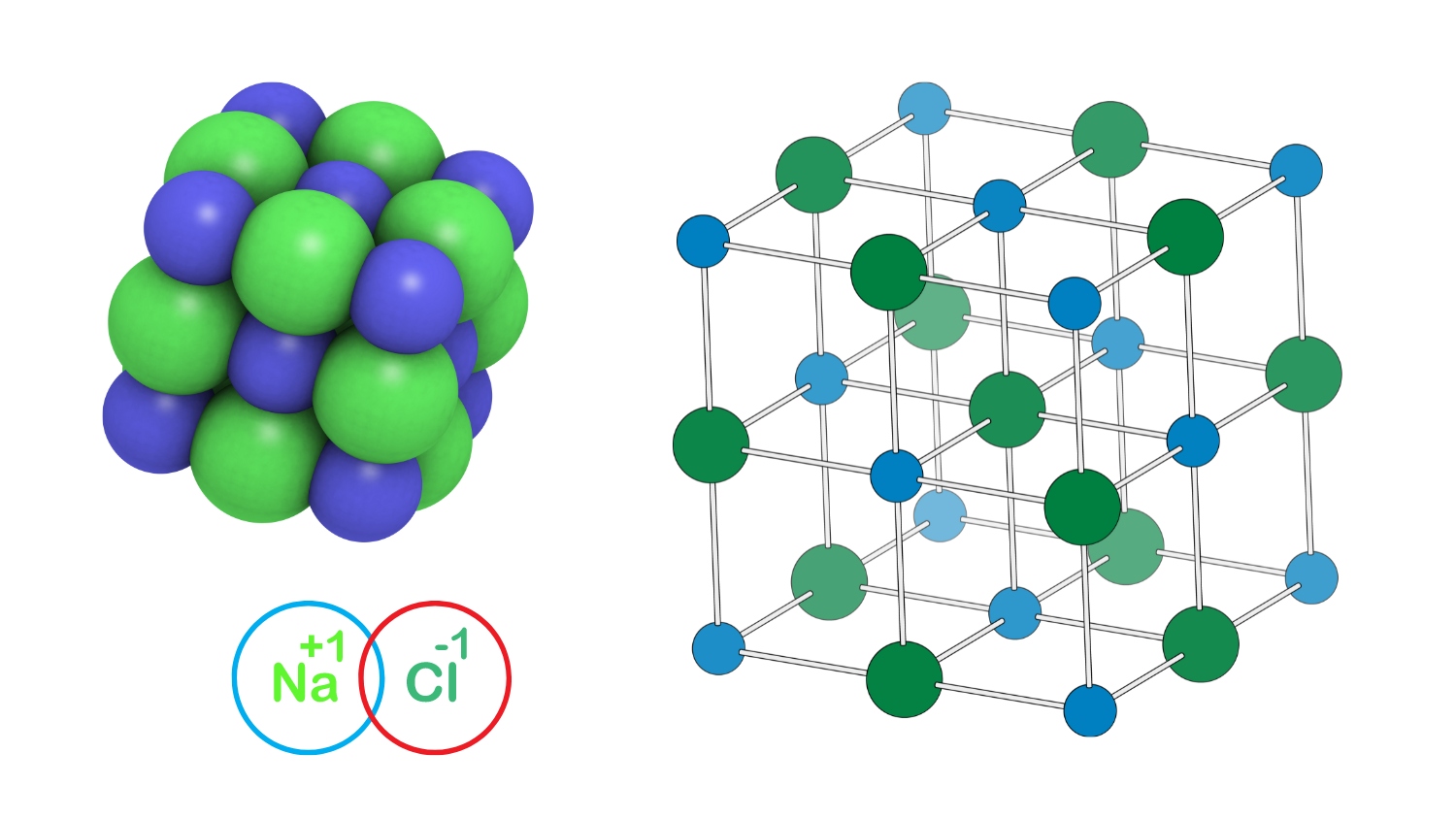
Đây là một trong những công thức hóa học cơ bản mà học sinh cần nắm vững. NaCl là hợp chất điển hình cho liên kết ion giữa kim loại kiềm và halogen.
Cấu tạo và đặc điểm phân tử natri clorua trong tự nhiên
Natri clorua trong tự nhiên tồn tại dưới dạng tinh thể ion với cấu trúc mạng lập phương tâm diện. Mỗi ion Na+ được bao quanh bởi 6 ion Cl- và ngược lại.
Muối ăn NaCl là một hợp chất điển hình của liên kết ion. Nó được tạo thành từ phản ứng giữa kim loại natri và khí clo, tương tự như công thức của natri hiđroxit là.
Cấu trúc tinh thể của natri clorua
Tinh thể NaCl có dạng lập phương với các ion Na+ và Cl- xếp xen kẽ nhau. Mỗi ion nằm tại các đỉnh và tâm các mặt của khối lập phương.
Khoảng cách giữa các ion Na+ và Cl- trong mạng tinh thể là 2.82Å. Con số này phản ánh lực hút tĩnh điện mạnh giữa các ion.
Cấu trúc này giúp tinh thể NaCl rất bền vững và có nhiệt độ nóng chảy cao khoảng 801°C.
Liên kết ion trong phân tử NaCl
Cấu tạo NaCl dựa trên liên kết ion giữa Na+ và Cl-. Ion Na+ được hình thành khi natri mất 1 electron, còn Cl- nhận thêm 1 electron.
Lực hút tĩnh điện giữa các ion trái dấu tạo nên liên kết ion bền vững. Đây là đặc trưng của các hợp chất muối vô cơ như công thức na2co3.
Năng lượng mạng tinh thể của NaCl là 787 kJ/mol, thể hiện độ bền vững cao của liên kết ion.
Sự phân bố của natri clorua trong tự nhiên
Natri clorua phân bố rộng rãi trong tự nhiên, chủ yếu trong nước biển với nồng độ trung bình 35g/L.
Các mỏ muối đá lớn được tìm thấy ở nhiều nơi trên thế giới. Mỏ muối Wieliczka ở Ba Lan là một trong những mỏ muối cổ nhất, được khai thác từ thế kỷ 13.
Ở Việt Nam, muối được khai thác chủ yếu từ nước biển qua phương pháp bay hơi nước tự nhiên tại các ruộng muối ven biển.
Tính chất vật lý và hóa học của natri clorua
Natri clorua tính chất bao gồm nhiều đặc điểm quan trọng cần nắm vững. Muối ăn là một hợp chất ion điển hình với công thức NaCl, được cấu tạo từ ion Na+ và Cl-. Các tính chất này quyết định ứng dụng rộng rãi của nó trong đời sống.
Các tính chất vật lý đặc trưng
NaCl là tinh thể không màu, trong suốt với cấu trúc mạng tinh thể lập phương tâm mặt. Điểm nóng chảy của muối ăn là 801°C và điểm sôi là 1413°C ở áp suất thường.
Khối lượng riêng của muối ăn hóa học là 2,17 g/cm³. Tôi thường ví von với học sinh rằng đó là lý do tại sao muối ăn luôn chìm trong nước.
Muối ăn có vị mặn đặc trưng và không mùi. Khi nghiền nhỏ thành bột, các tinh thể muối có màu trắng đục.
Phản ứng hóa học cơ bản
Natri clorua tham gia nhiều phản ứng hóa học quan trọng. Khi tác dụng với axit clohiđric có công thức hóa học là, muối giải phóng khí HCl.
Phản ứng với công thức của axit nitric là tạo thành muối natri nitrat và axit clohiđric. Đây là phản ứng tôi thường dùng làm thí nghiệm minh họa.
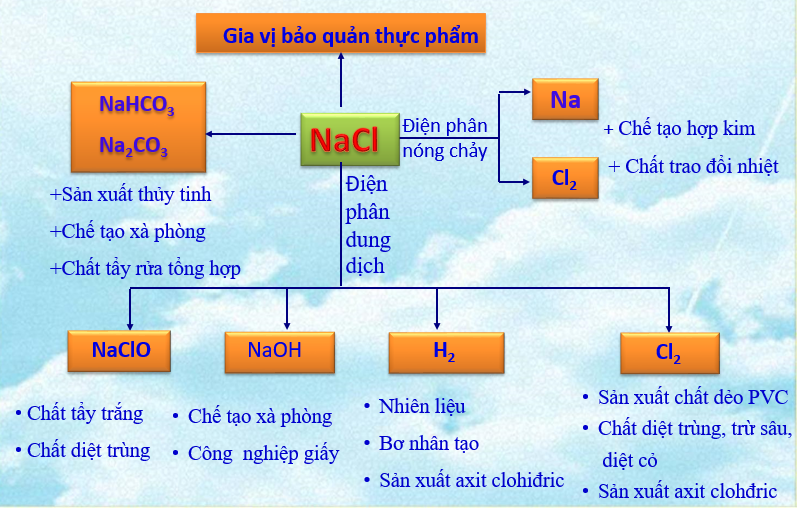
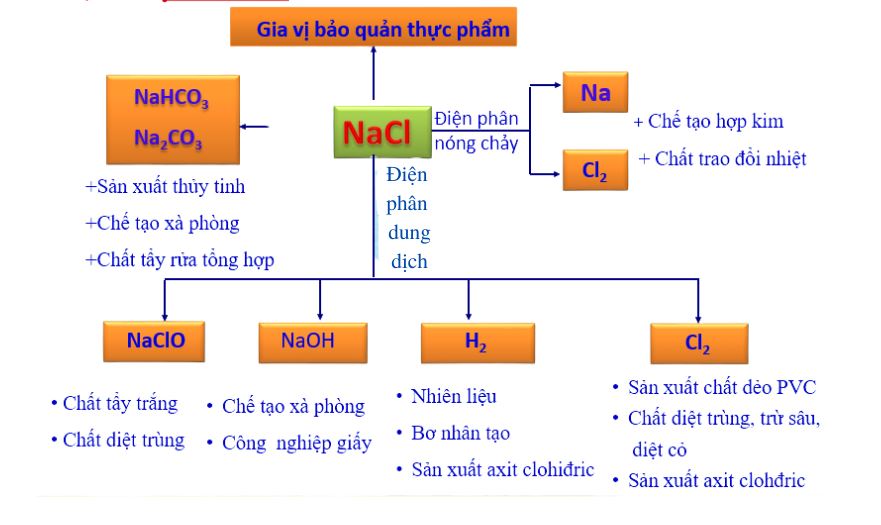
Khi điện phân dung dịch NaCl, ta thu được khí clo ở anot và natri hidroxit ở catot. Phản ứng này có ý nghĩa công nghiệp lớn.
Độ tan trong nước và dung môi khác
Natri clorua tan tốt trong nước với độ tan 359g/L ở 20°C. Độ tan tăng nhẹ theo nhiệt độ, đạt 391g/L ở 100°C.
Trong rượu etylic, độ tan của muối ăn rất thấp, chỉ khoảng 0,065g/100g dung môi. Điều này giải thích tại sao muối không tan trong cồn.
Muối ăn không tan trong các dung môi hữu cơ không phân cực như benzen, hexan. Tính chất này giúp phân biệt muối với các chất hữu cơ.
Ứng dụng của natri clorua trong đời sống và công nghiệp
Natri clorua ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Hợp chất này đóng vai trò quan trọng từ đời sống hàng ngày đến các ngành công nghiệp.
Vai trò trong chế biến thực phẩm
Muối ăn công thức hóa học NaCl là gia vị không thể thiếu trong bữa ăn hàng ngày. Nó giúp tăng hương vị và bảo quản thực phẩm hiệu quả.
Trong ngành công nghiệp thực phẩm, natri clorua được sử dụng để ướp muối cá, thịt và rau quả. Quá trình này giúp thực phẩm không bị hư hỏng do vi khuẩn.
Tôi thường hướng dẫn học sinh thí nghiệm đơn giản về khả năng bảo quản của muối. Đặt 2 miếng thịt – một có muối và một không, sau 24h sẽ thấy rõ sự khác biệt.
Ứng dụng trong công nghiệp hóa chất
Natri clorua là nguyên liệu quan trọng để sản xuất nhiều hóa chất công nghiệp. Điện phân dung dịch NaCl tạo ra khí clo và NaOH.
Khí clo được dùng để sản xuất vinyl clorua có công thức là và công thức của clorua vôi. Đây là những hợp chất quan trọng trong công nghiệp nhựa và tẩy trắng.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng điện phân NaCl để hiểu rõ hơn về ứng dụng này.
Sử dụng trong y học và dược phẩm
Dung dịch natri clorua 0,9% được sử dụng làm dịch truyền sinh lý. Nồng độ này tương đương với nồng độ muối trong máu người.
Trong phòng khám, dung dịch NaCl sinh lý dùng để rửa vết thương và làm sạch khoang mũi. Nó an toàn và không gây kích ứng cho cơ thể.
Kinh nghiệm giảng dạy cho thấy việc liên hệ với dung dịch muối sinh lý giúp học sinh hiểu rõ hơn về áp suất thẩm thấu trong tế bào.
FAQ: Câu hỏi thường gặp về natri clorua
Natri clorua là hợp chất phổ biến trong đời sống. Tuy nhiên vẫn còn nhiều thắc mắc về tính chất và cách nhận biết muối ăn. Dưới đây là một số câu hỏi thường gặp về NaCl là gì và đặc điểm của nó.
NaCl có độc không?
NaCl không độc hại với liều lượng sử dụng bình thường. Tuy nhiên việc tiêu thụ quá nhiều muối ăn có thể gây hại cho sức khỏe.
Theo Tổ chức Y tế Thế giới (WHO), người lớn chỉ nên tiêu thụ dưới 5g muối/ngày. Lượng natri clorua dư thừa có thể gây tăng huyết áp và các bệnh tim mạch.
Với trẻ em, cần hạn chế lượng muối ăn để tránh ảnh hưởng đến sự phát triển. Tốt nhất nên tham khảo ý kiến bác sĩ về liều lượng phù hợp.
Làm thế nào để phân biệt NaCl với các muối khác?
Natri clorua có dạng tinh thể màu trắng trong suốt, vị mặn đặc trưng. Để phân biệt với công thức hóa học của kali clorua, ta có thể dựa vào màu ngọn lửa khi đốt.
NaCl cho màu vàng cam đặc trưng khi đốt trong đèn cồn. Trong khi đó công thức kali đicromat cho màu tím và công thức hóa học của natri oxit cho màu vàng.
Ngoài ra có thể dùng phương pháp kết tủa với AgNO3 để nhận biết ion Cl-. Kết tủa AgCl màu trắng sẽ xuất hiện khi có mặt ion clorua.
Tại sao NaCl lại tan tốt trong nước?
Công thức hóa học của natri clorua cho thấy đây là muối ion. Khi tan trong nước, NaCl phân ly thành các ion Na+ và Cl-.
Các ion này được bao quanh bởi các phân tử nước (hydrat hóa). Lớp hydrat hóa giúp các ion ổn định trong dung dịch.
Độ tan của NaCl trong nước ở 20°C là 359g/L, thuộc nhóm muối tan tốt. Đặc tính này giúp NaCl được ứng dụng rộng rãi trong đời sống.
Chất hóa học với công thức hóa học của natri clorua đóng vai trò quan trọng trong đời sống. Đây là hợp chất ion điển hình với cấu trúc tinh thể lập phương tâm diện và các tính chất đặc trưng. NaCl tan tốt trong nước, không màu, không mùi và có vị mặn đặc trưng. Hợp chất này phân bố rộng rãi trong tự nhiên và có nhiều ứng dụng thiết thực trong công nghiệp, y học và đời sống hàng ngày.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

