Công thức hóa học của muối và cách viết chuẩn cho học sinh trung học
Công thức hóa học của muối giúp mô tả thành phần và cấu tạo của các hợp chất muối. Bài viết phân tích chi tiết cách viết công thức, phân loại và đặc điểm của từng loại muối. Các phương pháp nhận biết muối trong phòng thí nghiệm cũng được trình bày rõ ràng.
Công thức hóa học của muối là gì?
Muối trong hóa học là hợp chất được tạo thành khi ion dương của bazơ kết hợp với ion âm của axit. Công thức hóa học của muối có dạng tổng quát:
MaAb
Trong đó:
– M: Kim loại hoặc gốc NH4+
– A: Gốc axit
– a, b: Hệ số cân bằng điện tích
Ví dụ một số công thức muối phổ biến:
– NaCl (Natri clorua): Na+ + Cl- → NaCl
– CaSO4 (Canxi sunfat): Ca2+ + SO42- → CaSO4
– NH4NO3 (Amoni nitrat): NH4+ + NO3- → NH4NO3
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ muối là gì trong hóa học bằng cách liên tưởng đến việc nấu ăn. Giống như muối ăn được tạo ra từ natri và clo, các muối khác cũng được hình thành từ sự kết hợp của ion dương và ion âm.
Để viết đúng công thức muối, cần xác định rõ hóa trị của các ion. Sau đó, điều chỉnh hệ số sao cho tổng điện tích dương bằng tổng điện tích âm. Đây là nguyên tắc quan trọng giúp cân bằng công thức hóa học của muối.

Một mẹo nhỏ khi viết công thức muối là luôn viết ion dương trước, ion âm sau. Điều này giúp thống nhất cách viết và dễ dàng nhận biết loại muối.
Phân loại và đặc điểm cấu tạo của các loại muối
Muối là hợp chất được tạo thành từ ion kim loại và gốc axit. Dựa vào cấu tạo, muối được chia thành 3 loại chính: muối trung hòa, muối axit và muối bazơ.

Mỗi loại muối có những đặc điểm cấu tạo riêng biệt. Điều quan trọng là hiểu rõ cấu trúc để phân biệt và sử dụng chúng trong các phản ứng hóa học.
Muối trung hòa và cách viết công thức
Muối trung hòa là hợp chất tạo thành khi H+ trong axit được thay thế hoàn toàn bằng ion kim loại. Ví dụ: NaCl, K2SO4, Ca(NO3)2.
Công thức của muối trung hòa được viết theo quy tắc:
Ma(b)
Trong đó:
– M là kim loại với hóa trị a
– X là gốc axit với hóa trị b
Tôi thường hướng dẫn học sinh ghi nhớ: “Muối trung hòa giống như một cuộc hôn nhân hoàn hảo – không thừa không thiếu ion nào.”
Muối axit – Đặc điểm và cấu tạo
Muối axit là hợp chất tạo thành khi H+ trong axit chỉ được thay thế một phần bằng ion kim loại. Chúng còn được gọi là muối chua.
Cấu tạo của muối axit luôn chứa nguyên tử H có khả năng phân ly. Điều này giúp phân biệt với muối trung hòa.
Một ví dụ điển hình là NaHCO3 (muối axit cacbonat). Trong công thức chất béo là gì, muối axit đóng vai trò quan trọng trong quá trình chế biến.
Muối bazơ – Cấu trúc và thành phần
Muối bazơ là hợp chất tạo thành khi nhóm OH- trong bazơ chỉ được thay thế một phần bằng gốc axit.
Cấu trúc của muối bazơ luôn chứa nhóm OH- gắn với kim loại. Ví dụ: Al(OH)2Cl, Fe(OH)2NO3.
Trong quá trình giảng dạy, tôi thường ví von muối bazơ như “ngôi nhà chưa hoàn thiện” – vẫn còn nhóm OH- chưa được thay thế hết.
Quy tắc viết công thức và gọi tên các loại muối
Muối là hợp chất được tạo thành từ phản ứng giữa axit và bazơ. Việc nắm vững cách viết công thức muối và cách gọi tên muối rất quan trọng trong học tập hóa học.
Trong quá trình 20 năm giảng dạy, tôi nhận thấy nhiều học sinh thường nhầm lẫn khi viết công thức và gọi tên muối. Vì vậy cần có những quy tắc cụ thể để ghi nhớ.
Nguyên tắc viết công thức muối
Công thức muối được viết theo thứ tự: Gốc kim loại (hoặc NH4+) + Gốc axit. Ví dụ muối natri clorua có công thức NaCl.

Khi viết công thức muối, cần xác định hóa trị của các ion để cân bằng điện tích. Ví dụ muối canxi clorua CaCl2 có Ca2+ và 2 ion Cl-.
Với muối phức tạp hơn như đimetylamin là gì, cần chú ý đến cấu trúc không gian của phân tử.
Cách đặt tên muối theo danh pháp IUPAC
Tên muối được đặt theo quy tắc: Tên gốc kim loại + Tên gốc axit. Với muối của axit có oxy, đuôi -ic chuyển thành -at, đuôi -o chuyển thành -it.
Ví dụ: H2SO4 (axit sunfuric) tạo muối Na2SO4 (natri sunfat). HNO2 (axit nitrơ) tạo muối NaNO2 (natri nitrit).
Với muối axit, thêm tiền tố hydro- trước tên muối trung hòa. Ví dụ: NaHCO3 là natri hydrocacbonat.
Một số lưu ý khi viết công thức muối
Cần phân biệt rõ muối trung hòa và muối axit. Muối trung hòa không còn H+ có thể thay thế, còn muối axit vẫn còn H+ có thể thay thế.
Với muối đa nguyên tố, cần viết đúng tỉ lệ các nguyên tố theo hóa trị. Ví dụ Fe2(SO4)3 có 2 ion Fe3+ và 3 ion SO42-.
Khi viết công thức muối kép, cần đặt các ion theo thứ tự điện tích giảm dần. Ví dụ KAl(SO4)2 có K+, Al3+ và SO42-.
Tính chất và phương pháp nhận biết muối trong phòng thí nghiệm
Muối là hợp chất ion được tạo thành từ phản ứng trung hòa giữa axit và bazơ. Việc nhận biết các muối có vai trò quan trọng trong phân tích định tính các chất.
Tương tự như các hợp chất hữu cơ như công thức c3h6 hay cấu tạo axit oleic, tính chất của muối cũng rất đa dạng và đặc trưng.
Tính chất vật lý của muối
Muối thường tồn tại ở dạng tinh thể rắn màu trắng hoặc có màu đặc trưng. Ví dụ muối CuSO4.5H2O có màu xanh lam, K2Cr2O7 có màu da cam.
Đa số muối có độ tan trong nước khác nhau. Một số muối tan tốt như NaCl, KNO3. Một số muối khó tan như BaSO4, PbCl2.
Nhiệt độ nóng chảy và sôi của muối thường cao do liên kết ion mạnh. NaCl nóng chảy ở 801°C, sôi ở 1413°C.
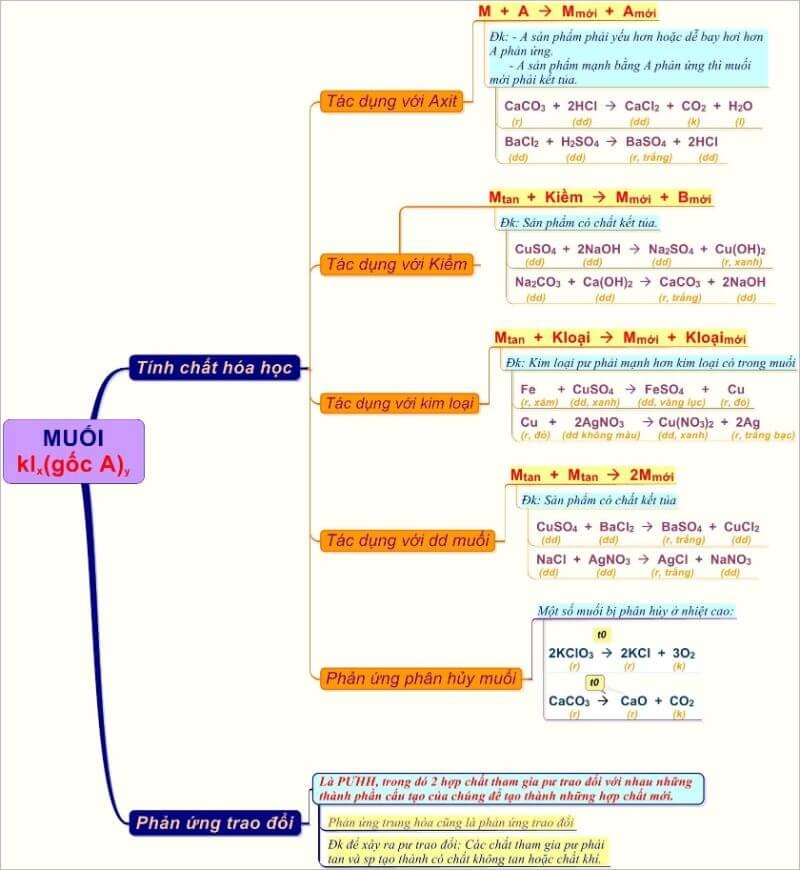
Tính chất hóa học đặc trưng
Muối có khả năng tham gia phản ứng trao đổi ion khi gặp dung dịch muối khác:
AgNO3 + NaCl → AgCl↓ + NaNO3
Nhiều muối bị thủy phân trong nước tạo môi trường axit hoặc bazơ:
CH3COONa + H2O ⇌ CH3COOH + NaOH
Khi đun nóng, một số muối bị phân hủy:
CaCO3 → CaO + CO2↑
Các phản ứng nhận biết muối
Cách nhận biết muối dựa vào màu sắc đặc trưng của kết tủa hoặc dung dịch:
Muối Fe3+ cho màu vàng nâu với NaOH:
Fe3+ + 3OH- → Fe(OH)3↓ (kết tủa nâu đỏ)
Muối Cu2+ cho màu xanh lam với N
Cu2+ + 4NH3 → [Cu(NH3)4]2+ (dung dịch xanh lam)
Muối Ba2+ cho kết tủa trắng với SO42-:
Ba2+ + SO42- → BaSO4↓ (kết tủa trắng)
Các phản ứng này giúp phân tích định tính nhanh chóng và chính xác các muối trong phòng thí nghiệm.
FAQ: Câu hỏi thường gặp về công thức hóa học của muối
Với hơn 20 năm giảng dạy, tôi nhận được rất nhiều câu hỏi về công thức muối hóa học. Các thắc mắc thường xoay quanh cách viết công thức và phân loại muối hóa học.
- Muối trung hòa là gì?
Muối trung hòa là muối được tạo thành khi H+ của axit được thay thế hoàn toàn bằng kim loại. Ví dụ: NaCl, K2SO4.
- Làm sao để nhận biết muối axit?
Muối axit có công thức chứa nguyên tử H thay thế không hoàn toàn. Ví dụ: NaHCO3, KHSO4.
- Muối bazơ có đặc điểm gì?
Muối bazơ chứa gốc OH- còn lại trong phân tử. Ví dụ: Al(OH)2Cl, Fe(OH)2NO3.
- Cách viết nhanh công thức muối?
Viết gốc kim loại trước, sau đó viết gốc axit. Chú ý cân bằng điện tích.
- Muối kép là gì?
Muối kép chứa 2 kim loại khác nhau cùng 1 gốc axit. Ví dụ: KAl(SO4)2.
Kinh nghiệm của tôi là học sinh cần ghi nhớ các gốc axit phổ biến và hóa trị của chúng để viết công thức muối chính xác.
Việc nắm vững công thức hóa học của muối giúp học sinh dễ dàng phân biệt và sử dụng các loại muối trong học tập. Muối được chia thành 3 nhóm chính: muối trung hòa, muối axit và muối bazơ với những đặc điểm cấu tạo riêng biệt. Mỗi loại muối đều tuân theo quy tắc viết công thức và cách gọi tên theo danh pháp IUPAC. Các tính chất vật lý, hóa học đặc trưng của muối là cơ sở để nhận biết chúng trong phòng thí nghiệm.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

