Khái quát công thức hóa học của khí cười N2O và ứng dụng thực tế
Công thức hóa học của khí cười N2O là chất khí không màu với mùi ngọt nhẹ. Chất khí này có tác dụng gây cười đặc trưng khi hít vào. N2O được ứng dụng rộng rãi trong y tế làm thuốc gây mê và công nghiệp thực phẩm. Bài viết phân tích chi tiết cấu tạo, tính chất và phương pháp điều chế N2O trong phòng thí nghiệm.
Công thức hóa học của khí cười
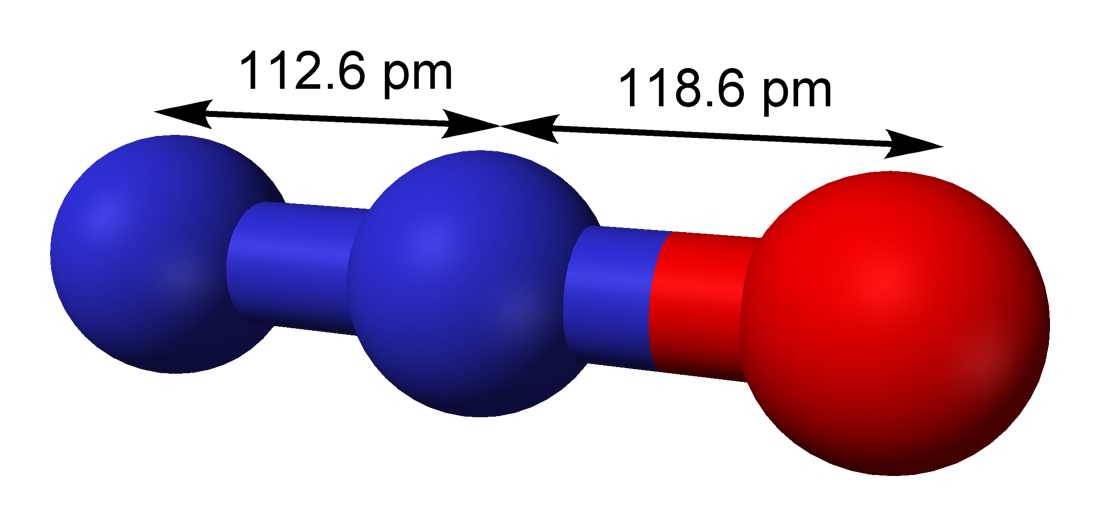
Khí cười có công thức hóa học của khí cười là N2O (Dinitrogen monoxide). Đây là một hợp chất vô cơ gồm 2 nguyên tử nitơ và 1 nguyên tử oxi.

Cấu trúc phân tử của N2O có dạng thẳng với liên kết N≡N và N-O:
N≡N-O
Trong đó:
- N≡N: liên kết ba giữa 2 nguyên tử nitơ
- N-O: liên kết đơn giữa nitơ và oxi
Khí N2O được tổng hợp trong phòng thí nghiệm bằng cách nhiệt phân muối NH4NO3 ở 250°C theo phương trình:
NH4NO3 → N2O + 2H2O
Trong quá trình giảng dạy, tôi thường ví von N2O như một “chàng trai vui tính”. Khi hít vào, nó tạo cảm giác phấn khích và gây cười. Đó là lý do N2O còn có tên gọi khí cười.
Tuy nhiên, cần lưu ý N2O là chất gây nghiện nguy hiểm. Việc sử dụng N2O không đúng cách có thể gây tổn thương não và hệ thần kinh trung ương.
Khí cười N2O là gì và cấu tạo phân tử
Khí cười là gì – một hợp chất hóa học có công thức N2O, tên gọi khoa học là dinitrogen monoxide. Tôi thường ví von với học sinh rằng đây là “anh em họ” của không khí chúng ta hít thở hàng ngày. Khí N2O có mùi ngọt nhẹ và tạo cảm giác hưng phấn khi hít phải.
Trong quá trình giảng dạy, tôi luôn nhấn mạnh với học sinh về tính chất đặc biệt của khí N2O. Nó là một chất khí không màu ở điều kiện thường, tan được trong nước và có khả năng hóa lỏng ở nhiệt độ thấp.
Định nghĩa và đặc điểm cơ bản của khí N2O
N2O là một oxide của nitơ, được tạo thành từ 2 nguyên tử nitơ và 1 nguyên tử oxi. Tôi thường giải thích cho học sinh bằng cách so sánh với bánh sandwich – hai lát bánh mì là N và miếng thịt ở giữa là O.
Đặc điểm nổi bật của N2O là khả năng gây tê và tạo cảm giác hưng phấn. Chính vì vậy, nó được sử dụng trong y tế như một loại thuốc gây mê nhẹ, đặc biệt trong nha khoa.
Trong môi trường, N2O đóng vai trò là một khí nhà kính. Tôi thường nhắc học sinh rằng mỗi phân tử N2O có tác động gây nóng lên bầu khí quyển mạnh gấp 300 lần CO2.
Cấu trúc phân tử và liên kết trong N2O
Cấu trúc phân tử N2O có dạng thẳng với thứ tự nguyên tử là N-N-O. Hai liên kết N-N và N-O đều là liên kết cộng hóa trị.
Công thức cấu tạo của N2O có thể viết là:
N≡N+-O-
Trong đó:
- Liên kết N≡N là liên kết ba
- Liên kết N-O là liên kết đơn
- Phân tử có cấu trúc cộng hưởng
Kinh nghiệm của tôi cho thấy học sinh dễ nhớ cấu trúc này khi tôi so sánh nó với một cây gậy có hai đầu khác nhau. Điều quan trọng là phải hiểu rõ bản chất của các liên kết để giải thích được tính chất hóa học của N2O.
Tính chất vật lý và hóa học của khí N2O
Khí N2O là một chất khí không màu, có mùi thơm nhẹ dễ chịu và vị ngọt. Đây là một trong những khí hiếm có tính chất đặc biệt được ứng dụng rộng rãi trong y học và công nghiệp.
Các tính chất khí N2O rất đa dạng và thú vị, từ đặc điểm vật lý cho đến khả năng tham gia phản ứng hóa học. Tôi sẽ phân tích chi tiết từng nhóm tính chất để các em dễ nắm bắt.
Các tính chất vật lý đặc trưng
N2O có khối lượng phân tử là 44 đvC, nặng hơn không khí khoảng 1,5 lần. Ở điều kiện thường, khí này tồn tại ở dạng phân tử.
Nhiệt độ nóng chảy của N2O là -90,8°C và nhiệt độ sôi là -88,5°C. Điều đặc biệt là N2O dễ dàng hóa lỏng khi nén ở nhiệt độ thường.
Khí N2O tan được trong nước với độ tan khoảng 0,15g/100ml nước ở 15°C. Độ tan này giảm khi nhiệt độ tăng lên.

Phản ứng hóa học quan trọng của N2O
Các phản ứng của N2O thường xảy ra ở nhiệt độ cao do tính bền vững của phân tử. Khí này có thể tham gia phản ứng oxi hóa và phân hủy.
Phản ứng với kim loại
N2O phản ứng được với một số kim loại hoạt động ở nhiệt độ cao như magie, nhôm. Phản ứng tạo thành oxit kim loại và giải phóng nitơ:
2Mg + N2O → 2MgO + N2
Tôi thường ví von phản ứng này như “cuộc đua” giữa kim loại và oxi – kim loại sẽ “cướp” oxi từ N2O để tạo oxit.
Phản ứng phân hủy nhiệt
Ở nhiệt độ trên 600°C, N2O bị phân hủy thành nitơ và oxi theo phương trình:
2N2O → 2N2 + O2
Phản ứng này tỏa nhiệt và có thể xảy ra nổ nếu nhiệt độ tăng đột ngột. Trong phòng thí nghiệm, tôi luôn nhắc học sinh phải hết sức cẩn thận khi thực hiện phản ứng này.
Phương pháp điều chế và nhận biết khí N2O trong phòng thí nghiệm
Khí N2O hay còn gọi là khí cười là một chất khí không màu, có mùi thơm nhẹ và vị ngọt. Chất khí này có nhiều ứng dụng trong y học và công nghiệp.
Việc điều chế và nhận biết khí N2O đòi hỏi các thao tác thí nghiệm cẩn thận và chính xác. Tương tự như công thức hoá học của nước mắt, N2O cũng là một hợp chất quan trọng cần nắm vững.

Các phương pháp điều chế N2O
Phương pháp phổ biến nhất để điều chế N2O là nhiệt phân muối NH4NO3 ở 170-260°C theo phương trình:
NH4NO3 → N2O + 2H2O
Cần kiểm soát nhiệt độ chặt chẽ vì ở trên 260°C, NH4NO3 có thể phân hủy nổ mạnh. Tôi thường khuyên học sinh dùng đèn cồn để gia nhiệt từ từ.
Một phương pháp khác là cho dung dịch NH2OH tác dụng với HNO2:
NH2OH + HNO2 → N2O + 2H2O
Cách nhận biết khí N2O
Để nhận biết khí N2O, ta có thể dựa vào các tính chất đặc trưng sau:
- Khí không màu, mùi thơm nhẹ, vị ngọt
- Tỉ khối so với không khí là 1,53
- Tan ít trong nước
- Không duy trì sự cháy của que đóm âm ỉ nhưng làm bùng cháy que đóm còn tàn đỏ
Khi tiến hành thí nghiệm, tôi thường cho học sinh quan sát hiện tượng que đóm tàn đỏ bùng cháy – đây là phản ứng đặc trưng để cách nhận biết khí N2O rất dễ nhớ và thú vị.
Ngoài ra có thể nhận biết qua phản ứng với dung dịch FeSO4 tạo phức màu nâu đặc trưng:
N2O + FeSO4 → [Fe(N2O)]SO4
Ứng dụng và tác dụng của khí cười trong đời sống
Khí cười N2O là một hợp chất hóa học có nhiều ứng dụng khí cười quan trọng trong đời sống. Chất khí này được phát hiện từ thế kỷ 18 và nhanh chóng được ứng dụng rộng rãi.
Với đặc tính an toàn và hiệu quả, khí N2O đã trở thành một công cụ không thể thiếu trong nhiều lĩnh vực. Tôi sẽ phân tích chi tiết các ứng dụng chính của nó.
Ứng dụng trong y học
Trong suốt 20 năm giảng dạy, tôi thường lấy ví dụ về tác dụng của khí cười trong phẫu thuật nha khoa. Khí N2O được trộn với oxy theo tỷ lệ 70:30 để gây mê nhẹ cho bệnh nhân.
Khí cười giúp giảm đau và tạo cảm giác thư giãn mà không gây mất ý thức hoàn toàn. Điều này giúp bác sĩ dễ dàng thực hiện các thủ thuật nha khoa.
Ngoài ra, khí N2O còn được sử dụng trong gây tê sản khoa và một số ca phẫu thuật nhỏ khác. Tính an toàn cao là ưu điểm lớn nhất của phương pháp này.
Ứng dụng trong công nghiệp
Công thức hóa học của khí cười N2O được ứng dụng rộng rãi trong công nghiệp thực phẩm. Nó được dùng làm chất tạo bọt cho kem tươi và các loại đồ uống có ga.
Trong ngành công nghiệp ô tô, N2O được sử dụng như một chất oxy hóa để tăng công suất động cơ. Khi phun vào buồng đốt, nó giúp tăng lượng oxy cho quá trình cháy.
Khí N2O cũng được dùng trong ngành điện tử để làm sạch các linh kiện nhạy cảm. Đặc tính không độc hại và dễ bay hơi giúp nó trở thành lựa chọn tối ưu.
Tác dụng sinh lý của khí N2O
Khi hít vào, N2O tác động lên hệ thần kinh trung ương gây ra cảm giác phấn khích nhẹ. Tôi thường giải thích cho học sinh rằng đây là lý do nó có tên “khí cười”.
Tuy nhiên, việc sử dụng không đúng cách có thể gây ra các tác dụng phụ như chóng mặt, buồn nôn. Trong một số trường hợp nghiêm trọng có thể dẫn đến thiếu oxy.
Kinh nghiệm giảng dạy cho thấy cần nhấn mạnh với học sinh về việc chỉ sử dụng N2O dưới sự giám sát của chuyên gia y tế. Lạm dụng khí này có thể gây ra những hậu quả nghiêm trọng.
FAQ: Câu hỏi thường gặp về khí cười N2O
Khí cười N2O là một chất khí không màu, có mùi ngọt nhẹ và được sử dụng phổ biến trong y tế. Tuy nhiên, nhiều người vẫn còn thắc mắc về tính an toàn và cách sử dụng loại khí này.
Khí N2O có độc không?
Khí N2O độc không phụ thuộc vào liều lượng và cách sử dụng. Ở nồng độ thấp và được kiểm soát bởi chuyên gia y tế, N2O an toàn cho người sử dụng.
Khi sử dụng đúng liều lượng, khí N2O chỉ gây tê tạm thời và không để lại độc tính. Tuy nhiên, việc lạm dụng hoặc sử dụng không đúng cách có thể gây nguy hiểm.
Tác dụng phụ khi sử dụng khí N2O?
Một số tác dụng phụ thường gặp khi sử dụng N2O bao gồm buồn nôn và chóng mặt nhẹ. Các triệu chứng này thường biến mất sau 5-10 phút.
Trong trường hợp sử dụng kéo dài, N2O có thể gây thiếu vitamin B12 và tổn thương thần kinh. Đặc biệt nguy hiểm nếu hít trực tiếp từ bình chứa không qua thiết bị điều chỉnh.
Cách bảo quản và sử dụng khí N2O an toàn
Bình chứa công thức hóa học của khí cười N2O cần được bảo quản ở nơi khô ráo, thoáng mát và tránh ánh nắng trực tiếp. Nhiệt độ bảo quản tốt nhất là 15-25°C.
Khi sử dụng cần tuân thủ nghiêm ngặt quy trình:
- Kiểm tra van điều áp trước mỗi lần sử dụng
- Không để bình N2O gần nguồn nhiệt
- Luôn có người giám sát khi sử dụng
- Không tự ý điều chỉnh áp suất bình chứa
Việc tuân thủ đúng quy trình sẽ đảm bảo an toàn tối đa khi sử dụng khí N2O.
Việc nắm vững công thức hóa học của khí cười N2O giúp hiểu rõ bản chất và tính chất của hợp chất này. Khí N2O có cấu trúc phân tử đặc biệt và nhiều ứng dụng quan trọng trong y học và công nghiệp. Các phương pháp điều chế, nhận biết và sử dụng an toàn khí N2O là kiến thức cần thiết cho học sinh khi học về hợp chất này. Mỗi người cần tuân thủ nghiêm ngặt quy tắc an toàn khi tiếp xúc với khí N2O.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

