Ghi nhớ công thức hóa học của carbon dioxide và tính chất cơ bản
Công thức hóa học của carbon dioxide đóng vai trò quan trọng trong tự nhiên và đời sống. Phân tử CO2 có cấu trúc đơn giản nhưng ẩn chứa nhiều tính chất đặc biệt. Các phản ứng hóa học của CO2 tạo nên những ứng dụng thiết thực trong công nghiệp và y tế.
Công thức hóa học của carbon dioxide
Công thức hóa học của carbon dioxide là CO2. Đây là một hợp chất vô cơ phổ biến trong tự nhiên và đời sống.
Công thức phân tử: CO2
- C: 1 nguyên tử carbon
- O: 2 nguyên tử oxygen
Cấu tạo phân tử CO2 có dạng thẳng với nguyên tử carbon ở giữa và hai nguyên tử oxygen ở hai đầu. Liên kết giữa C và O là liên kết cộng hóa trị kép.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức này bằng cách liên hệ với hiện tượng thở ra của con người. Khi chúng ta thở ra, khí thải chứa nhiều CO2.
Một cách dễ nhớ khác là liên tưởng đến nước ngọt có ga. Các bọt khí nổi lên trong nước ngọt chính là CO2 được hòa tan vào nước dưới áp suất cao.
Để kiểm tra sự hiện diện của CO2, chúng ta có thể sục khí này vào dung dịch nước vôi trong Ca(OH)2. Dung dịch sẽ chuyển từ trong sang đục do tạo kết tủa CaCO3.
Cấu tạo phân tử và tính chất của CO2
Cấu tạo phân tử CO2 là một phân tử tuyến tính gồm 1 nguyên tử carbon ở giữa và 2 nguyên tử oxygen ở hai đầu. Phân tử này có vai trò quan trọng trong tự nhiên và công nghiệp.
Tương tự như công thức hoá học của metan, CO2 cũng là một phân tử đơn giản nhưng có cấu trúc đặc biệt. Cấu trúc này quyết định các tính chất vật lý và hóa học của nó.
Cấu tạo phân tử CO2
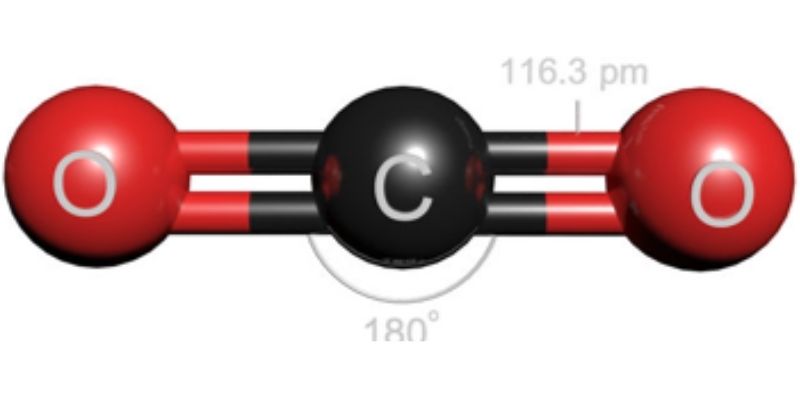
Phân tử CO2 có cấu tạo đối xứng với góc liên kết O=C=O là 180°. Mỗi nguyên tử oxygen tạo liên kết đôi với nguyên tử carbon trung tâm.
Trong phân tử, nguyên tử carbon có số oxi hóa +4 và mỗi nguyên tử oxygen có số oxi hóa -2. Điều này tạo nên sự cân bằng điện tích trong phân tử.
Liên kết trong phân tử CO2
Các liên kết trong CO2 là liên kết cộng hóa trị có cực yếu. Mỗi liên kết C=O là liên kết đôi gồm một liên kết σ và một liên kết π.
Tương tự như cấu trúc của cấu trúc phân tử kim cương, các electron trong CO2 cũng được sắp xếp theo quy luật bát tử. Nguyên tử carbon dùng 4 electron hóa trị để tạo 2 liên kết đôi với oxygen.
Độ dài liên kết C=O trong CO2 là 116.3 pm, ngắn hơn so với liên kết đơn C-O thông thường do có thêm liên kết π.
 Cấu tạo phân tử và tính chất của CO2
Cấu tạo phân tử và tính chất của CO2Hình dạng phân tử CO2
Phân tử CO2 có dạng tuyến tính với góc liên kết 180°. Cấu trúc này phù hợp với thuyết đẩy electron vỏ hóa trị VSEPR.
Hình dạng tuyến tính giúp phân tử CO2 không phân cực mặc dù các liên kết C=O có cực. Các mômen lưỡng cực của hai liên kết C=O triệt tiêu lẫn nhau.
Trong thực tế giảng dạy, tôi thường ví von hình dạng CO2 như một cây gậy thẳng với quả bóng oxygen ở hai đầu và quả bóng carbon ở giữa. Cách minh họa này giúp học sinh dễ hình dung và nhớ lâu.
Tính chất vật lý của khí carbon dioxide
Carbon dioxide (CO2) là một chất khí không màu, không mùi và có vị hơi chua nhẹ. Khí này đóng vai trò quan trọng trong quá trình quang hợp của thực vật và công thức của protein.
Khi tiếp xúc với không khí ẩm, CO2 nặng hơn không khí khoảng 1,5 lần. Điều này khiến nó thường tích tụ ở các vùng thấp như hầm mỏ, hang động.
Trạng thái tự nhiên của CO2
CO2 là chất khí ở điều kiện thường, nhưng có thể chuyển sang trạng thái rắn ở -78,5°C. Đây là hiện tượng thăng hoa trực tiếp từ rắn sang khí mà không qua trạng thái lỏng.
Trong tự nhiên, CO2 có màu trong suốt hoàn toàn và carbohydrate công thức hóa học. Tôi thường ví von với học sinh rằng CO2 giống như “người vô hình” trong không khí.
Độ tan trong nước của CO2
CO2 tan trong nước khá tốt, tạo thành acid carbonic (H2CO3). Ở 20°C và áp suất 1 atm, 1 lít nước có thể hòa tan được khoảng 0,88 lít CO2.
Khi nhiệt độ tăng lên, độ tan của CO2 trong nước giảm xuống. Đó là lý do nước ngọt có ga thường sủi bọt nhiều hơn khi để ấm.
Khối lượng riêng của CO2
CO2 có mùi đặc trưng không thể nhận biết được bằng khứu giác của con người. Khối lượng riêng của CO2 ở điều kiện tiêu chuẩn là 1,98 kg/m³.
Với khối lượng riêng này, CO2 nặng hơn không khí đáng kể. Trong phòng thí nghiệm, tôi thường cho học sinh làm thí nghiệm đổ CO2 từ cốc này sang cốc khác như đổ nước.
Tính chất hóa học của carbon dioxide
Carbon dioxide là một chất khí không màu, không mùi và nặng hơn không khí. Khí CO2 có nhiều tính chất hóa học đặc trưng và ứng dụng quan trọng trong đời sống.
Phản ứng với nước tạo axit cacbonic
Khi hòa tan trong nước, công thức hóa học của cacbonic được tạo thành theo phương trình:
CO2 + H2O ⇌ H2CO3
Axit cacbonic là axit yếu, không bền và dễ phân hủy ngược lại thành CO2 và H2O. Tương tự như axit clohidric công thức hóa học, H2CO3 có thể phân ly trong nước tạo ion H+.
Phản ứng với bazơ
CO2 có tính chất gì nổi bật nhất là khả năng phản ứng với bazơ. Phản ứng này tạo muối cacbonat và nước:
CO2 + 2NaOH → Na2CO3 + H2O
Phản ứng này giống với phản ứng của công thức axit sunfuric với bazơ. CO2 còn có thể phản ứng với dung dịch Ca(OH)2 tạo kết tủa trắng CaCO3.
 Tính chất hóa học của carbon dioxide
Tính chất hóa học của carbon dioxideTính oxi hóa khử
Carbon dioxide thể hiện tính oxi hóa trong nhiều phản ứng hóa học. CO2 có thể bị khử thành CO hoặc C trong điều kiện nhiệt độ cao:
CO2 + C → 2CO (ở 1000°C)
Trong quá trình quang hợp của thực vật, CO2 cũng bị khử thành glucoza nhờ năng lượng ánh sáng mặt trời. Đây là phản ứng quan trọng giúp duy trì sự sống trên Trái đất.
Ứng dụng của carbon dioxide trong đời sống
Carbon dioxide với công thức hóa học CO2 có vai trò quan trọng trong nhiều lĩnh vực khác nhau. Khí này tham gia vào nhiều quá trình sản xuất và ứng dụng thiết thực. Tôi sẽ phân tích chi tiết các ứng dụng chính của CO2 trong đời sống.
Ứng dụng trong công nghiệp thực phẩm
CO2 được sử dụng phổ biến trong bảo quản và chế biến thực phẩm. Khí này giúp tạo bọt cho đồ uống có ga và làm tăng độ xốp cho bánh mì.
Trong quy trình làm bánh, CO2 sinh ra từ phản ứng giữa công thức hoá học của baking soda với acid. Quá trình này tạo nên độ nở xốp đặc trưng.
CO2 còn được dùng để bảo quản thực phẩm trong môi trường khí quyển biến đổi. Phương pháp này giúp kéo dài thời gian bảo quản công thức hóa học của đường glucose và các loại thực phẩm khác.
Ứng dụng trong y tế
CO2 đóng vai trò quan trọng trong các phẫu thuật nội soi. Bác sĩ bơm khí này vào khoang phẫu thuật để tạo không gian làm việc.
Trong điều trị da liễu, CO2 lỏng được sử dụng để điều trị các tổn thương da. Phương pháp này an toàn và mang lại hiệu quả cao.
Theo nghiên cứu của Bệnh viện Đại học Y Dược TP.HCM, liệu pháp CO2 giúp cải thiện 85% các trường hợp sẹo lõm và nám da.
Ứng dụng trong nông nghiệp
CO2 thúc đẩy quá trình quang hợp của cây trồng trong nhà kính. Nồng độ CO2 tăng giúp cây phát triển nhanh hơn.
Khí này còn được sử dụng để diệt côn trùng gây hại trong kho bảo quản nông sản. Phương pháp này an toàn và không để lại dư lượng độc hại.

Các nhà vườn thường bổ sung CO2 vào không khí để tăng năng suất cây trồng. Kỹ thuật này đặc biệt hiệu quả với rau củ và hoa.
FAQ: Câu hỏi thường gặp về carbon dioxide
Carbon dioxide (CO2) là một chất khí phổ biến trong tự nhiên và đời sống. Tôi sẽ giải đáp một số thắc mắc thường gặp về khí này.
Khí CO2 có độc không?
Khí CO2 có độc không phụ thuộc vào nồng độ và thời gian tiếp xúc. Ở nồng độ thấp dưới 1%, CO2 không gây độc cho cơ thể.
Tuy nhiên, khi nồng độ CO2 trong không khí vượt quá 5%, nó có thể gây ra các triệu chứng như khó thở và chóng mặt. Điều này tương tự như khi bạn ở trong phòng kín thiếu không khí.
Nồng độ CO2 trên 10% có thể gây nguy hiểm đến tính mạng. Vì vậy cần thận trọng khi làm việc trong môi trường có nhiều CO2 như cấu tạo phân tử dầu ăn bị đốt cháy.
Tại sao CO2 gây hiệu ứng nhà kính?
CO2 có khả năng hấp thụ bức xạ hồng ngoại từ bề mặt Trái đất. Quá trình này giống như tấm kính trong nhà kính giữ nhiệt.
Khi nồng độ CO2 tăng cao do đốt nhiên liệu hóa thạch như công thức hóa học của dầu diesel, lượng nhiệt giữ lại trong khí quyển càng nhiều.
Điều này làm tăng nhiệt độ trung bình của Trái đất, gây ra hiện tượng nóng lên toàn cầu và biến đổi khí hậu nghiêm trọng.
Làm thế nào để phát hiện CO2?
Phương pháp đơn giản nhất là dùng nước vôi trong Ca(OH)2. Khi CO2 đi qua nước vôi trong sẽ tạo kết tủa trắng CaCO3.
Trong phòng thí nghiệm, các thiết bị đo khí CO2 chuyên dụng được sử dụng. Chúng hoạt động dựa trên nguyên lý hấp thụ bức xạ hồng ngoại.
Ngoài ra, sinh vật chỉ thị như nến cháy cũng có thể phát hiện CO2. Nến sẽ tắt trong môi trường có nồng độ CO2 cao do thiếu oxy.
Kiến thức về công thức hóa học của carbon dioxide giúp chúng ta hiểu rõ bản chất và vai trò của hợp chất quan trọng này. CO2 là một phân tử tuyến tính với liên kết đôi C=O bền vững, tạo nên những tính chất đặc trưng như không màu, không mùi và nặng hơn không khí. Phân tử này tham gia vào nhiều phản ứng hóa học thiết yếu và có ứng dụng rộng rãi trong công nghiệp, y tế và nông nghiệp.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

