Thông tin về công thức hóa học của bạc và các hợp chất quan trọng
Công thức hóa học của bạc đóng vai trò quan trọng trong ngành công nghiệp và đời sống. Bạc tạo nhiều hợp chất đặc biệt như AgNO3, Ag2O, AgCl và Ag2SO4. Các hợp chất này có tính chất độc đáo và ứng dụng rộng rãi trong thực tiễn. Chúng tôi phân tích chi tiết từng hợp chất để bạn dễ dàng ghi nhớ.
Công thức hóa học của bạc và các hợp chất quan trọng
Bạc là kim loại quý có ký hiệu hóa học là Ag, số hiệu nguyên tử 47. Công thức hóa học của bạc và các hợp chất của nó thường xuất hiện trong các bài tập hóa học phổ thông.
Bạc nguyên chất có màu trắng bạc đặc trưng, khối lượng nguyên tử là 107,87. Trong tự nhiên, bạc tồn tại ở dạng đơn chất Ag và các hợp chất như:
AgNO3 (Bạc nitrat): Tinh thể không màu, dễ tan trong nước, được sử dụng làm thuốc thử trong phòng thí nghiệm. Tôi thường dùng AgNO3 để nhận biết ion Cl- trong dung dịch.
Ag2O (Bạc (I) oxit): Bột màu nâu đen, khó tan trong nước. Đây là oxit bazơ, có thể tác dụng với axit tạo muối và nước. Học sinh hay nhầm lẫn công thức này với AgO.
AgCl (Bạc clorua): Kết tủa màu trắng, không tan trong nước. Phản ứng tạo AgCl là một trong những phản ứng đặc trưng để nhận biết ion Ag+ và Cl-.
Ag2S (Bạc sunfua): Chất rắn màu đen, không tan trong nước. Khi bạc tiếp xúc với không khí có chứa H2S sẽ bị đen do tạo thành Ag2S.
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh dễ nhớ các công thức này khi liên hệ với màu sắc đặc trưng và ứng dụng thực tế của chúng.
Bạc nitrat AgNO3 – Hợp chất quan trọng của bạc trong công nghiệp và đời sống
Bạc nitrat là một muối vô cơ có công thức AgNO3 với cấu trúc ion gồm Ag+ và NO3-. Đây là hợp chất quan trọng của bạc được ứng dụng rộng rãi trong nhiều lĩnh vực.
Tương tự như công thức hóa học của đồng, bạc nitrat có vai trò quan trọng trong công nghiệp điện tử và mạ kim loại. Hợp chất này cũng được sử dụng nhiều trong y học và nhiếp ảnh.
Cấu tạo phân tử và tính chất của AgNO3
Bạc nitrat cấu tạo từ ion Ag+ và NO3- liên kết với nhau bằng liên kết ion. Trong đó, ion Ag+ đóng vai trò là cation và NO3- là anion.
Bạc nitrat tồn tại ở dạng tinh thể không màu, trong suốt ở nhiệt độ thường. Hợp chất này tan rất tốt trong nước và có tính oxi hóa mạnh.
Giống như công thức hóa học của bazơ, bạc nitrat có khả năng phản ứng với nhiều chất khác để tạo thành các sản phẩm mới.
Phản ứng đặc trưng của AgNO3 với NaCl
Phản ứng AgNO3 với NaCl là một trong những phản ứng đặc trưng nhất của bạc nitrat. Phản ứng tạo ra kết tủa AgCl màu trắng không tan trong nước:
AgNO3 + NaCl → AgCl↓ + NaNO3
Phản ứng này thường được sử dụng để nhận biết ion Cl- trong dung dịch. Kết tủa AgCl có màu trắng và không tan trong nước nhưng tan được trong dung dịch NH3.
Ứng dụng của bạc nitrat trong thực tế
Bạc nitrat tính chất đặc biệt giúp nó được ứng dụng rộng rãi trong nhiều lĩnh vực. Trong y học, bạc nitrat được dùng làm thuốc sát trùng và điều trị một số bệnh ngoài da.
Trong công nghiệp, bạc nitrat là nguyên liệu quan trọng để sản xuất gương phẳng. Hợp chất này cũng được sử dụng trong ngành nhiếp ảnh truyền thống để tạo ra các hình ảnh.
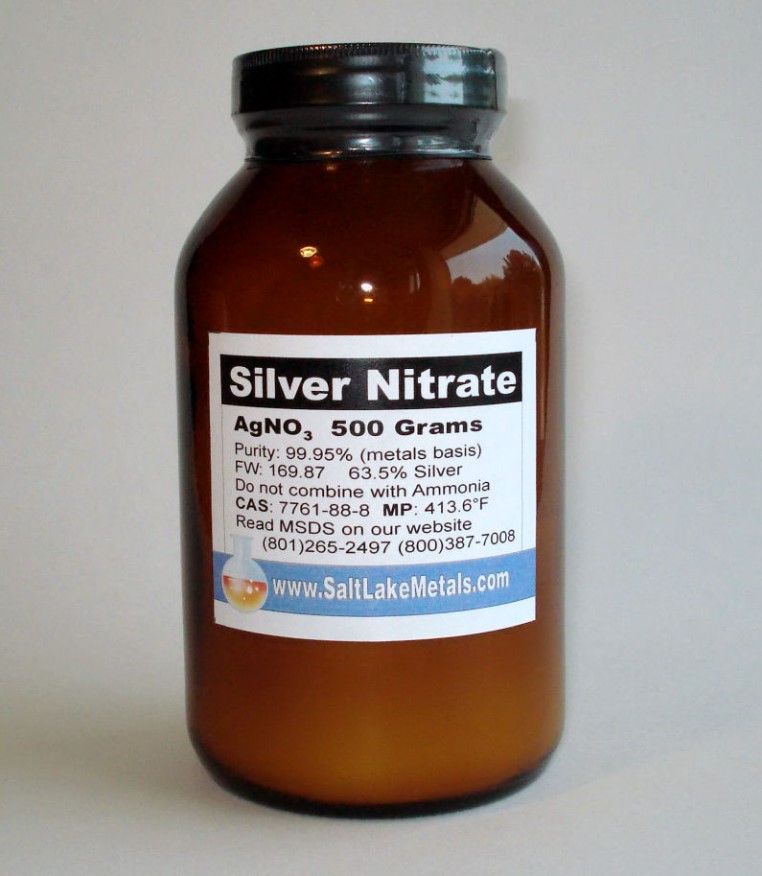
Trong phòng thí nghiệm, bạc nitrat thường được dùng làm thuốc thử để phát hiện ion halogen như Cl-, Br-, I- thông qua phản ứng tạo kết tủa.
Bạc oxit Ag2O và các phản ứng tạo thành
Bạc oxit là hợp chất vô cơ với công thức Ag2O, có màu nâu đen và tồn tại ở dạng bột. Hợp chất này đóng vai trò quan trọng trong nhiều ứng dụng công nghiệp và thí nghiệm hóa học.
Tương tự như oxit sắt từ công thức, bạc oxit cũng là một oxit kim loại điển hình. Khi tiếp xúc với ánh sáng, bạc oxit tạo thành các sản phẩm phân hủy là bạc kim loại và oxi.
Cấu tạo và tính chất của bạc oxit
Bạc oxit có cấu trúc tinh thể lập phương tâm khối. Trong đó, mỗi ion Ag+ được bao quanh bởi 2 ion O2- theo hình học tuyến tính.
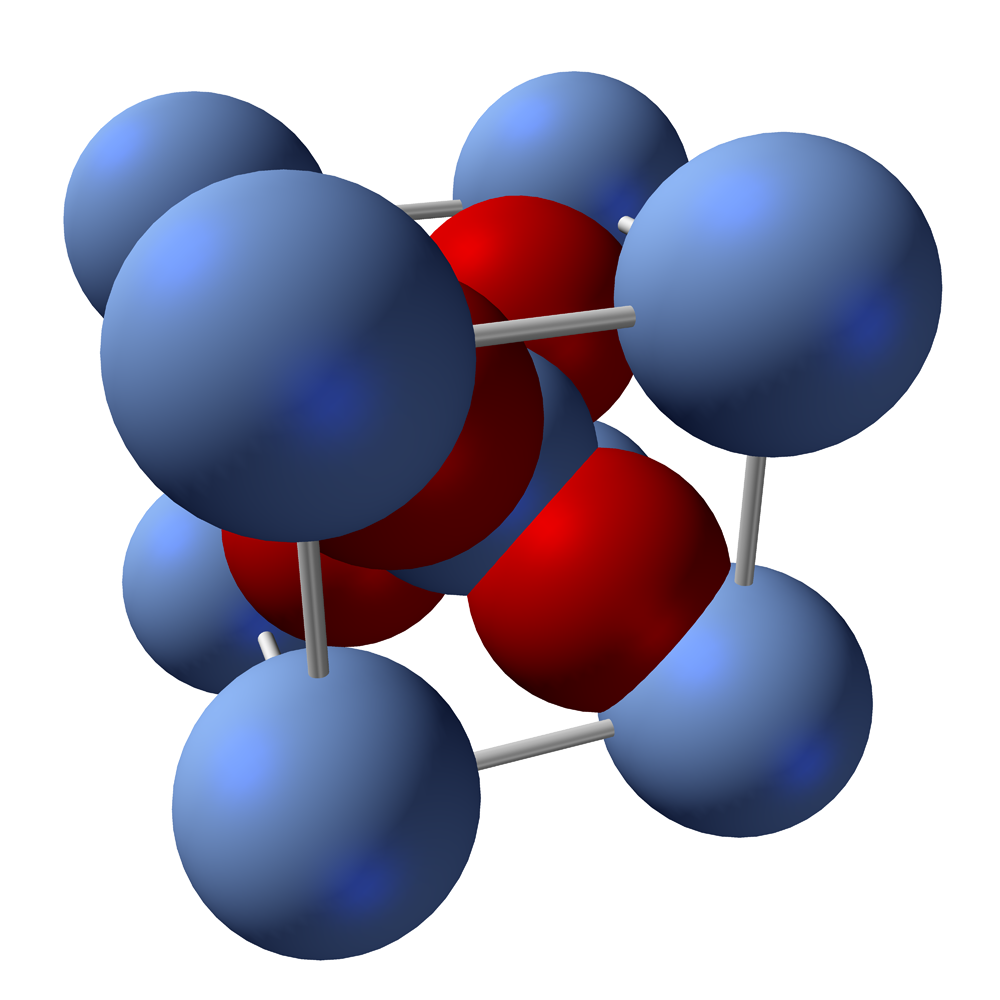
Hợp chất này có khả năng tan rất ít trong nước, tạo thành dung dịch bazơ yếu. Khi nhiệt độ tăng cao trên 300°C, bạc oxit sẽ phân hủy hoàn toàn.
Trong môi trường axit, bạc oxit phản ứng tạo thành muối bạc và nước. Đây là phản ứng quan trọng trong phòng thí nghiệm và sản xuất.
Các phương pháp điều chế Ag2O
Phương pháp phổ biến nhất để điều chế bạc oxit là cho dung dịch AgNO3 tác dụng với dung dịch kiềm NaOH hoặc KOH:
2AgNO3 + 2NaOH → Ag2O↓ + 2NaNO3 + H2O
Một phương pháp khác là điện phân dung dịch AgNO3 với điện cực than chì. Quá trình này tạo ra bạc oxit tại anot:
4Ag+ + 2H2O → 2Ag2O + 4H+ + 2e-
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh cần chú ý điều kiện nhiệt độ và nồng độ chất phản ứng để thu được sản phẩm tinh khiết.
Bạc clorua AgCl và hiện tượng kết tủa đặc trưng
Bạc clorua là một hợp chất vô cơ có công thức hóa học là AgCl. Đây là chất rắn màu trắng, không tan trong nước nhưng tan trong amoniac.
Khi cho dung dịch muối bạc tác dụng với dung dịch chứa ion Cl-, AgCl kết tủa sẽ xuất hiện ngay lập tức dưới dạng kết tủa màu trắng. Hiện tượng này tương tự như phản ứng tạo công thức hóa học của vàng.
Trong quá trình giảng dạy, tôi thường ví von AgCl như một “bông tuyết” trắng muốt rơi xuống đáy ống nghiệm. Điều này giúp học sinh dễ nhớ và hứng thú hơn với môn học.
Tính chất và ứng dụng của AgCl
Bạc clorua có nhiều tính chất đặc trưng quan trọng. Chất này không tan trong nước lạnh và nước nóng, nhưng tan được trong dung dịch amoniac tạo phức [Ag(NH3)2]Cl.
AgCl có khả năng bị phân hủy dưới tác dụng của ánh sáng, chuyển thành màu tím đen. Tính chất này được ứng dụng trong ngành nhiếp ảnh truyền thống.
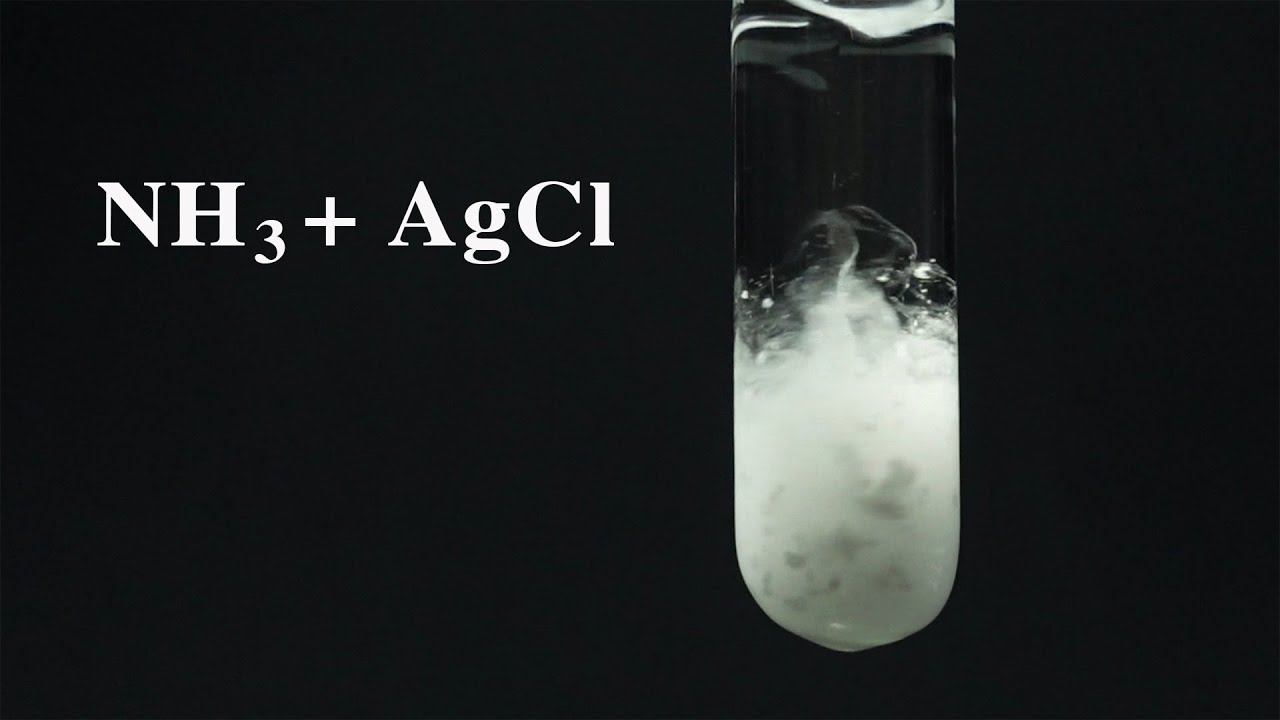
Trong công nghiệp, AgCl được sử dụng để sản xuất các hợp chất bạc khác như đồng sunfat là gì. Ngoài ra, nó còn được dùng làm chất điện phân trong pin nhiên liệu.
Phản ứng tạo kết tủa AgCl
Phản ứng tạo kết tủa AgCl diễn ra theo phương trình:
AgNO3 + NaCl → AgCl↓ + NaNO3
Trong đó:
- AgNO3: Dung dịch bạc nitrat
- NaCl: Dung dịch natri clorua
- AgCl↓: Kết tủa bạc clorua màu trắng
- NaNO3: Natri nitrat hòa tan trong dung dịch
Phản ứng này thường được sử dụng để nhận biết ion Cl- trong dung dịch. Tôi thường hướng dẫn học sinh quan sát kỹ màu sắc và đặc điểm của kết tủa để phân biệt với các kết tủa khác.
Bạc sunfat Ag2SO4 và các phản ứng quan trọng
Bạc sunfat (Ag2SO4) là một hợp chất vô cơ có màu trắng, tồn tại ở dạng tinh thể. Hợp chất này được tạo thành từ ion bạc Ag+ và ion sulfat SO42-.
Công thức hóa học của bạc sunfat có thể viết là Ag2SO4, trong đó tỉ lệ ion bạc và ion sulfat là 2:1. Hợp chất này có cấu trúc tinh thể monoclinic.
Một số phản ứng quan trọng của bạc sunfat như phản ứng với dung dịch muối halogenua tạo kết tủa AgX. Giống như công thức hóa học của kim cương, cấu trúc của nó rất bền vững.

Cấu tạo và tính chất của Ag2SO4
Bạc sunfat có cấu tạo tinh thể với các ion Ag+ và SO42- sắp xếp theo mạng tinh thể monoclinic. Hợp chất này có độ tan trong nước là 8,3g/L ở 25°C.
Ag2SO4 phản ứng mạnh với các halogenua tạo kết tủa AgX có màu đặc trưng. Phản ứng này thường được sử dụng để nhận biết ion halogenua trong dung dịch.
Tương tự như công thức của thép, bạc sunfat bền trong không khí và không bị phân hủy bởi ánh sáng. Hợp chất này có tính oxi hóa mạnh.
Ứng dụng của bạc sunfat trong thực tế
Bạc sunfat ứng dụng rộng rãi trong công nghiệp điện phân để tạo lớp mạ bạc. Quá trình này giúp tạo ra các sản phẩm trang sức và đồ gia dụng có độ bóng cao.
Trong y học, bạc sunfat được sử dụng làm thuốc sát trùng và kháng khuẩn. Hợp chất này có khả năng tiêu diệt vi khuẩn hiệu quả mà không gây kích ứng.
Ngoài ra, bạc sunfat còn được dùng trong ngành công nghiệp nhiếp ảnh truyền thống để tạo ra các hợp chất nhạy sáng trên phim ảnh và giấy in ảnh.
FAQ: Câu hỏi thường gặp về các hợp chất của bạc
Các hợp chất của bạc thường gặp nhiều câu hỏi từ học sinh và sinh viên khi học tập. Tôi sẽ giải đáp những thắc mắc phổ biến nhất về các công thức hóa học của bạc và cách nhận biết chúng.
Giống như thành phần nước mắt có chứa NaCl, các hợp chất của bạc cũng có những đặc điểm riêng biệt. Việc phân biệt và bảo quản chúng đòi hỏi sự cẩn thận.
Phân biệt các hợp chất của bạc trong phòng thí nghiệm
Để phân biệt các hợp chất của bạc, ta dựa vào màu sắc và độ tan của chúng. AgCl có màu trắng và không tan trong nước.
AgBr có màu vàng nhạt, còn AgI có màu vàng đậm. Cả hai đều không tan trong nước giống như công thức hóa học của bột nở.
Ag2O có màu nâu đen, dễ bị phân hủy khi đun nóng. Ag2S có màu đen và rất bền với nhiệt.
Cách bảo quản các hợp chất của bạc
Các hợp chất của bạc cần được bảo quản trong lọ thủy tinh màu nâu hoặc đen. Điều này giúp tránh ánh sáng trực tiếp gây phân hủy.
Nhiệt độ bảo quản tốt nhất là 15-25°C, độ ẩm dưới 75%. Nơi bảo quản phải khô ráo, thoáng mát.
Tôi thường hướng dẫn học sinh đặt các lọ đựng hợp chất bạc trong tủ có khóa. Việc này giúp tránh tiếp xúc với không khí và ánh sáng.
Việc nắm vững các công thức hóa học của bạc giúp học sinh dễ dàng phân biệt và ghi nhớ các hợp chất quan trọng như AgNO3, Ag2O, AgCl và Ag2SO4. Các phản ứng đặc trưng của những hợp chất này có vai trò thiết yếu trong phòng thí nghiệm và ứng dụng thực tế. Kiến thức về cấu tạo, tính chất và phản ứng của các hợp chất bạc tạo nền tảng vững chắc cho việc học tập hóa học nâng cao.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

