Tìm hiểu công thức hóa học của axit nitric và ứng dụng trong đời sống
Công thức hóa học của axit nitric là một kiến thức nền tảng trong chương trình hóa học phổ thông. Axit nitric đóng vai trò quan trọng trong nhiều ngành công nghiệp hiện đại. Bài viết phân tích chi tiết cấu trúc phân tử, tính chất và ứng dụng thiết thực của hợp chất này.
Công thức hóa học của axit nitric
Công thức hóa học của axit nitric là HNO3. Đây là một axit mạnh được sử dụng rộng rãi trong công nghiệp hóa chất và phòng thí nghiệm.
Trong công thức của axit nitric HNO3, mỗi phân tử gồm:
- H: 1 nguyên tử hydro
- N: 1 nguyên tử nitơ
- O: 3 nguyên tử oxi
Axit nitric có cấu trúc phân tử dạng phẳng tam giác, trong đó nguyên tử N ở trung tâm liên kết với 3 nguyên tử O và 1 nguyên tử H. Một trong ba liên kết N-O là liên kết đôi.
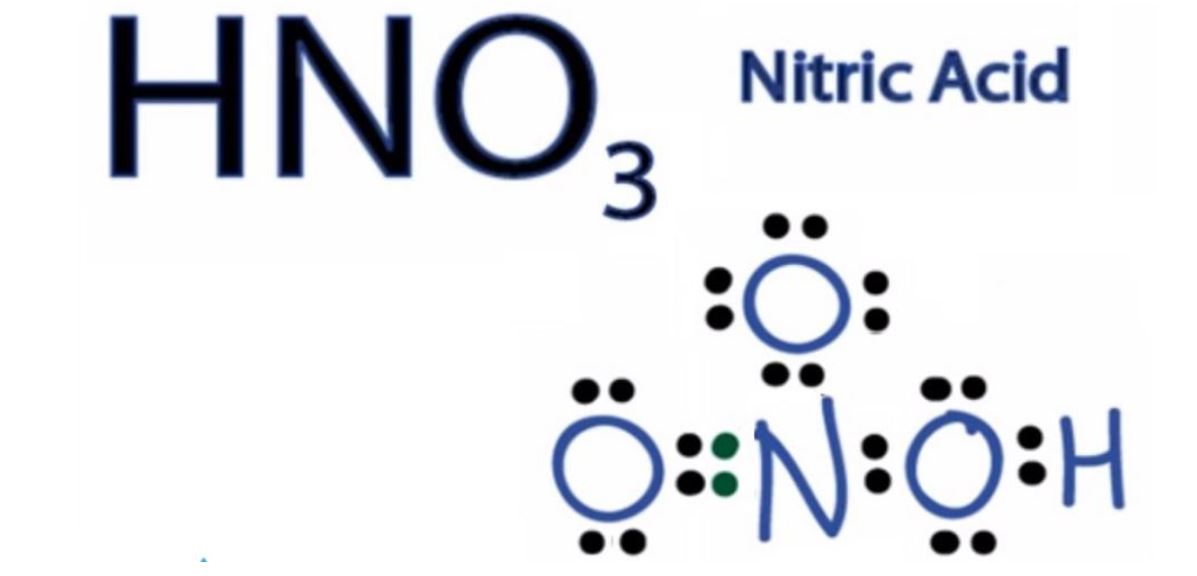
Qua 20 năm giảng dạy, tôi thường gợi ý học sinh ghi nhớ công thức này bằng cách liên tưởng đến chữ số 3 – số nguyên tử oxi trong phân tử. Điều này giúp các em không nhầm lẫn với các axit khác.
Khi viết phương trình phản ứng, cần chú ý HNO3 là axit mạnh nên phân ly hoàn toàn trong nước:
HNO3 → H+ + NO3-
Đây là kiến thức nền tảng quan trọng để giải các bài tập về phản ứng của axit nitric với kim loại, bazơ và muối.
Cấu tạo phân tử và đặc điểm của axit nitric
Công thức phân tử của axit nitric là HNO3. Đây là một axit vô cơ mạnh thường được sử dụng trong công nghiệp hóa chất. Tương tự như công thức hóa học của axit clohiđric, axit nitric có công thức hóa học là HNO3 với cấu trúc đặc trưng.
Cấu trúc phân tử HNO3
Phân tử HNO3 có cấu trúc phẳng tam giác với nguyên tử N ở trung tâm. Ba nguyên tử O được sắp xếp xung quanh nguyên tử N. Một nguyên tử O liên kết với H tạo nhóm OH.
Góc liên kết O-N-O trong phân tử xấp xỉ 120°. Điều này phù hợp với cấu hình electron và lai hóa sp2 của nguyên tử N trung tâm.
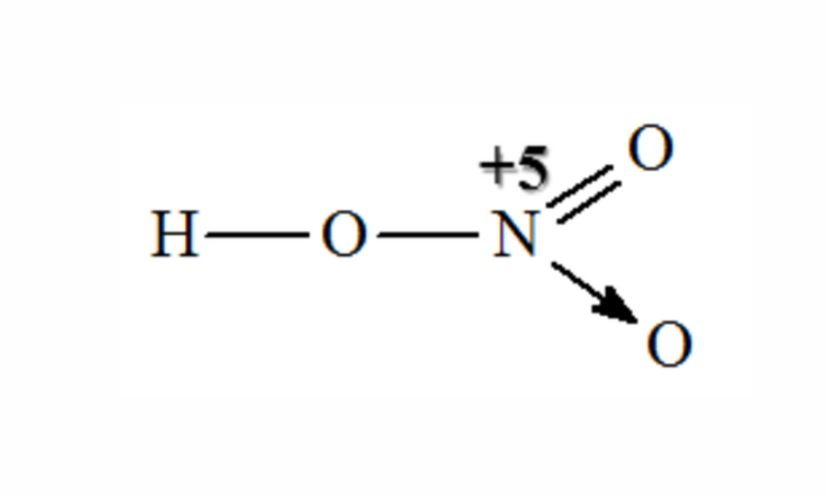
Liên kết hóa học trong phân tử
Trong phân tử HNO3 tồn tại hai loại liên kết chính:
- Liên kết cộng hóa trị phân cực N-O
- Liên kết cộng hóa trị có cực O-H
Độ dài liên kết N-O dao động từ 1,20Å đến 1,41Å. Liên kết N-OH dài hơn so với hai liên kết N=O còn lại do hiệu ứng cộng hợp π.
Các đặc điểm vật lý của axit nitric
Ở điều kiện thường, HNO3 là chất lỏng không màu, có mùi xốc đặc trưng. Nhiệt độ nóng chảy của axit nitric là -42°C.
Axit nitric có khả năng hòa tan rất tốt trong nước. Quá trình hòa tan tỏa nhiệt mạnh và tạo dung dịch axit có tính ăn mòn cao.
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh cần đặc biệt thận trọng khi tiếp xúc với axit nitric. Dung dịch đậm đặc có thể gây bỏng nặng khi tiếp xúc với da.
Tính chất hóa học cơ bản của axit nitric
Tính chất axit nitric được thể hiện qua nhiều phản ứng hóa học đặc trưng. Axit nitric (HNO3) là một axit vô cơ mạnh, có tính oxi hóa mạnh và phản ứng được với nhiều chất.
Tương tự như axit fomic là gì, công thức của axit nitric là HNO3 – một phân tử gồm 1 nguyên tử H, 1 nguyên tử N và 3 nguyên tử O.
Tính axit mạnh
HNO3 phân ly hoàn toàn trong nước theo phương trình:
HNO3 → H+ + NO3-
Độ điện ly α ≈ 1 cho thấy đây là axit mạnh một nấc. Trong dung dịch, HNO3 tồn tại chủ yếu dưới dạng ion H+ và NO3-.
Tôi thường ví von với học sinh rằng HNO3 giống như một “võ sĩ” mạnh mẽ, luôn sẵn sàng “tặng” proton H+ cho đối thủ.
Tính oxi hóa
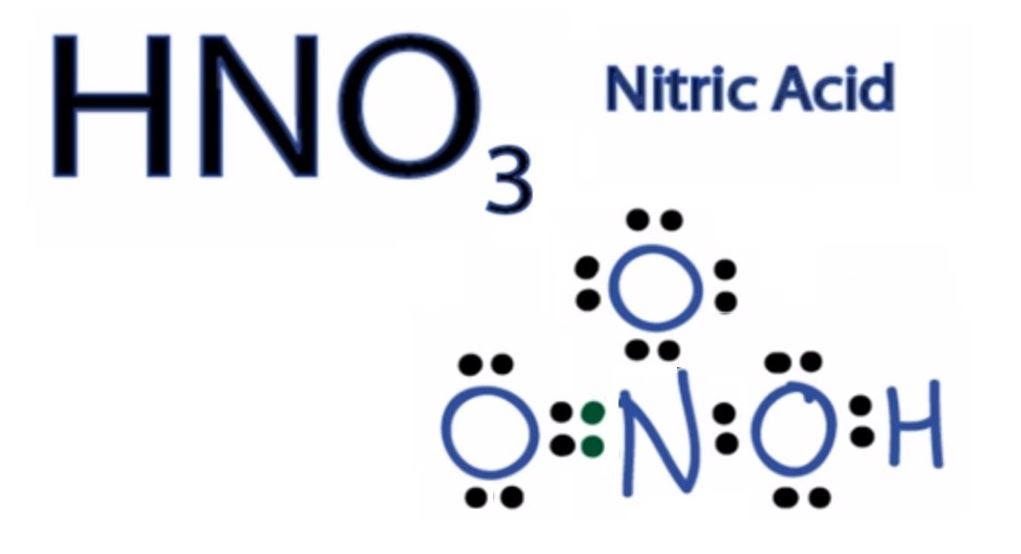
HNO3 có tính oxi hóa mạnh nhờ có nitơ với số oxi hóa +5. Khi tham gia phản ứng, N+5 thường bị khử thành các mức thấp hơn như N+4, N+2, N0, N-3.
Trong quá trình giảng dạy, tôi luôn nhấn mạnh với học sinh về màu khí NO2 nâu đỏ – dấu hiệu nhận biết quan trọng của phản ứng oxi hóa khử có HNO3.
Phản ứng với kim loại
HNO3 phản ứng được với hầu hết kim loại, trừ Au và Pt. Sản phẩm khử của HNO3 phụ thuộc vào nồng độ axit và bản chất kim loại.
Với HNO3 loãng:
8HNO3 + 3Cu → 3Cu(NO3)2 + 2NO + 4H2O
Với HNO3 đặc:
4HNO3 + Cu → Cu(NO3)2 + 2NO2 + 2H2O
Phản ứng với bazơ
HNO3 tác dụng với bazơ tạo muối nitrat và nước:
HNO3 + NaOH → NaNO3 + H2O
Phản ứng trung hòa này diễn ra nhanh và mạnh. Muối nitrat tạo thành thường tan tốt trong nước.
Đây là phản ứng quan trọng trong công nghiệp sản xuất phân bón và thuốc nổ.
Ứng dụng quan trọng của axit nitric trong đời sống và công nghiệp
Axit nitric trong đời sống có vai trò vô cùng quan trọng với nhiều ứng dụng đa dạng. Hợp chất này không chỉ là nguyên liệu cơ bản trong công nghiệp mà còn liên quan mật thiết đến sức khỏe con người, tương tự như công thức hóa học của vitamin c.
Với tính chất là một axit mạnh và có khả năng oxi hóa cao, ứng dụng axit nitric được thể hiện rõ nét trong 3 lĩnh vực chính: sản xuất phân bón, công nghiệp hóa chất và sản xuất thuốc nổ.
Sản xuất phân bón
Axit nitric đóng vai trò then chốt trong sản xuất phân bón amoni nitrat (NH4NO3). Đây là loại phân bón cung cấp nitơ dễ hấp thu cho cây trồng.
Quá trình sản xuất diễn ra qua phản ứng trung hòa giữa axit nitric và amoniac:
HNO3 + NH3 → NH4NO3
Theo số liệu từ Hiệp hội Phân bón Việt Nam, mỗi năm ngành công nghiệp phân bón tiêu thụ khoảng 500.000 tấn axit nitric để sản xuất phân đạm.
Công nghiệp hóa chất
Trong công nghiệp hóa chất, axit nitric được sử dụng làm chất oxi hóa mạnh để tổng hợp nhiều hợp chất quan trọng.
Axit nitric tham gia vào quá trình nitro hóa các hợp chất hữu cơ, tạo ra các dẫn xuất nitro có giá trị như nitrobenzen và nitrotoluen.
Ngoài ra, axit nitric còn được dùng trong sản xuất thuốc nhuộm, chất tẩy rửa và các hóa chất tinh khiết phục vụ nghiên cứu.
Công nghiệp thuốc nổ
Axit nitric là nguyên liệu không thể thiếu trong sản xuất thuốc nổ TNT (trinitrotoluen) và nitroglycerin.
Phản ứng nitro hóa toluen bằng axit nitric tạo ra TNT diễn ra theo phương trình:

C7H8 + 3HNO3 → C7H5(NO2)3 + 3H2O
Việc kiểm soát chặt chẽ nhiệt độ và nồng độ axit là yếu tố quyết định đến chất lượng sản phẩm thuốc nổ. Tôi thường nhấn mạnh với sinh viên rằng đây là quá trình đòi hỏi độ chính xác và an toàn cao.
FAQ: Câu hỏi thường gặp về axit nitric
Axit nitric là gì và những câu hỏi liên quan luôn được nhiều người quan tâm. Tôi sẽ giải đáp các thắc mắc phổ biến nhất về loại axit này.
Axit nitric có độc không?
Axit nitric là một chất cực độc và nguy hiểm. Khi tiếp xúc với da, nó gây bỏng nặng và để lại sẹo vàng khó phai.
Khói axit nitric màu nâu đỏ có thể gây tổn thương phổi nghiêm trọng nếu hít phải. Tương tự như công thức hóa học của nước mắt, nó kích ứng mạnh niêm mạc.
Cách bảo quản axit nitric an toàn
Axit nitric cần được bảo quản trong chai thủy tinh màu nâu, có nút kín. Nhiệt độ bảo quản tối ưu từ 15-25°C.
Tránh ánh sáng trực tiếp và nhiệt độ cao vì axit dễ phân hủy tạo khí độc NO2. Giống như công thức hóa học của protein, axit nitric rất nhạy cảm với điều kiện môi trường.
Phải đặt chai đựng trong khay chống tràn và xa các hóa chất khác. Cách viết công thức axit nitric chuẩn là HNO3.
Cách nhận biết axit nitric trong phòng thí nghiệm
Axit nitric có màu trong suốt hoặc hơi vàng nhạt. Khi tiếp xúc với kim loại tạo khí NO2 màu nâu đỏ đặc trưng.
Phản ứng với đồng tạo dung dịch xanh lam và khí nâu đỏ. Đây là phương pháp định tính phổ biến trong phòng thí nghiệm.
Có thể nhận biết qua mùi hăng cay nồng đặc trưng. Tuy nhiên không nên ngửi trực tiếp vì rất độc hại.
Kiến thức về công thức hóa học của axit nitric giúp người học nắm vững cấu trúc phân tử HNO3 và các tính chất đặc trưng của nó. Axit nitric là một chất quan trọng trong công nghiệp hóa chất với khả năng oxi hóa mạnh và nhiều ứng dụng thiết thực. Việc nắm chắc cấu tạo, tính chất và cách sử dụng an toàn axit nitric là nền tảng để học tập tốt môn hóa học và áp dụng trong thực tiễn.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

