Hiểu sâu công thức hóa học của axit clohiđric và ứng dụng thực tế
Công thức hóa học của axit clohiđric là kiến thức nền tảng trong chương trình phổ thông. Chất này đóng vai trò quan trọng trong nhiều ngành công nghiệp. Các phản ứng hóa học đặc trưng của nó tạo nên nhiều ứng dụng thiết thực trong đời sống.
Công thức hóa học của axit clohiđric
Axit clohiđric có công thức hóa học là HCl. Đây là một axit đơn chức phổ biến trong phòng thí nghiệm và công nghiệp.
Khi viết công thức hóa học của axit clohiđric, ta cần chú ý:
- H: Nguyên tử hiđro có hóa trị I
- Cl: Nguyên tử clo có hóa trị I
- Không có chỉ số phân tử vì tỉ lệ kết hợp là 1:1
Trong dung dịch, HCl phân ly thành ion theo phương trình:
HCl → H+ + Cl-
Qua 20 năm giảng dạy, tôi thường gợi ý học sinh ghi nhớ công thức này bằng cách liên tưởng đến “một chàng hiđro kết đôi với một nàng clo”. Cách này giúp các em nhớ rất lâu và chính xác.
Khi làm bài tập, các em cần phân biệt HCl với dung dịch axit clohiđric. HCl là khí không màu còn dung dịch axit clohiđric là dung dịch của HCl trong nước.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng giữa NaCl và H2SO4 đặc để tạo ra HCl. Phản ứng này giúp các em hiểu rõ hơn về tính chất của axit này.
Cấu tạo và đặc điểm phân tử của axit clohiđric
Axit clohiđric có công thức HCl là một phân tử đơn giản gồm 1 nguyên tử hiđro và 1 nguyên tử clo. Đây là một trong những axit mạnh phổ biến nhất, tương tự như công thức hóa học của axit nitric.
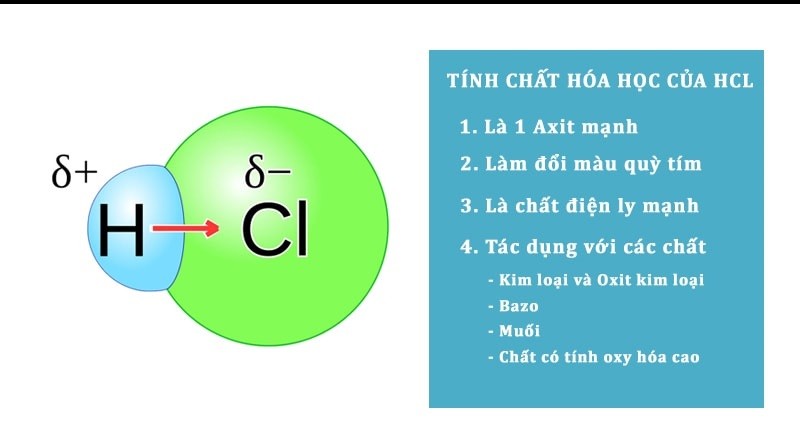
Phân tử HCl có cấu trúc tuyến tính với góc liên kết 180°. Điều đặc biệt là phân tử này có tính phân cực mạnh do sự chênh lệch về độ âm điện giữa H và Cl.
Liên kết hóa học trong phân tử HCl
Liên kết trong phân tử HCl là liên kết cộng hóa trị phân cực. Nguyên tử clo có độ âm điện lớn hơn nguyên tử hiđro.
Khi hình thành liên kết, electron chung có xu hướng lệch về phía nguyên tử clo. Điều này tạo nên một đầu âm (Cl) và một đầu dương (H).
Qua 20 năm giảng dạy, tôi thường ví von liên kết này như một cặp vợ chồng – người vợ (Cl) “nắm giữ” tài chính (electron) nhiều hơn người chồng (H).
Cách viết công thức electron và cấu tạo
Công thức electron của HCl được viết như sau:
H:Cl:
Trong đó dấu “:” thể hiện cặp electron chung giữa H và Cl. Clo còn có 3 cặp electron độc thân.
Công thức cấu tạo đơn giản được viết: H-Cl. Đây là cách viết tương tự như công thức hóa học của axit sunfuric.
Các đặc điểm về khối lượng và độ tan
Khối lượng phân tử của HCl là 36,5 đvC, trong đó H đóng góp 1 đvC và Cl đóng góp 35,5 đvC.
HCl có độ tan trong nước rất cao. Ở điều kiện tiêu chuẩn, 1 lít nước có thể hòa tan được khoảng 500 lít khí HCl.
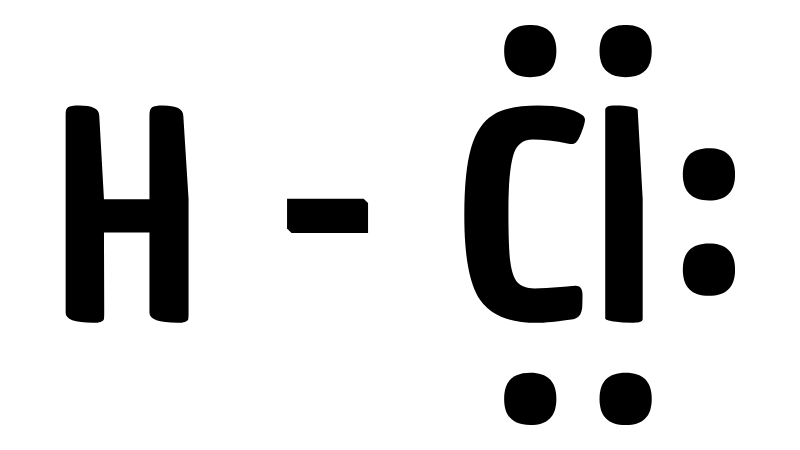
Dung dịch HCl bão hòa trong nước có nồng độ khoảng 37% khối lượng. Đây là dạng axit clohiđric đậm đặc thường dùng trong phòng thí nghiệm.
Tính chất vật lý và hóa học của axit clohiđric
Axit clohiđric (HCl) là một trong những axit mạnh phổ biến nhất trong phòng thí nghiệm và công nghiệp. Tương tự như công thức của axit photphoric, axit clohiđric có những tính chất đặc trưng riêng biệt.
Tính chất vật lý đặc trưng
Ở điều kiện thường, HCl là chất khí không màu, mùi xốc nồng đặc trưng. Khi hòa tan trong nước tạo dung dịch trong suốt. Dung dịch HCl có tỉ trọng 1,19 g/ml ở nồng độ 37%.
Điểm sôi của HCl là -85°C và điểm nóng chảy là -114°C. Khí HCl rất dễ hòa tan trong nước, 1 thể tích nước có thể hòa tan tới 450 thể tích khí ở 20°C.
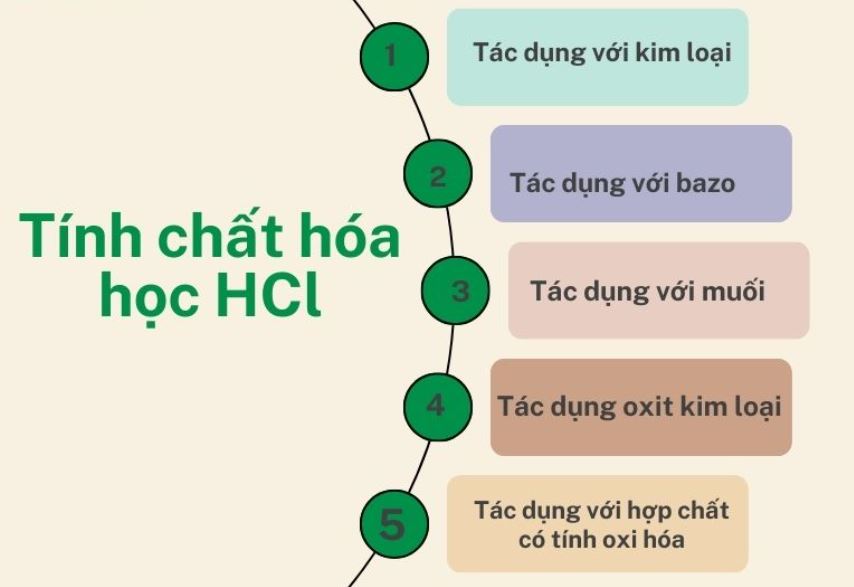
Phản ứng với kim loại và oxit kim loại
HCl có tính chất ăn mòn kim loại mạnh mẽ. Nó phản ứng được với hầu hết kim loại đứng trước hydro trong dãy hoạt động hóa học:
2HCl + Zn → ZnCl2 + H2↑
2HCl + Fe → FeCl2 + H2↑
Với oxit kim loại, HCl tạo ra muối clorua và nước:
2HCl + CuO → CuCl2 + H2O
Phản ứng với bazơ và muối
Tương tự như công thức chung của axit cacboxylic, HCl tham gia phản ứng trung hòa với bazơ tạo muối và nước:
HCl + NaOH → NaCl + H2O
Với muối, HCl phản ứng với muối của axit yếu hơn tạo axit mới và muối mới:
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
Phản ứng này thường được sử dụng để nhận biết muối cacbonat trong phòng thí nghiệm thông qua việc quan sát khí CO2 thoát ra.
Ứng dụng và độc tính của axit clohiđric trong thực tế
Axit clohiđric (HCl) là một trong những axit mạnh được sử dụng phổ biến nhất. Hợp chất này có vai trò quan trọng trong nhiều lĩnh vực khác nhau của đời sống và công nghiệp.
Ứng dụng trong công nghiệp và đời sống
HCl dùng để làm gì trong thực tế? Axit clohiđric được ứng dụng rộng rãi trong sản xuất phân bón, thuốc nhuộm và chất tẩy rửa công nghiệp.
Trong ngành luyện kim, HCl được dùng để tẩy gỉ sắt thép trước khi mạ. Quá trình này giúp loại bỏ các lớp oxit sắt bám trên bề mặt kim loại.
HCl còn là nguyên liệu quan trọng để sản xuất công thức clorua vôi là gì và kali clorua là gì. Các hợp chất này được sử dụng làm chất tẩy trắng và phân bón.
Trong y học, dạ dày người có chứa HCl nồng độ khoảng 0,3% giúp tiêu hóa thức ăn và tiêu diệt vi khuẩn có hại.
Tác hại và cách phòng tránh khi sử dụng
HCl có độc không? Câu trả lời là có. HCl là axit mạnh có tính ăn mòn cao, gây bỏng nặng khi tiếp xúc với da.
Hơi HCl có thể gây kích ứng đường hô hấp, mắt và niêm mạc. Phơi nhiễm lâu dài có thể dẫn đến viêm phổi mãn tính.
Khi làm việc với HCl cần mang đầy đủ thiết bị bảo hộ như kính, găng tay, khẩu trang. Nơi làm việc phải thông thoáng.

Trong trường hợp bị bắn HCl vào da, cần rửa ngay bằng nhiều nước sạch trong 15 phút và đến cơ sở y tế gần nhất.
FAQ: Câu hỏi thường gặp về axit clohiđric
Axit clohiđric là một trong những axit mạnh phổ biến nhất trong phòng thí nghiệm và công nghiệp. Tuy nhiên, việc sử dụng và bảo quản cần tuân thủ nghiêm ngặt các quy tắc an toàn. Dưới đây là một số câu hỏi thường gặp về loại axit này.
Axit clohiđric có nguy hiểm không?
Axit clohiđric có tính ăn mòn mạnh và rất nguy hiểm nếu không được sử dụng đúng cách. Tôi đã từng chứng kiến nhiều trường hợp tai nạn trong phòng thí nghiệm do thiếu hiểu biết về đặc tính của axit này.
Khi tiếp xúc với da, axit có thể gây bỏng nặng và để lại sẹo vĩnh viễn. Hơi axit cũng gây kích ứng đường hô hấp nghiêm trọng. Giống như công thức thuốc tím, axit clohiđric cần được bảo quản cẩn thận.
Cách bảo quản và sử dụng an toàn
Qua kinh nghiệm giảng dạy, tôi luôn nhấn mạnh việc bảo quản axit clohiđric phải được thực hiện trong chai thủy tinh tối màu, đặt nơi thoáng mát. Tương tự như công thức của axit stearic, nhiệt độ bảo quản tối ưu là 15-25°C.
Khi sử dụng cần mang đầy đủ thiết bị bảo hộ như kính, găng tay và áo blouse. Không được để axit tiếp xúc với polivinyl clorua có công thức là vì có thể gây phản ứng nguy hiểm.
Xử lý khi bị bỏng axit clohiđric
Trong trường hợp bị bỏng, cần rửa ngay vùng bị thương dưới vòi nước sạch trong 15-20 phút. Tương tự như công thức phân tử của axit gluconic, vết bỏng do axit cần được trung hòa bằng dung dịch kiềm loãng.
Sau khi sơ cứu ban đầu, nạn nhân cần được đưa đến cơ sở y tế gần nhất để được điều trị chuyên sâu. Tuyệt đối không tự ý bôi các loại thuốc hay dầu lên vết thương.
Kiến thức về công thức hóa học của axit clohiđric là nền tảng quan trọng trong chương trình hóa học phổ thông. Axit HCl có cấu tạo đơn giản nhưng đóng vai trò thiết yếu trong nhiều ngành công nghiệp và đời sống. Việc nắm vững cấu tạo phân tử, tính chất và cách sử dụng an toàn giúp tận dụng tối đa lợi ích của hợp chất này. Các phản ứng hóa học đặc trưng của HCl tạo nên nhiều ứng dụng quan trọng trong thực tiễn.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

