Hiểu sâu công thức của phèn nhôm và ứng dụng trong đời sống
Công thức của phèn nhôm là một kiến thức quan trọng trong chương trình hóa học phổ thông. Phèn nhôm có nhiều loại với cấu trúc phân tử đặc biệt và tính chất đa dạng. Chất này đóng vai trò thiết yếu trong công nghiệp dệt nhuộm, xử lý nước và sản xuất mỹ phẩm.
Công thức của phèn nhôm
Phèn nhôm là một muối kép sulfat của nhôm và kali. Công thức của phèn nhôm là KAl(SO4)2.12H2O.
Trong đó:
- K: Nguyên tử Kali
- Al: Nguyên tử Nhôm
- SO4: Gốc sulfat
- 12H2O: 12 phân tử nước kết tinh
Tôi thường giúp học sinh ghi nhớ phèn nhôm có công thức là KAl(SO4)2.12H2O bằng cách chia thành 3 phần:
- Phần 1: KAl – Kali và Nhôm
- Phần 2: (SO4)2 – Hai gốc sulfat
- Phần 3: 12H2O – Nước kết tinh
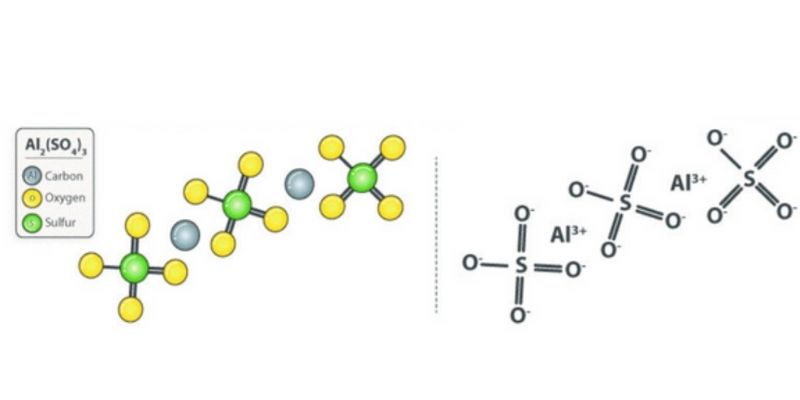 Phèn nhôm có cấu trúc tinh thể hình bát diện. Các ion K+ và Al3+ được bao quanh bởi các phân tử nước và gốc SO42-.
Phèn nhôm có cấu trúc tinh thể hình bát diện. Các ion K+ và Al3+ được bao quanh bởi các phân tử nước và gốc SO42-.
Khi pha loãng phèn nhôm trong nước, các phân tử nước kết tinh sẽ tách ra. Ion Al3+ tạo phức với nước tạo thành [Al(H2O)6]3+.
Đây là một trong những hợp chất quan trọng trong công nghiệp và đời sống. Nó được sử dụng làm chất cầm màu trong nhuộm vải và xử lý nước thải.
Cấu tạo và tính chất hóa học của phèn nhôm
Phèn nhôm là muối kép sulfat của nhôm và kali có công thức hóa học KAl(SO4)2.12H2O. Đây là một trong những hợp chất vô cơ quan trọng được ứng dụng rộng rãi trong công nghiệp và đời sống.
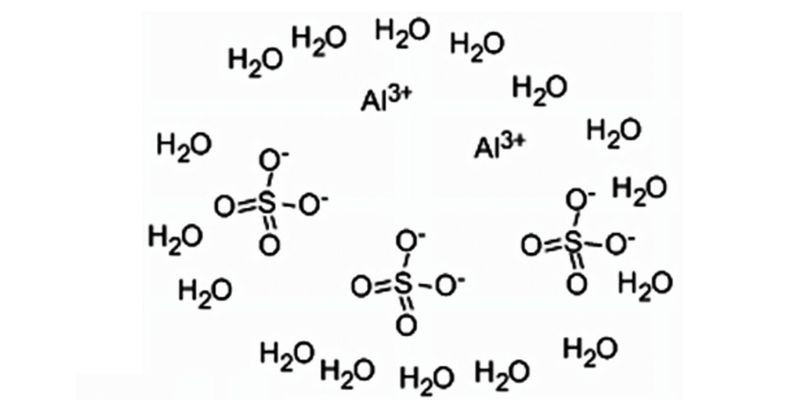 Cấu tạo và tính chất hóa học của phèn nhôm
Cấu tạo và tính chất hóa học của phèn nhômCấu trúc phân tử của phèn nhôm
Phân tử phèn nhôm có cấu trúc tinh thể phức tạp với các thành phần chính:
KAl(SO4)2.12H2O = K+ + Al3+ + 2SO42- + 12H2O
Ion K+ và Al3+ được bao quanh bởi các phối tử H2O tạo thành cấu trúc bát diện. Các ion SO42- liên kết với Al3+ tạo thành khung cấu trúc 3 chiều bền vững. Tương tự như công thức của phenol, cấu trúc này quyết định tính chất đặc trưng của hợp chất.
Các tính chất vật lý đặc trưng
Phèn nhôm tồn tại ở dạng tinh thể không màu, trong suốt với hình bát diện. Chất này tan tốt trong nước ở nhiệt độ thường, độ tan tăng theo nhiệt độ.
Khi đun nóng, phèn nhôm sẽ mất nước kết tinh và chuyển thành dạng bột trắng vô định hình. Điểm nóng chảy của phèn nhôm khoảng 92.5°C.
Phản ứng hóa học của phèn nhôm
Phèn nhôm tham gia nhiều phản ứng hóa học quan trọng:
Phản ứng thủy phân:
KAl(SO4)2 + H2O ⇌ K+ + Al3+ + 2SO42- + H2O
Phản ứng với bazơ:
KAl(SO4)2 + 3NaOH → Al(OH)3↓ + K2SO4 + Na2SO4
Khi đun nóng, phèn nhôm mất nước kết tinh:
KAl(SO4)2.12H2O → KAl(SO4)2 + 12H2O
Các phản ứng này giúp phèn nhôm được ứng dụng rộng rãi trong công nghiệp nhuộm vải, xử lý nước và sản xuất giấy.
Các loại phèn nhôm phổ biến và ứng dụng
Phèn nhôm là nhóm muối kép sulfat của nhôm với các kim loại kiềm hoặc amoni. Chúng có công thức chung là M2SO4.Al2(SO4)3.24H2O với M là kim loại kiềm hoặc NH4+.

Phèn nhôm được ứng dụng rộng rãi trong công nghiệp và đời sống. Chúng thường được dùng làm chất keo tụ trong xử lý nước, thuộc da và nhuộm vải.
Phèn nhôm kali và đặc điểm
Phèn nhôm kali có công thức hóa học K2SO4.Al2(SO4)3.24H2O. Đây là tinh thể không màu, trong suốt với cấu trúc bát diện.
Khi hòa tan trong nước, phèn nhôm kali tạo dung dịch trong suốt có tính axit nhẹ. Công thức của nhôm sunfat là một thành phần quan trọng trong cấu tạo của phèn này.
Trong quá trình giảng dạy, tôi thường cho học sinh làm thí nghiệm kết tinh phèn nhôm kali. Tinh thể phèn tạo thành rất đẹp mắt và giúp học sinh hiểu rõ hơn về cấu trúc tinh thể.
Phèn nhôm amoni và tính chất
Phèn nhôm amoni (NH4)2SO4.Al2(SO4)3.24H2O là dạng phèn phổ biến nhất. Nó tồn tại dưới dạng tinh thể màu trắng, dễ tan trong nước.
Công thức của nhôm oxit có liên quan mật thiết đến quá trình phân hủy nhiệt của phèn nhôm amoni. Khi nung nóng, phèn này sẽ mất nước và tạo thành nhôm oxit.
Phèn nhôm amoni có độ tan tốt hơn phèn kali, giá thành rẻ hơn nên được sử dụng nhiều trong công nghiệp.
Phèn chua và công dụng
Phèn chua là tên gọi dân gian của phèn nhôm. Nó được sử dụng từ xa xưa trong dân gian với nhiều mục đích khác nhau.
Trong y học cổ truyền, phèn chua được dùng để cầm máu, sát trùng vết thương. Ngày nay, nó còn được ứng dụng trong công nghiệp thực phẩm như chất làm trong nước.
Kinh nghiệm của tôi cho thấy phèn chua rất hiệu quả trong việc làm trong nước ao hồ. Chỉ cần một lượng nhỏ có thể keo tụ các chất lơ lửng, giúp nước trong vắt.
Quy trình điều chế và sản xuất phèn nhôm
Phèn nhôm là một hợp chất vô cơ quan trọng trong công nghiệp và đời sống. Công thức của phèn nhôm là KAl(SO4)2.12H2O, được sử dụng rộng rãi trong xử lý nước thải và công nghiệp dệt may.
Phương pháp điều chế trong phòng thí nghiệm
Trong phòng thí nghiệm, phèn nhôm được điều chế bằng phản ứng giữa kali sunfat và nhôm sunfat. Quá trình này tương tự như propen có công thức cấu tạo là với các bước thực hiện có kiểm soát.
Phản ứng tạo thành phèn nhôm sunfat diễn ra theo phương trình:
K2SO4 + Al2(SO4)3 + 24H2O → 2KAl(SO4)2.12H2O
Nhiệt độ phản ứng cần duy trì ở 25-30°C để đảm bảo hiệu suất tối ưu. Sau khi kết tinh, sản phẩm được lọc và sấy khô ở 40°C.
Quy trình sản xuất công nghiệp
Quy trình sản xuất công nghiệp phèn nhôm gồm 3 giai đoạn chính. Đầu tiên, quặng bauxit được xử lý với axit sunfuric đặc để tạo nhôm sunfat.
Tiếp theo, dung dịch nhôm sunfat được trộn với kali sunfat theo tỷ lệ mol 1:1. Phản ứng diễn ra trong thiết bị phản ứng có khuấy trộn liên tục.
Giai đoạn cuối cùng là kết tinh và tinh chế sản phẩm. Dung dịch được làm lạnh để tạo tinh thể phèn nhôm, sau đó ly tâm tách tinh thể.
Các yếu tố ảnh hưởng đến chất lượng sản phẩm
Nhiệt độ phản ứng đóng vai trò quyết định đến độ tinh khiết của sản phẩm. Theo nghiên cứu của Viện Hóa học Công nghiệp, nhiệt độ tối ưu là 28-32°C.
Nồng độ các chất phản ứng cần được kiểm soát chặt chẽ. Tỷ lệ mol giữa K2SO4 và Al2(SO4)3 phải đúng 1:1 để tránh dư thừa nguyên liệu.
Thời gian kết tinh ảnh hưởng trực tiếp đến kích thước tinh thể. Quá trình này thường kéo dài 4-6 giờ để thu được tinh thể đồng đều.
Ứng dụng của phèn nhôm trong đời sống và công nghiệp
Phèn nhôm ứng dụng rộng rãi trong nhiều lĩnh vực khác nhau. Với kinh nghiệm giảng dạy của tôi, đây là một trong những hợp chất quan trọng mà học sinh cần nắm vững. Công thức của phèn nhôm KAl(SO4)2.12H2O có cấu trúc đặc biệt giúp nó phát huy tác dụng trong nhiều ngành công nghiệp.
 Ứng dụng của phèn nhôm trong đời sống và công nghiệp
Ứng dụng của phèn nhôm trong đời sống và công nghiệpTương tự như cách phân loại thép dựa vào thành phần và công dụng, phèn nhôm cũng được ứng dụng đa dạng trong các lĩnh vực khác nhau. Hãy cùng tìm hiểu chi tiết các ứng dụng chính của phèn nhôm.
Xử lý nước và môi trường
Phèn nhôm đóng vai trò quan trọng trong quá trình xử lý nước sinh hoạt và nước thải. Khi hòa tan trong nước, phèn nhôm tạo ra các ion Al3+ có khả năng kết tụ các chất bẩn lơ lửng.
Theo nghiên cứu của Viện Khoa học và Công nghệ Môi trường, phèn nhôm có thể loại bỏ tới 95% các chất rắn lơ lửng trong nước thải. Quá trình này giúp làm trong nước và loại bỏ các tạp chất có hại.
Ngoài ra, phèn nhôm còn được sử dụng để xử lý nước hồ bơi và các nguồn nước công nghiệp. Chất này giúp điều chỉnh độ pH và loại bỏ vi khuẩn gây hại.
Công nghiệp dệt nhuộm
Trong ngành dệt nhuộm, phèn nhôm đóng vai trò là chất cầm màu (mordant). Hợp chất này tạo liên kết giữa sợi vải và phẩm màu, giúp màu sắc bền vững hơn.
Kinh nghiệm thực tế cho thấy, khi ngâm vải trong dung dịch phèn nhôm trước khi nhuộm, màu sắc sẽ đẹp và bền hơn rất nhiều. Điều này đặc biệt quan trọng với các loại vải tự nhiên như cotton và lụa.
Y học và mỹ phẩm
Trong y học, phèn nhôm được sử dụng làm thuốc cầm máu và sát trùng nhẹ. Hợp chất này có tác dụng se mạch máu và diệt khuẩn hiệu quả.
Ngành mỹ phẩm sử dụng phèn nhôm làm thành phần chính trong các sản phẩm khử mùi. Cơ chế hoạt động dựa trên khả năng ức chế vi khuẩn gây mùi và se lỗ chân lông.
Tôi thường chia sẻ với học sinh rằng phèn nhôm trong lăn khử mùi hoạt động giống như “cái nút” đóng tạm thời các tuyến mồ hôi, giúp kiểm soát mùi cơ thể hiệu quả.
FAQ: Câu hỏi thường gặp về phèn nhôm
Phèn nhôm là hợp chất vô cơ được sử dụng phổ biến trong đời sống. Tôi sẽ giải đáp một số thắc mắc thường gặp về loại hóa chất này.
Phèn nhôm có độc không?
Phèn nhôm có độc tính thấp khi sử dụng đúng liều lượng và mục đích. Tuy nhiên cần lưu ý một số điểm:
Nếu nuốt phải lượng lớn có thể gây buồn nôn, đau bụng và tiêu chảy. Tiếp xúc trực tiếp với da trong thời gian dài dễ gây kích ứng.
Khi sử dụng trong thực phẩm, chỉ dùng với nồng độ cho phép (0.01-0.1%). Nồng độ cao hơn có thể ảnh hưởng đến sức khỏe.
Cách bảo quản phèn nhôm
Để bảo quản phèn nhôm hiệu quả, cần đặt trong hộp kín tránh ánh nắng trực tiếp. Nhiệt độ bảo quản thích hợp từ 15-25°C.
Không để gần các chất dễ cháy nổ. Tránh để phèn tiếp xúc với không khí ẩm vì dễ bị vón cục.
Nên đeo găng tay, khẩu trang khi thao tác với phèn nhôm. Rửa tay sạch sau khi sử dụng.
Phân biệt phèn nhôm với các loại phèn khác
Phèn nhôm có dạng tinh thể trong suốt hoặc trắng đục. Mùi đặc trưng nhẹ, vị chát.
Phèn sắt có màu tím nhạt hoặc xanh lục. Phèn crom có màu tím đậm đặc trưng.
Phèn nhôm tan tốt trong nước lạnh, tạo dung dịch trong suốt. Các loại phèn khác thường tạo dung dịch có màu đặc trưng.
Kiến thức về công thức của phèn nhôm giúp người học nắm vững cấu tạo và tính chất của hợp chất quan trọng này. Phèn nhôm tồn tại dưới nhiều dạng khác nhau như phèn nhôm kali, phèn nhôm amoni và phèn chua. Các phương pháp điều chế trong phòng thí nghiệm và sản xuất công nghiệp tạo ra sản phẩm phèn nhôm chất lượng cao. Hợp chất này có nhiều ứng dụng thiết thực trong xử lý nước, dệt nhuộm và mỹ phẩm.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

