Kiến thức về công thức của axit stearic và ứng dụng trong đời sống
Công thức của axit stearic là một kiến thức quan trọng trong hóa học hữu cơ. Chất này có vai trò thiết yếu trong công nghiệp sản xuất và đời sống. Các tính chất đặc trưng cùng ứng dụng đa dạng của axit stearic đều xuất phát từ cấu trúc phân tử độc đáo của nó.
Công thức của axit stearic
Axit stearic là một axit béo bão hòa có vai trò quan trọng trong công nghiệp hóa chất. Công thức của axit stearic là C17H35COOH hay CH3(CH2)16COOH.
Phân tích cấu tạo phân tử axit stearic:
- C17H35: Mạch cacbon no có 17 nguyên tử cacbon
- COOH: Nhóm cacboxyl đặc trưng của axit cacboxylic
Trong phòng thí nghiệm, tôi thường giúp học sinh ghi nhớ công thức này bằng cách chia thành 2 phần:
- Phần đuôi hidrocacbon: CH3(CH2)16-
- Phần đầu axit: -COOH
Axit stearic có dạng tinh thể màu trắng ở nhiệt độ phòng. Điểm nóng chảy của nó là 69,6°C và điểm sôi là 361°C.
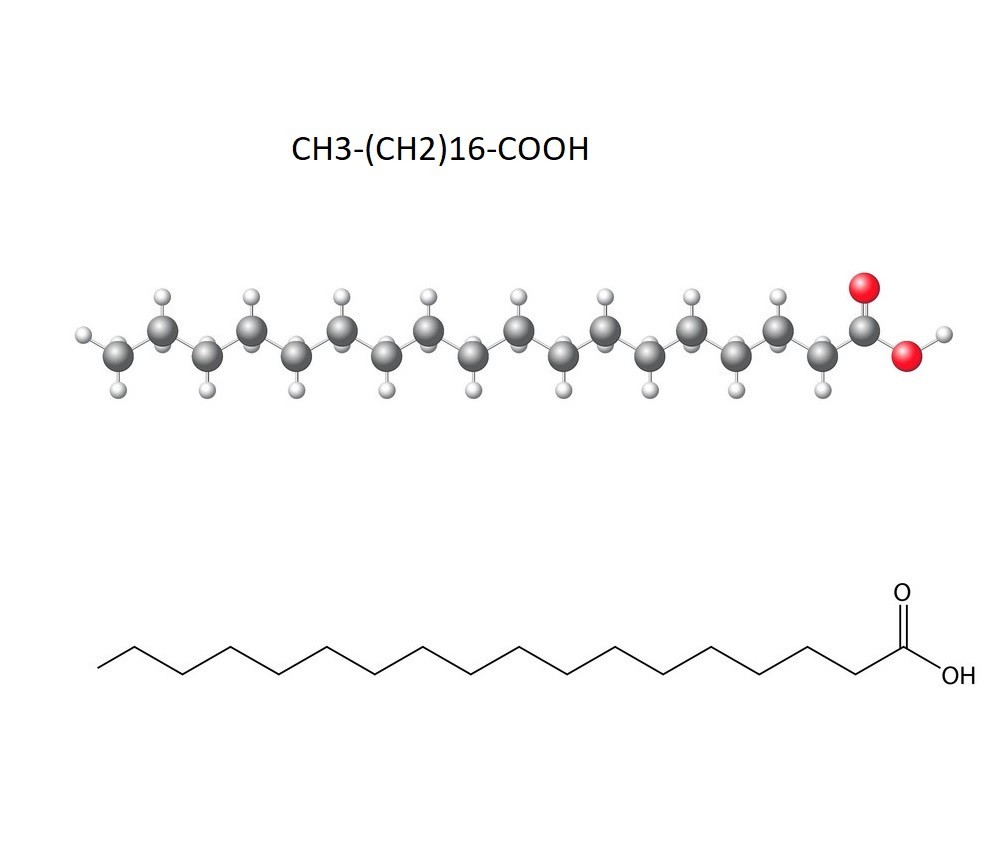
Một mẹo nhỏ để nhớ số nguyên tử cacbon: Axit stearic có 18 nguyên tử C (17 + 1 từ nhóm COOH). Con số 18 trùng với số electron hóa trị của nguyên tố Ar (Argon).
Cấu tạo phân tử và đặc điểm của axit stearic
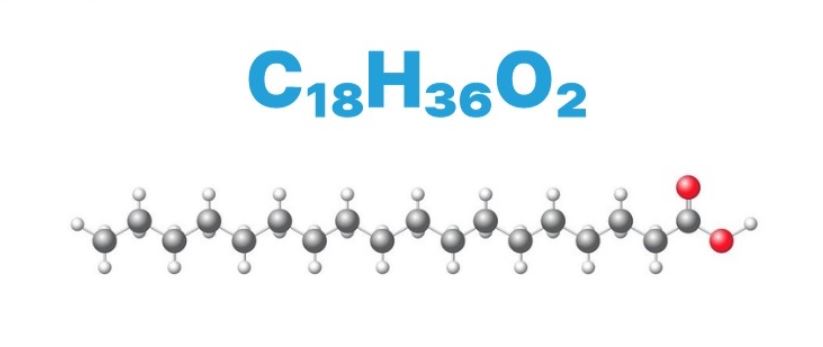
Axit stearic là một axit béo no có công thức phân tử C17H35COOH. Đây là một trong những axit béo phổ biến nhất trong tự nhiên, thường được tìm thấy trong mỡ động vật và dầu thực vật.
Cấu trúc phân tử của axit stearic có dạng mạch thẳng với 18 nguyên tử carbon. Tương tự như công thức cấu tạo của stiren, phân tử này có cấu trúc đặc trưng riêng biệt.
Cấu trúc phân tử của axit stearic
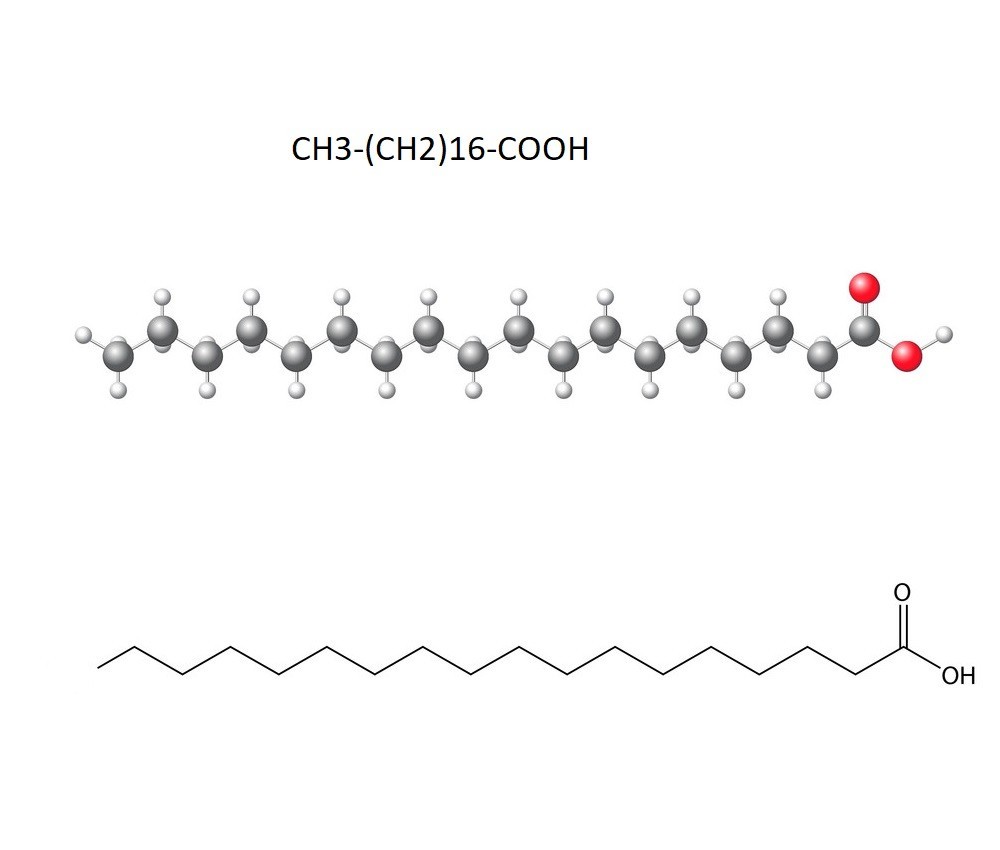
Cấu tạo axit stearic bao gồm một chuỗi hydrocarbon dài với 17 nhóm -CH2- và một nhóm -CH3 ở đầu mạch. Chuỗi carbon này có dạng zigzag do góc liên kết C-C là 109.5°.
Phân tử có tính đối xứng cao và sắp xếp theo dạng xoắn. Điều này giúp các phân tử có thể xếp chặt với nhau, tạo nên điểm nóng chảy cao khoảng 69.6°C.
Các nhóm chức trong phân tử
Phân tử axit stearic chứa một nhóm carboxyl (-COOH) ở đầu mạch. Nhóm này quyết định tính axit của phân tử, tương tự như công thức axit glutamic.
Ngoài ra còn có các nhóm alkyl (-CH2-) tạo nên chuỗi carbon không phân nhánh. Các nhóm này làm tăng tính kỵ nước của phân tử.
Liên kết hóa học trong axit stearic
Liên kết chính trong phân tử là liên kết đơn C-C và C-H. Các liên kết này có độ bền cao và góc liên kết ổn định.
Nhóm carboxyl tạo được liên kết hydrogen với các phân tử khác. Đặc điểm này giúp axit stearic có khả năng tạo dimer trong điều kiện thường.
Các tương tác van der Waals giữa các chuỗi hydrocarbon cũng đóng vai trò quan trọng. Chúng giúp các phân tử sắp xếp song song và tạo cấu trúc tinh thể.
Tính chất vật lý và hóa học của axit stearic
Axit stearic là một axit béo no có công thức phân tử C17H35COOH. Tính chất axit stearic thể hiện rõ qua các đặc điểm vật lý và phản ứng hóa học đặc trưng.
Tính chất vật lý đặc trưng
Axit stearic tồn tại ở dạng tinh thể màu trắng ở nhiệt độ phòng. Điểm nóng chảy của nó là 69,6°C và điểm sôi khoảng 361°C.
Chất này không tan trong nước nhưng tan tốt trong các dung môi hữu cơ như ether, cloroform. Đây là một tính chất quan trọng giúp phân biệt với công thức của axit citric.
Trong quá trình giảng dạy, tôi thường cho học sinh thí nghiệm đơn giản bằng cách thử độ tan của axit stearic trong nước và cồn để minh họa tính chất này.
Phản ứng hóa học cơ bản
Axit stearic tham gia các phản ứng điển hình của axit cacboxylic. Nó phản ứng với bazơ tạo muối và nước:
C17H35COOH + NaOH → C17H35COONa + H2O
Phản ứng este hóa với rượu cũng diễn ra dễ dàng:
C17H35COOH + CH3OH → C17H35COOCH3 + H2O
So với công thức của axit panmitic, axit stearic có độ hoạt động hóa học tương đương.
So sánh với các axit béo khác
Axit stearic có cấu trúc mạch cacbon dài hơn so với nhiều axit béo khác. Điều này làm cho nó có điểm nóng chảy cao hơn.
So với công thức của axit oleic, axit stearic bền vững hơn do không có liên kết đôi trong phân tử.
Trong công nghiệp, công thức của axit stearic là C17H35COOH được ứng dụng rộng rãi trong sản xuất xà phòng, nến và mỹ phẩm nhờ tính chất vật lý đặc biệt của nó.
Ứng dụng và vai trò của axit stearic trong đời sống
Axit stearic là một axit béo bão hòa có nhiều ứng dụng quan trọng trong công nghiệp và đời sống. Tương tự như axit fomic có công thức là, axit stearic cũng có cấu trúc đơn giản nhưng công dụng đa dạng.

Ứng dụng trong công nghiệp
Axit stearic dùng để làm gì trong công nghiệp? Chất này đóng vai trò quan trọng trong sản xuất nến, xà phòng và chất tẩy rửa. Khi kết hợp với các bazơ, axit stearic tạo thành muối stearat có khả năng tạo bọt và làm sạch tốt.
Trong ngành công nghiệp nhựa, axit stearic được sử dụng làm chất ổn định và bôi trơn. Tương tự như công thức benzyl axetat, nó giúp cải thiện tính chất của sản phẩm cuối cùng.
Vai trò trong thực phẩm
Axit stearic là thành phần tự nhiên có trong nhiều loại thực phẩm như thịt, cá và các loại dầu thực vật. Nó được FDA công nhận là chất phụ gia thực phẩm an toàn với mã số E570.
Trong sản xuất bánh kẹo, axit stearic trong thực phẩm giúp ổn định cấu trúc và tạo độ bóng cho sản phẩm. Đặc biệt trong chocolate, nó góp phần tạo nên kết cấu mịn màng đặc trưng.
Sử dụng trong mỹ phẩm
Trong ngành công nghiệp mỹ phẩm, axit stearic là thành phần quan trọng của kem dưỡng da và son môi. Nó có khả năng làm mềm và dưỡng ẩm cho da hiệu quả.
Các sản phẩm chăm sóc tóc cũng thường chứa axit stearic để cải thiện độ mượt và bóng của tóc. Theo nghiên cứu của Viện Khoa học và Công nghệ Việt Nam, axit stearic còn có tác dụng bảo vệ da khỏi tác hại của tia UV.
FAQ: Câu hỏi thường gặp về axit stearic
Axit stearic là một axit béo bão hòa phổ biến trong tự nhiên. Tôi sẽ giải đáp những thắc mắc thường gặp về hợp chất này.
Độ an toàn khi sử dụng axit stearic
Axit stearic có độc không là câu hỏi được nhiều người quan tâm. Theo kinh nghiệm giảng dạy của tôi, đây là một axit béo an toàn.
Axit stearic được FDA công nhận là chất phụ gia thực phẩm an toàn. Nó có mặt tự nhiên trong nhiều loại thực phẩm như thịt và các loại hạt.
Tuy nhiên, cần tuân thủ liều lượng khuyến cáo khi sử dụng. Giống như axit linoleic, axit stearic chỉ gây kích ứng nhẹ nếu tiếp xúc trực tiếp với da.
Cách bảo quản và lưu trữ
Axit stearic cần được bảo quản trong điều kiện khô ráo, thoáng mát. Nhiệt độ lý tưởng là 15-25°C.
Tránh để gần nguồn nhiệt và ánh nắng trực tiếp. Khác với công thức của isoamyl axetat, axit stearic ít bay hơi ở nhiệt độ thường.
Đóng kín nắp sau khi sử dụng và để xa tầm tay trẻ em. Thời hạn sử dụng thông thường là 2 năm kể từ ngày sản xuất.
Tác động đến sức khỏe
Axit stearic có vai trò quan trọng trong cơ thể. Nó tham gia cấu tạo màng tế bào và cung cấp năng lượng.
Nghiên cứu cho thấy axit stearic không làm tăng cholesterol xấu như nhiều axit béo bão hòa khác. Tương tự như axit gluconic là gì, nó được cơ thể chuyển hóa hiệu quả.
Tuy nhiên, người có tiền sử bệnh tim mạch nên tham khảo ý kiến bác sĩ trước khi bổ sung axit stearic. Liều lượng khuyến cáo không quá 20g/ngày với người trưởng thành khỏe mạnh.
Kiến thức về công thức của axit stearic giúp chúng ta hiểu rõ bản chất và ứng dụng của hợp chất quan trọng này. Axit stearic có cấu trúc phân tử đặc biệt với mạch cacbon dài và nhóm chức axit đặc trưng. Các tính chất vật lý và hóa học của nó quyết định vai trò thiết yếu trong công nghiệp sản xuất và chế biến thực phẩm. Việc nắm vững đặc điểm cấu tạo và tính chất của axit stearic là nền tảng để ứng dụng hiệu quả trong thực tiễn.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

