Nắm rõ công thức của axit photphoric và ứng dụng trong đời sống
Công thức của axit photphoric H3PO4 đóng vai trò quan trọng trong công nghiệp và đời sống. Chất này tồn tại dưới dạng tinh thể không màu. Nó được sử dụng rộng rãi trong sản xuất phân bón và thực phẩm. Axit photphoric có tính chất đặc trưng của một axit vô cơ đa bazơ.
Công thức của axit photphoric
Axit photphoric có công thức của axit photphoric là H3PO4. Đây là một axit vô cơ phổ biến trong công nghiệp và đời sống.
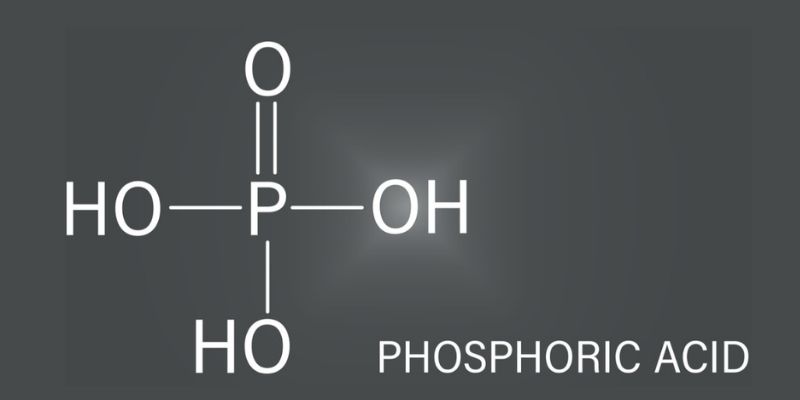
Trong phân tử H3PO4, nguyên tử photpho (P) liên kết với 4 nguyên tử oxi (O) tạo thành ion PO43-. Ba nguyên tử hydro (H) liên kết với các nguyên tử oxi để tạo nên cấu trúc hoàn chỉnh.
Công thức của axit photphoric là H3PO4 có thể phân ly theo 3 nấc:
H3PO4 ⇌ H+ + H2PO4-
H2PO4- ⇌ H+ + HPO42-
HPO42- ⇌ H+ + PO43-
Trong quá trình giảng dạy, tôi thường ví von H3PO4 như một chiếc ghế 3 chân. Mỗi nguyên tử H giống như một cái chân ghế, có thể tháo rời từng cái một. Cách ghi nhớ này giúp học sinh dễ hiểu về khả năng phân ly của axit.
Khi pha loãng H3PO4 với nước, dung dịch thu được có vị chua đặc trưng. Đó là lý do axit photphoric được sử dụng làm phụ gia trong nước giải khát để tạo vị chua dễ chịu.
Cấu tạo phân tử và tính chất của axit photphoric H3PO4
Axit photphoric là một axit vô cơ quan trọng, có công thức phân tử H3PO4. Nó được ứng dụng rộng rãi trong công nghiệp thực phẩm và sản xuất phân bón.
Cấu tạo phân tử axit photphoric
Axit photphoric cấu tạo gồm một nguyên tử photpho (P) liên kết với 4 nguyên tử oxi (O) tạo thành ion PO43-. Ba nguyên tử hidro (H) liên kết với 3 nguyên tử oxi còn lại.
Phân tử có dạng tứ diện với nguyên tử P ở tâm và 4 nguyên tử O ở 4 đỉnh. Liên kết P-O có tính chất cộng hóa trị phân cực.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc ô 4 cạnh, với P là tay cầm và 4 nguyên tử O như 4 thanh gỗ chống đỡ.
Tính chất vật lý của axit photphoric
H3PO4 tinh khiết là chất rắn không màu, dạng tinh thể ở nhiệt độ phòng. Nó tan rất tốt trong nước và có vị chua đặc trưng.
Điểm nóng chảy của axit photphoric là 42,35°C. Khi đun nóng trên 213°C, nó mất nước tạo thành axit pyrophotphoric (H4P2O7).
Tương tự như công thức HCl là gì, dung dịch H3PO4 có tính axit mạnh và ăn mòn kim loại.
Tính chất hóa học của axit photphoric
H3PO4 là axit đa bazơ, có thể phân ly theo 3 nấc tạo ra 3 loại muối khác nhau. Khả năng phân ly giảm dần qua mỗi nấc.
Axit photphoric tác dụng với kim loại hoạt động hóa học mạnh tạo muối photphat và giải phóng khí H2. Phản ứng này tương tự như công thức hóa học của axit sunfuric.
H3PO4 là gì? Đây là một axit vô cơ quan trọng được sử dụng làm chất điều vị trong công nghiệp thực phẩm và sản xuất phân bón photphat.
Trong phòng thí nghiệm, tôi thường nhắc học sinh cẩn thận khi sử dụng H3PO4 đậm đặc vì nó có tính ăn mòn mạnh và có thể gây bỏng da.
Phương pháp điều chế và sản xuất axit photphoric trong công nghiệp
Axit photphoric là một hợp chất quan trọng trong công nghiệp hóa chất. Nó được sản xuất bằng nhiều phương pháp khác nhau tùy theo mục đích sử dụng và quy mô.
Phương pháp điều chế trong phòng thí nghiệm
Trong phòng thí nghiệm, công thức axit photphoric được điều chế bằng phản ứng giữa P2O5 và nước. Phương pháp này cho sản phẩm tinh khiết nhưng chi phí cao.
Phản ứng xảy ra theo phương trình:
P2O5 + 3H2O → 2H3PO4
Một phương pháp khác là cho photpho trắng tác dụng với HNO3 đặc, nóng:
P + 5HNO3 → H3PO4 + 5NO2 + H2O
Quy trình sản xuất công nghiệp
Trong công nghiệp, axit photphoric được sản xuất chủ yếu bằng phương pháp ướt từ quặng photphorit. Đây là phương pháp kinh tế và hiệu quả nhất.
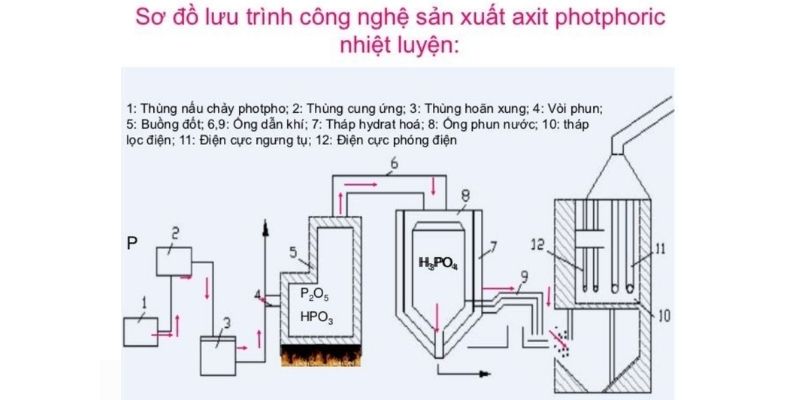 Phương pháp điều chế và sản xuất axit photphoric trong công nghiệp
Phương pháp điều chế và sản xuất axit photphoric trong công nghiệpQuặng photphorit được nghiền nhỏ và cho phản ứng với H2SO4:
Ca3(PO4)2 + 3H2SO4 → 2H3PO4 + 3CaSO4
Sản phẩm thu được qua phương pháp này có thể dùng để sản xuất supephotphat kép có công thức là và các loại phân bón khác.
Ngoài ra còn có phương pháp nhiệt điều chế từ photpho nguyên tố. Phương pháp này cho sản phẩm tinh khiết hơn nhưng chi phí cao và năng suất thấp hơn phương pháp ướt.
Ứng dụng quan trọng của axit photphoric trong đời sống và công nghiệp
Axit photphoric là một hợp chất hóa học có vai trò quan trọng trong nhiều lĩnh vực. Tôi thường ví von nó như một “người hùng thầm lặng” trong ngành công nghiệp hóa chất.
Với hơn 20 năm giảng dạy, tôi nhận thấy nhiều học sinh thường bỡ ngỡ khi tìm hiểu về các ứng dụng của axit này. Hãy cùng tôi khám phá các ứng dụng chính của nó.
 Ứng dụng quan trọng của axit photphoric trong đời sống và công nghiệp
Ứng dụng quan trọng của axit photphoric trong đời sống và công nghiệpỨng dụng trong công nghiệp thực phẩm
Axit photphoric trong thực phẩm đóng vai trò là chất điều chỉnh độ pH và tạo hương vị. Tương tự như axit glutamic công thức cấu tạo, nó giúp tăng cường vị umami.
Trong nước giải khát, đặc biệt là axit photphoric trong nước ngọt, nó tạo vị chua đặc trưng. Nồng độ sử dụng thường từ 0.02-0.05%.
Kinh nghiệm giảng dạy cho thấy học sinh dễ nhớ ứng dụng này khi tôi lấy ví dụ về Coca-Cola – thương hiệu nước ngọt nổi tiếng sử dụng E338 (mã số của axit photphoric).
Ứng dụng trong sản xuất phân bón
Ứng dụng axit photphoric quan trọng nhất là sản xuất phân bón. Nó tạo ra các muối phosphat làm phân bón.
Phản ứng chính trong quá trình này là:
H3PO4 + Ca(OH)2 → Ca3(PO4)2 + H2O
Tôi thường giải thích cho học sinh bằng cách so sánh với công thức của axit panmitic – một axit hữu cơ không tham gia vào quá trình này.
Các ứng dụng khác
Trong nha khoa, axit photphoric được dùng làm chất tẩy rửa men răng. Nồng độ sử dụng khoảng 30-40%.
Trong công nghiệp kim loại, nó được dùng làm chất chống gỉ sét. Phản ứng với oxit sắt tạo lớp phủ bảo vệ.
Trong xử lý nước, axit photphoric giúp điều chỉnh pH và loại bỏ cặn canxi, magie. Đây là ứng dụng tôi thường nhấn mạnh với sinh viên ngành môi trường.
FAQ: Câu hỏi thường gặp về axit photphoric
Axit photphoric là một trong những hợp chất quan trọng được ứng dụng rộng rãi trong công nghiệp và đời sống. Tuy nhiên, nhiều người vẫn còn thắc mắc về tính chất và cách sử dụng an toàn của nó.
Axit photphoric có độc không?
Axit photphoric ở nồng độ thấp không gây độc cho cơ thể. Nó được FDA chứng nhận an toàn và cho phép sử dụng trong thực phẩm như công thức axit oleic và công thức axit fomic.
Tuy nhiên, ở nồng độ cao trên 85%, axit này có thể gây bỏng da và tổn thương niêm mạc nghiêm trọng. Các sản phẩm như công thức phenyl axetat thường được pha loãng để đảm bảo an toàn.
Cách bảo quản và sử dụng axit photphoric an toàn
Bảo quản axit photphoric cần tuân thủ nguyên tắc trong phòng thí nghiệm như cấu tạo isoamyl axetat. Đặt trong chai thủy tinh tối màu, nơi khô ráo, thoáng mát.
Khi sử dụng cần đeo găng tay, kính bảo hộ và áo blouse. Tránh để tiếp xúc trực tiếp với da và mắt. Pha loãng axit bằng cách cho từ từ axit vào nước, không làm ngược lại.
Sự khác biệt giữa axit photphoric và axit photphorơ
Axit photphoric (H3PO4) có độ mạnh và độ bền cao hơn axit photphorơ (H3PO3). Trong khi este benzyl axetat có công thức là tương tự, axit photphoric có 3 nguyên tử H có thể phân ly.
Axit photphoric được sử dụng phổ biến trong công nghiệp thực phẩm và sản xuất phân bón. Còn axit photphorơ chủ yếu là sản phẩm trung gian trong phòng thí nghiệm.
Kiến thức về công thức của axit photphoric đóng vai trò quan trọng trong chương trình hóa học phổ thông và đại học. Với cấu tạo phân tử H3PO4 đặc trưng, axit photphoric thể hiện tính chất của một axit đa chức và có nhiều ứng dụng thiết thực trong công nghiệp thực phẩm, sản xuất phân bón và các lĩnh vực khác. Việc nắm vững cấu tạo, tính chất và phương pháp điều chế giúp người học vận dụng tốt trong học tập và thực tiễn.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

