Ghi nhớ công thức của axit fomic và tính chất quan trọng nhất
Công thức của axit fomic thể hiện cấu trúc phân tử đơn giản nhất trong họ axit cacboxylic. Chất này có vai trò quan trọng trong tự nhiên và công nghiệp hóa chất. Các phản ứng đặc trưng của axit fomic giúp tạo ra nhiều sản phẩm hữu ích trong đời sống.
Công thức của axit fomic – Axit hữu cơ đơn giản nhất
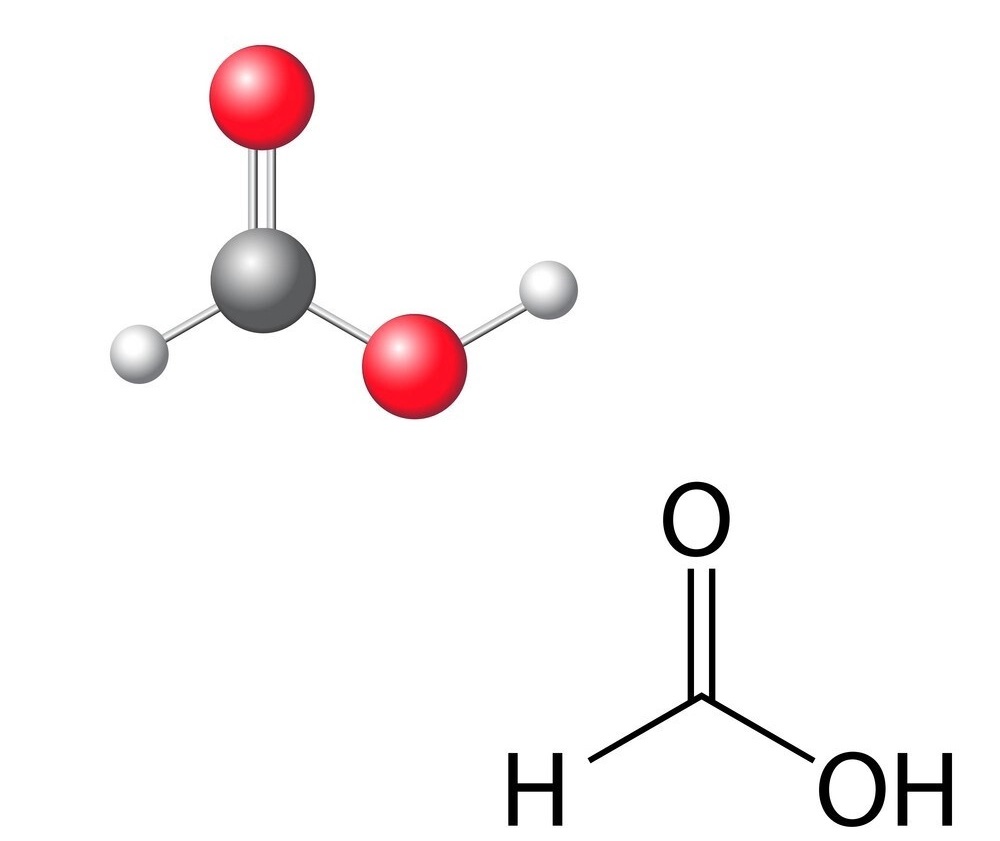
Axit fomic có công thức của axit fomic là HCOOH hoặc CH2O2. Đây là axit hữu cơ đơn giản nhất trong tự nhiên.
Công thức cấu tạo của axit fomic:
H-C(=O)-OH
Trong đó:
- H là nguyên tử hydro
- C là nguyên tử cacbon
- O là nguyên tử oxi
- Nhóm -OH là nhóm hydroxyl đặc trưng của axit
Axit fomic có cấu trúc phân tử khá đơn giản. Một đầu phân tử là nhóm carboxyl (-COOH), đầu còn lại là nguyên tử hydro.
Khi giảng dạy, tôi thường ví von axit fomic như một “em bé” trong họ axit hữu cơ. Nó có cấu trúc đơn giản nhất nhưng lại rất quan trọng trong tự nhiên.
Một ví dụ thực tế về axit fomic là trong nọc kiến. Khi kiến cắn, chúng tiết ra axit fomic gây cảm giác đau rát trên da. Đây là cách tự vệ tự nhiên của loài kiến.
Trong phòng thí nghiệm, axit fomic thường được sử dụng làm chất xúc tác trong nhiều phản ứng hóa học. Nó cũng là nguyên liệu quan trọng trong công nghiệp dệt nhuộm và thuộc da.
Cấu tạo phân tử và đặc điểm của axit fomic
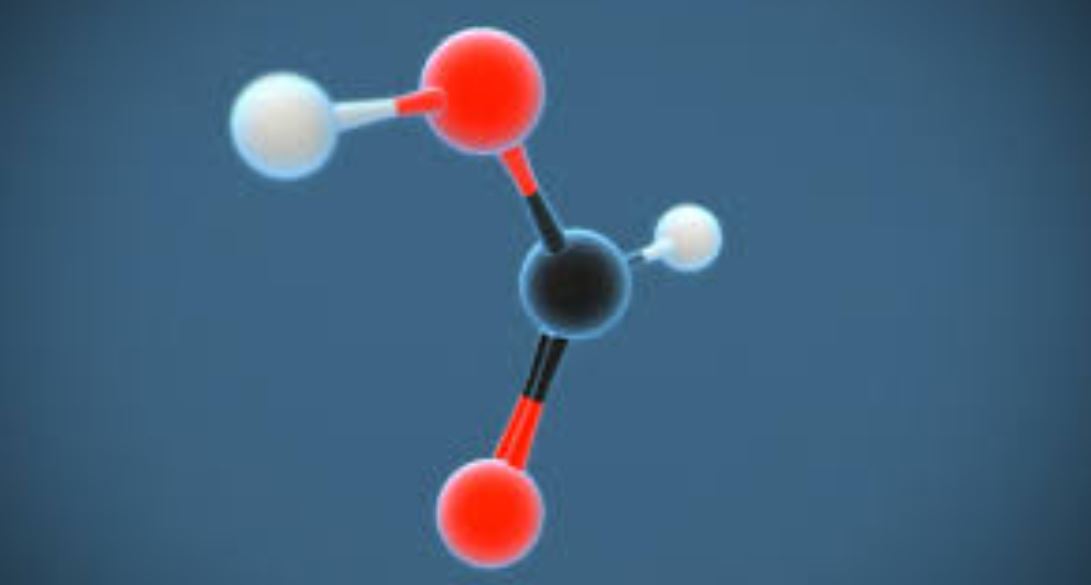
Axit fomic có công thức axit fomic là HCOOH – một phân tử nhỏ gọn nhưng đóng vai trò quan trọng trong tự nhiên. Phân tử này có cấu trúc đặc biệt với nhóm cacboxyl (-COOH) gắn trực tiếp với nguyên tử hydro.
Công thức phân tử và công thức cấu tạo
Công thức phân tử của axit fomic là CH2O2, thường được viết dưới dạng HCOOH. Trong đó:
- H: 2 nguyên tử hydro
- C: 1 nguyên tử cacbon
- O: 2 nguyên tử oxi
Cấu trúc này có mối liên hệ chặt chẽ với công thức của anđehit fomic khi thay thế nhóm -OH bằng -H.
Liên kết hóa học trong phân tử
Phân tử axit fomic có hai loại liên kết chính. Liên kết σ (sigma) hình thành giữa các nguyên tử C-H, C-O và O-H. Liên kết π (pi) xuất hiện giữa C=O tạo nên nhóm cacboxyl đặc trưng.
Trong quá trình giảng dạy, tôi thường ví von liên kết π như một cây cầu nối hai bờ, giúp học sinh dễ hình dung và nhớ lâu hơn.
Đặc điểm cấu trúc không gian
Axit fomic cấu tạo có dạng phẳng trong không gian. Nguyên tử cacbon sp2 nằm ở tâm với ba liên kết nằm trong cùng mặt phẳng, tạo góc xấp xỉ 120°.
Nhóm -OH có khả năng xoay quanh liên kết đơn C-O, tạo điều kiện thuận lợi cho việc hình thành liên kết hydro giữa các phân tử. Đây là lý do giải thích nhiệt độ sôi cao của axit fomic.
Tính chất vật lý và hóa học của axit fomic
Axit fomic là axit hữu cơ đơn giản nhất trong dãy axit cacboxylic. Chất này có nhiều tính chất đặc biệt và ứng dụng quan trọng trong công nghiệp cũng như đời sống.
Các tính chất vật lý đặc trưng
Axit fomic tính chất vật lý nổi bật là chất lỏng không màu, có mùi xốc đặc trưng. Nhiệt độ nóng chảy là 8,4°C và nhiệt độ sôi là 100,8°C.
Axit fomic tan tốt trong nước và nhiều dung môi hữu cơ phổ biến. Khối lượng riêng của nó là 1,22 g/mL ở 20°C.
Trong phòng thí nghiệm, tôi thường nhắc học sinh phải đeo găng tay và kính bảo hộ khi tiếp xúc với axit fomic vì nó có tính ăn mòn mạnh.
Phản ứng hóa học cơ bản
Axit fomic phản ứng đa dạng do có nhóm -COOH và nhóm -H. Các phản ứng chính gồm phản ứng với bazơ, oxi hóa-khử và este hóa.
Phản ứng với bazơ
Axit fomic phản ứng với bazơ tạo muối format và nước. Phản ứng này xảy ra nhanh và mạnh.
Ví dụ phản ứng với NaOH:
HCOOH + NaOH → HCOONa + H2O
Phản ứng oxi hóa – khử
Axit fomic có thể bị oxi hóa bởi các chất oxi hóa mạnh như KMnO4 hoặc K2Cr2O7 tạo thành CO2 và H2O.
Trong giảng dạy, tôi thường cho học sinh làm thí nghiệm với dung dịch KMnO4 để quan sát sự mất màu tím của permanganat.

Phản ứng este hóa
Axit fomic tham gia phản ứng este hóa với rượu tạo thành este. Công thức của metyl fomat là một ví dụ điển hình.
Phản ứng este hóa cần xúc tác axit và đun nóng:
HCOOH + CH3OH ⇌ HCOOCH3 + H2O
Ứng dụng và sản xuất axit fomic trong công nghiệp
Axit fomic công nghiệp đóng vai trò quan trọng trong nhiều ngành sản xuất hiện đại. Tôi sẽ phân tích chi tiết các ứng dụng và quy trình sản xuất của hợp chất này.
Các ứng dụng chính trong công nghiệp
Axit fomic ứng dụng rộng rãi trong ngành dệt may làm chất xử lý vải sợi. Acid này giúp tăng độ bền màu và khả năng chống nhăn cho vải.
Trong ngành thuộc da, axit fomic được dùng làm chất điều chỉnh pH. Nó giúp da mềm mại và có độ bền cao hơn sau quá trình thuộc.
Ngành nông nghiệp sử dụng Fomon công thức làm chất bảo quản thức ăn gia súc. Axit fomic có khả năng ức chế vi khuẩn gây hại hiệu quả.
Quy trình sản xuất công nghiệp
Phương pháp phổ biến nhất là phản ứng giữa CO và NaOH ở nhiệt độ cao. Quá trình này tạo ra muối natri format.
Sau đó, muối natri format được xử lý với axit sulfuric đậm đặc. Phản ứng này giải phóng axit fomic tinh khiết.
Một phương pháp khác là thủy phân methyl format. Quá trình này diễn ra dưới áp suất cao và có xúc tác axit.
An toàn khi sử dụng
Axit fomic có tính ăn mòn mạnh nên cần trang bị bảo hộ đầy đủ khi tiếp xúc. Găng tay, kính bảo hộ và quần áo chống acid là bắt buộc.
Khu vực làm việc phải được thông thoáng tốt. Hơi acid có thể gây kích ứng đường hô hấp nghiêm trọng.

Cần có sẵn bình rửa mắt và vòi sen khẩn cấp. Trong trường hợp bị bắn acid, rửa ngay bằng nước sạch trong 15 phút.
FAQ: Câu hỏi thường gặp về axit fomic
Axit fomic với công thức của axit fomic là HCOOH có nhiều ứng dụng trong công nghiệp và đời sống. Tuy nhiên, việc sử dụng an toàn luôn là mối quan tâm hàng đầu. So với công thức axit citric và công thức của axit oleic, axit fomic là gì và những điều cần lưu ý khi sử dụng sẽ được giải đáp qua các câu hỏi phổ biến sau.
Axit fomic có độc không?
Axit fomic có độc tính cao với cơ thể con người khi tiếp xúc trực tiếp. Hơi axit fomic gây kích ứng đường hô hấp và niêm mạc mắt nghiêm trọng.
Theo nghiên cứu của Viện Khoa học An toàn Nghề nghiệp Việt Nam, nồng độ axit fomic trên 5% có thể gây bỏng da và tổn thương mắt không hồi phục. Tiếp xúc kéo dài với nồng độ thấp cũng làm tăng nguy cơ mắc các bệnh về đường hô hấp.
Cách bảo quản axit fomic an toàn
Axit fomic cần được bảo quản trong bình kín bằng thủy tinh hoặc nhựa chuyên dụng, đặt nơi thoáng mát dưới 30°C. Tránh ánh nắng trực tiếp và nguồn nhiệt.
Khi vận chuyển phải có thiết bị bảo hộ đầy đủ như găng tay, kính bảo vệ mắt và khẩu trang. Không để gần các chất oxy hóa mạnh, kim loại và bazơ.
Nơi bảo quản cần có hệ thống thông gió tốt và thiết bị chữa cháy phù hợp. Kiểm tra định kỳ tình trạng bình chứa để phát hiện rò rỉ.
So sánh axit fomic với các axit cacboxylic khác
Axit fomic là axit cacboxylic đơn giản nhất nhưng có tính axit mạnh hơn nhiều axit cacboxylic khác. Điều này do nhóm -COOH liên kết trực tiếp với nguyên tử H.
Khả năng phân ly H+ của axit fomic cao hơn axit axetic gấp 10 lần. Điều này giúp nó phản ứng mạnh với kim loại và bazơ.
Về độ tan trong nước, axit fomic tan vô hạn và tạo dung dịch đồng nhất. Các axit béo mạch dài như axit stearic lại không tan trong nước do chuỗi hidrocacbon kỵ nước.
Kiến thức về công thức của axit fomic giúp học sinh nắm vững cấu trúc phân tử đơn giản nhất trong họ axit cacboxylic. Axit fomic có vai trò quan trọng trong công nghiệp hóa chất và đời sống với các tính chất đặc trưng. Việc nắm chắc cấu tạo phân tử và các phản ứng cơ bản tạo nền tảng để học tập các hợp chất hữu cơ phức tạp hơn. Các biện pháp an toàn khi sử dụng cần được tuân thủ nghiêm ngặt.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

