Nắm kỹ công thức của anilin và các tính chất hóa học cơ bản
Công thức của anilin là kiến thức quan trọng trong chương trình hóa học hữu cơ. Anilin có cấu trúc đặc biệt với nhóm amino gắn trực tiếp vào vòng benzen. Chất này tham gia nhiều phản ứng hóa học đặc trưng và được ứng dụng rộng rãi trong công nghiệp. Các tính chất vật lý và hóa học của anilin giúp phân biệt nó với các hợp chất amin thơm khác.
Công thức của anilin
Anilin là một hợp chất hữu cơ có vai trò quan trọng trong công nghiệp hóa chất. Công thức của anilin được biểu diễn là C6H5NH2 hoặc C6H7N.
Trong đó:
- C6H5: Gốc phenyl
- N<h2>Nhóm amino</h2>- Khối lượng phân tử: 93 g/mol
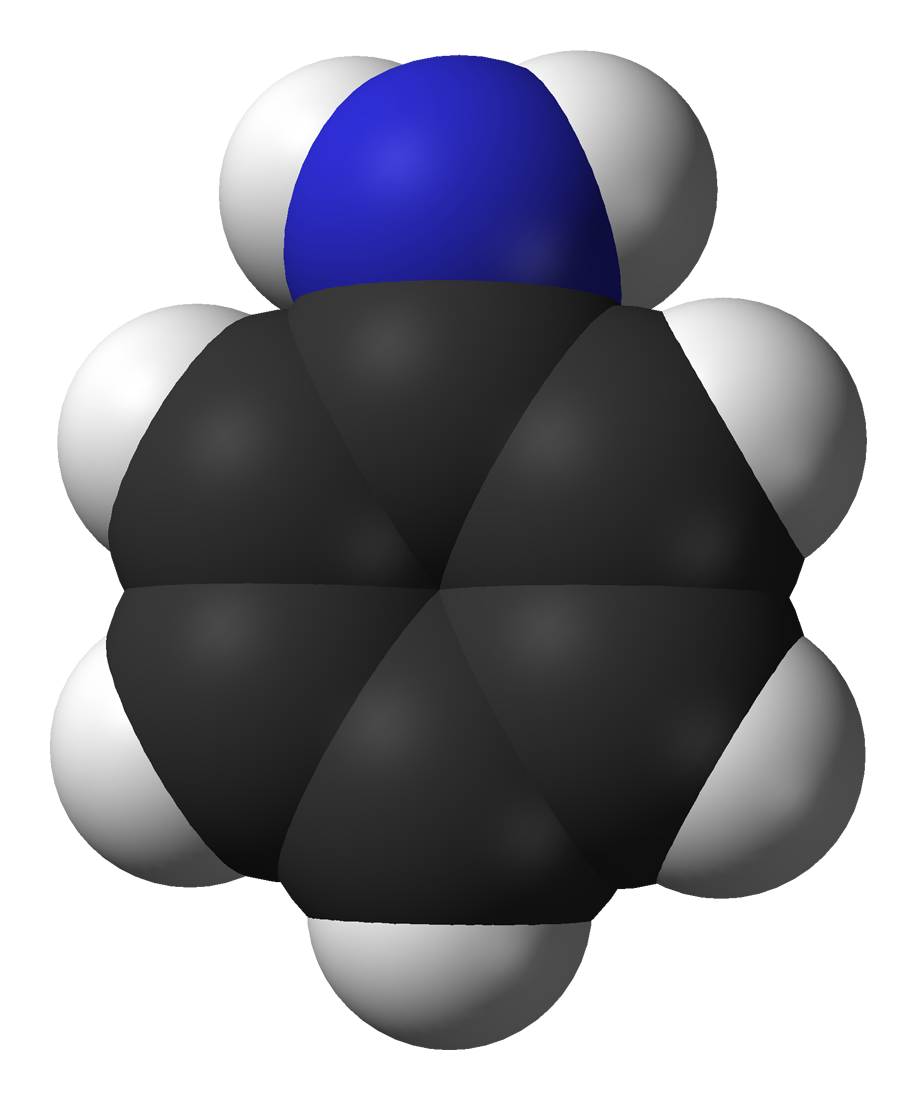
Cấu trúc phân tử anilin gồm một vòng benzen liên kết với nhóm amino (-NH2). Nhóm -NH2 có khả năng tham gia phản ứng thế electrophil vào vòng benzen.
Khi giảng dạy, tôi thường ví von anilin như một “ngôi nhà” với vòng benzen là phần khung chính và nhóm amino là “cánh cửa” để các phản ứng hóa học diễn ra.
Một điểm đặc biệt của anilin là khả năng phân cực của liên kết N-H làm cho nó có tính bazơ yếu. Điều này giúp học sinh dễ nhớ và hiểu được các phản ứng của anilin với axit.
Trong phòng thí nghiệm, anilin thường được điều chế bằng phản ứng khử nitrobenzen:
C6H5NO2 + 6[H] → C6H5NH2 + 2H2O
Cấu tạo và đặc điểm phân tử anilin
Anilin là một hợp chất hữu cơ quan trọng trong công nghiệp hóa chất. Phân tử anilin có cấu tạo đặc biệt với nhóm amino gắn trực tiếp vào vòng benzen. Để hiểu rõ về cấu tạo anilin, chúng ta cần tìm hiểu từng thành phần cấu trúc của nó.
Công thức phân tử của anilin
Công thức phân tử của anilin là C6H5NH2. Đây là một dẫn xuất của công thức phân tử của amin với vòng benzen. Phân tử gồm 6 nguyên tử carbon tạo thành vòng benzen, 5 nguyên tử hydro gắn với vòng và một nhóm amino -NH2.
Trong quá trình giảng dạy, tôi thường ví von anilin như một “chiếc bánh” vòng benzen có “cái nơ” NH2 gắn vào. Cách hình dung này giúp học sinh dễ nhớ cấu trúc phân tử hơn.
Công thức cấu tạo của anilin
Công thức cấu tạo của anilin thể hiện rõ sự liên kết giữa các nguyên tử trong phân tử. Nhóm -NH2 liên kết trực tiếp với một nguyên tử carbon của vòng benzen tại vị trí para.
Vòng benzen trong anilin có 6 liên kết xen kẽ đơn và đôi, tạo thành hệ liên hợp π. Điều này làm cho anilin có tính thơm đặc trưng và độ bền cao.
Cấu trúc không gian và liên kết trong phân tử
Phân tử anilin có cấu trúc không gian phẳng ở vòng benzen. Nhóm -NH2 hơi nhô lên khỏi mặt phẳng vòng benzen một góc khoảng 38°.
Sự có mặt của nhóm -NH2 tạo ra hiệu ứng cộng hưởng với vòng benzen. Cặp electron tự do trên nguyên tử N tham gia vào hệ liên hợp π của vòng benzen.
Kinh nghiệm giảng dạy cho thấy việc vẽ mô hình 3D sẽ giúp học sinh hình dung rõ hơn về góc nghiêng của nhóm -NH2 so với mặt phẳng vòng benzen.
Tính chất vật lý và hóa học của anilin
Anilin là một hợp chất hữu cơ quan trọng trong công nghiệp hóa chất. Tính chất anilin bao gồm các đặc điểm vật lý và phản ứng hóa học đặc trưng.
Các tính chất vật lý đặc trưng
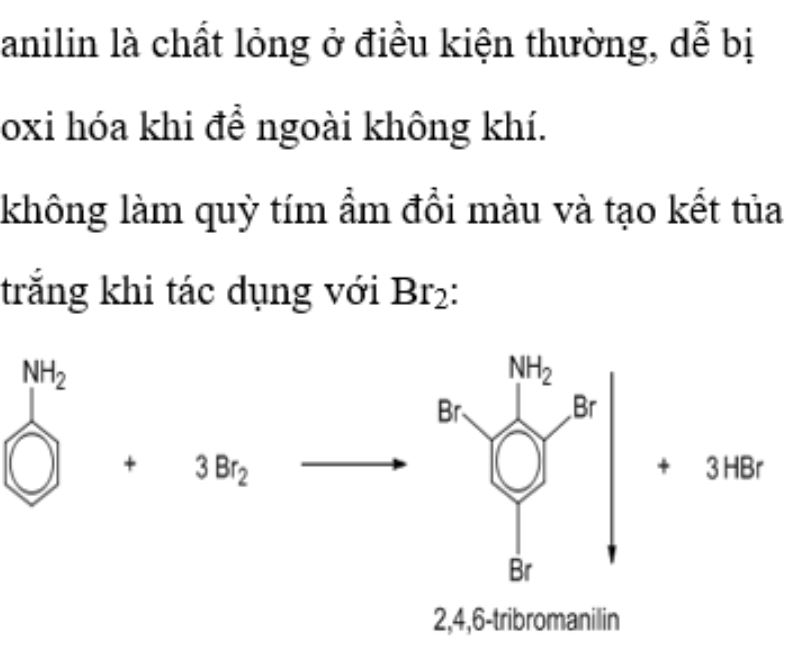
Ở nhiệt độ thường, anilin là chất lỏng không màu, có mùi đặc trưng khó chịu. Khi để ngoài không khí, anilin chuyển sang màu nâu do bị oxi hóa.
Anilin có nhiệt độ sôi 184°C và nhiệt độ nóng chảy -6°C. Đây là chất ít tan trong nước nhưng tan tốt trong các dung môi hữu cơ như cồn, benzen.
Trong phòng thí nghiệm, tôi thường nhắc học sinh phải cẩn thận khi làm việc với anilin vì nó có độc tính cao, có thể gây kích ứng da và niêm mạc.
Phản ứng của anilin với các chất khác
Phản ứng của anilin rất đa dạng do cấu trúc đặc biệt của nó. Công thức chung của ankin benzen cho thấy sự liên hợp giữa nhóm -NH2 và vòng benzen.
Phản ứng với axit
Anilin phản ứng với axit tạo muối diazonium. Phản ứng này xảy ra do nhóm -NH2 có tính bazơ yếu.
Khi cho anilin tác dụng với dung dịch HCl ta được muối phenylamoni clorua:
C6H5NH2 + HCl → C6H5NH3+Cl-
Phản ứng thế ở vòng benzen
Nhóm -NH2 làm tăng mật độ electron ở vòng benzen. Điều này khiến phản ứng thế định hướng vào vị trí ortho và para.
Trong giảng dạy, tôi thường ví von nhóm -NH2 như “nam châm” hút electron, giúp học sinh dễ nhớ quy luật định hướng thế.
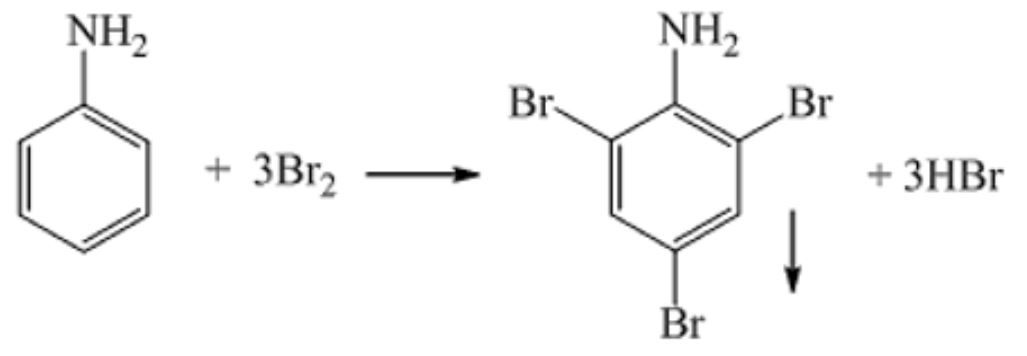
Phản ứng với nước brom
Khi cho anilin tác dụng với nước brom sẽ tạo kết tủa trắng 2,4,6-tribromanilin. Công thức của anilin C6H5NH2 cho thấy 3 vị trí brom thế vào vòng benzen.
Phản ứng này thường được dùng để nhận biết anilin trong phòng thí nghiệm:
C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
Phương pháp điều chế và ứng dụng của anilin
Anilin là một hợp chất hữu cơ quan trọng trong công nghiệp hóa chất. Quá trình điều chế anilin có thể thực hiện qua nhiều phương pháp khác nhau, từ phòng thí nghiệm đến quy mô công nghiệp.
Các phương pháp điều chế anilin trong phòng thí nghiệm
Phương pháp phổ biến nhất để điều chế anilin trong phòng thí nghiệm là khử nitrobenzen. Phản ứng này sử dụng thiếc và axit clohidric làm tác nhân khử.
Công thức phản ứng điều chế:
C6H5NO2 + 6[H] → C6H5NH2 + 2H2O
Một phương pháp khác là sử dụng sắt và axit clohidric. Phương pháp này an toàn hơn và cho hiệu suất cao, thường được tôi áp dụng khi hướng dẫn sinh viên thực hành.
Quy trình sản xuất anilin trong công nghiệp
Trong công nghiệp, anilin được sản xuất chủ yếu bằng phương pháp khử xúc tác nitrobenzen. Quá trình này sử dụng khí hydro và xúc tác là công thức chung của ankan.
Nhiệt độ phản ứng duy trì ở 250-300°C và áp suất 20-30 atm. Hiệu suất phản ứng có thể đạt tới 95% trong điều kiện tối ưu.
Ứng dụng của anilin trong đời sống và công nghiệp
Ứng dụng anilin rất đa dạng trong nhiều lĩnh vực công nghiệp. Nó là nguyên liệu chính để sản xuất thuốc nhuộm, chất dẻo và cao su tổng hợp.
Trong ngành dược phẩm, anilin được dùng làm nguyên liệu tổng hợp các loại thuốc kháng sinh và thuốc giảm đau. Tôi thường lấy ví dụ về paracetamol – một dẫn xuất của anilin để minh họa cho sinh viên.

Anilin còn được sử dụng trong sản xuất chất chống oxi hóa, phụ gia cao su và các hợp chất bảo vệ thực vật. Đây là một trong những hóa chất công nghiệp quan trọng nhất hiện nay.
FAQ: Câu hỏi thường gặp về anilin
Để hiểu rõ hơn về anilin trong hóa học, tôi sẽ giải đáp một số thắc mắc phổ biến mà học sinh thường gặp phải khi học về hợp chất này.
Anilin có độc không?
Anilin là một chất độc nguy hiểm, có thể gây tổn thương gan và thận. Khi tiếp xúc trực tiếp với da, anilin dễ dàng thẩm thấu và gây ngộ độc cấp tính.
Theo nghiên cứu của Viện Khoa học và Công nghệ Việt Nam, nồng độ anilin trên 100ppm trong không khí có thể gây tử vong sau vài giờ tiếp xúc.
Làm thế nào để nhận biết anilin?
Anilin có thể nhận biết qua phản ứng với nước brom tạo kết tủa trắng. Phương pháp này tương tự như cách nhận biết andehit công thức trong phòng thí nghiệm.
Một cách khác là cho anilin tác dụng với dung dịch HCl loãng. Khi đó sẽ tạo thành muối anilin hydrochlorid tan trong nước.
Anilin tan trong nước không?
Anilin là gì và khả năng tan của nó trong nước là câu hỏi thường gặp. Anilin ít tan trong nước lạnh nhưng tan tốt trong cồn và ete.
Tương tự như cấu tạo trimetylamin, anilin có thể tạo liên kết hydro với nước. Tuy nhiên do phân tử anilin có phần không phân cực lớn nên khả năng tan trong nước kém hơn.
Kiến thức về công thức của anilin giúp người học nắm vững cấu trúc phân tử, tính chất và phản ứng của hợp chất hữu cơ quan trọng này. Anilin có vai trò thiết yếu trong công nghiệp hóa chất, đặc biệt là sản xuất thuốc nhuộm và polyme. Các phương pháp điều chế anilin trong phòng thí nghiệm và công nghiệp đều dựa trên nguyên liệu nitrobenzen. Việc nắm chắc các phản ứng đặc trưng của anilin tạo nền tảng cho học tập và nghiên cứu hóa học hữu cơ.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

