Công thức chung của axit cacboxylic và các tính chất hóa học cơ bản
Công thức chung của axit cacboxylic là nền tảng để hiểu về nhóm hợp chất hữu cơ quan trọng này. Các axit cacboxylic tồn tại phổ biến trong tự nhiên và đóng vai trò thiết yếu trong nhiều ngành công nghiệp. Chúng có cấu tạo đặc trưng với nhóm chức -COOH và tham gia vào nhiều phản ứng hóa học đa dạng.
Công thức chung của axit cacboxylic
Axit cacboxylic là một trong những hợp chất hữu cơ quan trọng. Công thức chung của axit cacboxylic có dạng R-COOH, trong đó:
R là gốc hiđrocacbon (alkyl hoặc aryl)
COOH là nhóm cacboxyl đặc trưng
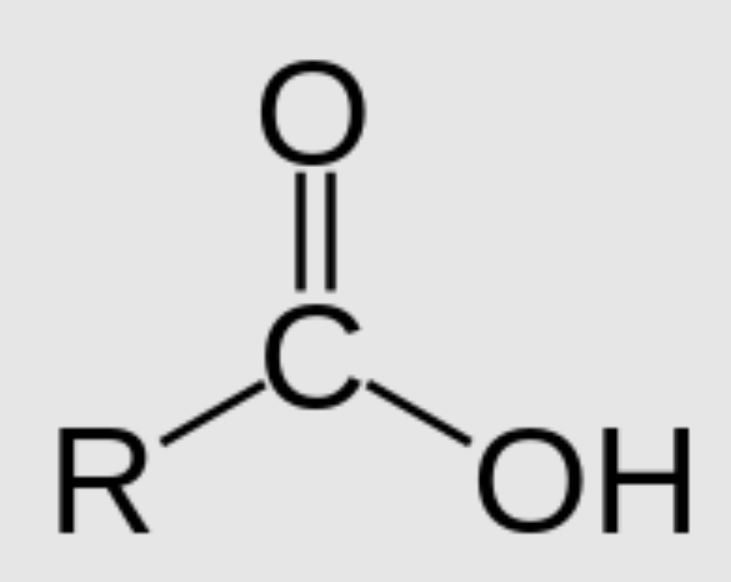
Tôi thường giảng cho học sinh rằng nhóm COOH giống như “chữ ký” của axit cacboxylic. Nó gồm hai phần:
- C=O: nhóm cacbonyl
- OH: nhóm hiđroxyl
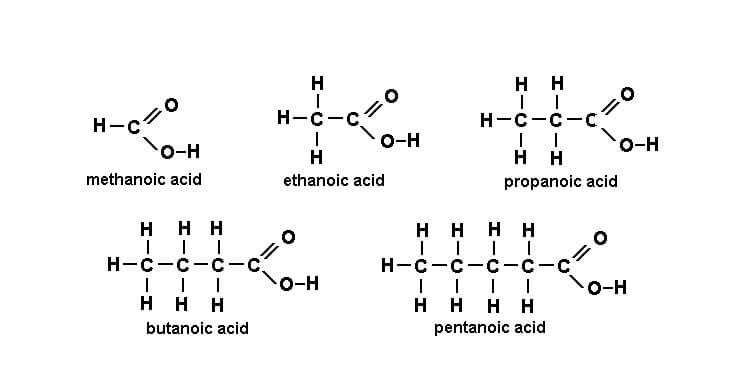
Ví dụ một số axit cacboxylic thường gặp:
CH3COOH: Axit axetic (dấm ăn)
HCOOH: Axit fomic (nọc kiến)
C2H5COOH: Axit propionic
Khi viết công thức, các em cần chú ý:
- Nhóm COOH luôn ở cuối chuỗi cacbon
- Gốc R có thể no hoặc không no
- Một phân tử có thể chứa nhiều nhóm COOH
Trong 20 năm giảng dạy, tôi nhận thấy học sinh dễ nhớ công thức này khi liên hệ với thực tế. Ví dụ dấm ăn là axit axetic, nọc kiến là axit fomic. Điều này giúp các em tiếp thu tốt hơn.
Cấu tạo và đặc điểm của nhóm chức axit cacboxylic
Axit cacboxylic là hợp chất hữu cơ chứa nhóm chức -COOH. Nhóm này quyết định tính chất hóa học đặc trưng của axit cacboxylic.
Tương tự như ankan có công thức chung là, axit cacboxylic cũng có công thức tổng quát là R-COOH. Trong đó R là gốc hiđrocacbon.
Cấu trúc phân tử của axit cacboxylic
Cấu tạo axit cacboxylic gồm hai phần chính: nhóm chức -COOH và phần gốc hiđrocacbon R. Nhóm -COOH có cấu tạo phẳng.
Trong nhóm -COOH, nguyên tử cacbon sp2 liên kết với nguyên tử oxi bằng liên kết đôi C=O. Đồng thời nó cũng liên kết với nhóm -OH bằng liên kết đơn.
Góc liên kết giữa các nguyên tử trong nhóm -COOH xấp xỉ 120°. Điều này phù hợp với lai hóa sp2 của nguyên tử cacbon.
Đặc điểm liên kết trong nhóm chức -COOH
Liên kết C=O có tính phân cực mạnh do độ âm điện của oxi lớn hơn cacbon. Điện tử trong liên kết bị lệch về phía oxi.
Nhóm -OH trong -COOH có khả năng tạo liên kết hiđro với nước và các phân tử khác. Đây là nguyên nhân khiến axit cacboxylic tan tốt trong nước.
Sự phân cực của liên kết C=O làm tăng độ phân ly của liên kết O-H. Vì thế axit cacboxylic có tính axit mạnh hơn phenol và ancol.
Phân loại axit cacboxylic theo cấu tạo
Phân loại axit cacboxylic dựa vào số nhóm -COOH và cấu tạo của gốc R. Theo số nhóm -COOH, có axit đơn chức và đa chức.
Theo cấu tạo gốc R, axit cacboxylic được chia thành axit no, axit không no và axit thơm. Axit no có gốc R là ankan, axit không no có liên kết đôi hoặc ba.
Axit thơm có gốc R chứa vòng benzen. Đặc biệt, một số axit cacboxylic có thêm nhóm chức khác như -OH, -NH2 tạo thành axit đa chức.
Quy tắc gọi tên và danh pháp axit cacboxylic
Axit cacboxylic có công thức tổng quát của axit cacboxylic là R-COOH, trong đó R là gốc hidrocacbon. Nhóm -COOH được gọi là nhóm cacboxyl và quyết định tính chất axit của hợp chất.
Tôi thường giải thích với học sinh rằng việc gọi tên axit cacboxylic giống như đặt biệt danh cho một người bạn – có tên chính thức và tên thường gọi. Chúng ta có 2 cách gọi tên chính:
Danh pháp thay thế
Danh pháp axit cacboxylic theo quy tắc thay thế được xây dựng bằng cách thêm “axit” vào trước tên gốc hidrocacbon tương ứng và thêm “oic” vào cuối.
Ví dụ: CH3COOH là axit etanoic (từ gốc etan)
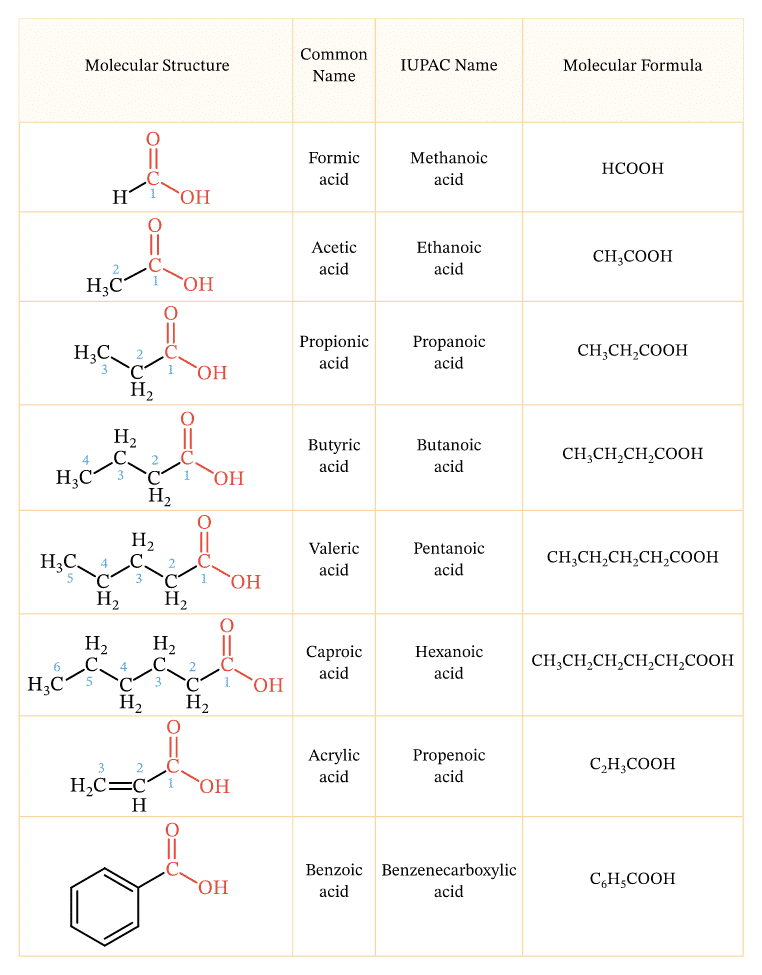
CH3CH2COOH là axit propanoic (từ gốc propan)
Khi dạy học sinh, tôi thường nhấn mạnh quy tắc: Đếm số cacbon trong chuỗi chính rồi thêm “oic” vào sau tên gốc hidrocacbon tương ứng.
Danh pháp thông thường
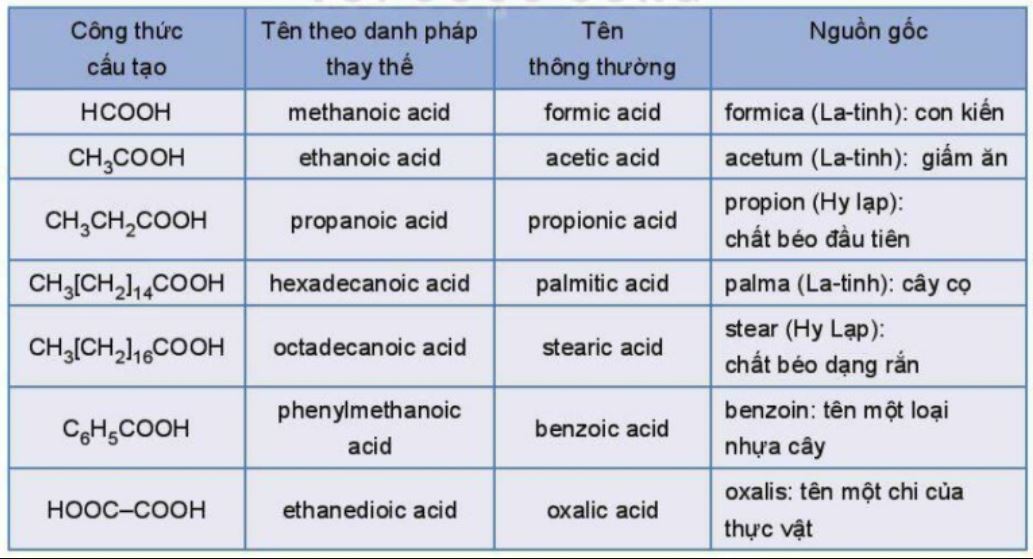
Cách gọi tên thông thường dựa trên nguồn gốc tự nhiên hoặc tên gọi quen thuộc của axit.
Một số axit thường gặp:
- HCOOH: Axit fomic (từ kiến)
- CH3COOH: Axit axetic (từ giấm)
- HOOC-COOH: Axit oxalic (từ rau dấm)
Tôi thường khuyến khích học sinh ghi nhớ cả hai cách gọi tên, vì trong thực tế và các bài thi đều sử dụng cả hai hệ thống danh pháp này.
Tính chất hóa học đặc trưng của axit cacboxylic
Axit cacboxylic là hợp chất hữu cơ chứa nhóm chức -COOH. Tính chất axit cacboxylic thể hiện qua các phản ứng đặc trưng với bazơ, kim loại và phản ứng este hóa.
Tính axit của nhóm -COOH
Nhóm -COOH có khả năng phân ly trong nước tạo ion H+ và ion cacboxylat RCOO-. Phản ứng này có thể viết:
RCOOH + H2O ⇌ RCOO- + H3O+
Trong đó R là gốc hidrocacbon. Tính axit của axit cacboxylic mạnh hơn phenol và yếu hơn công thức của axit photphoric là.
Phản ứng với bazơ
Axit cacboxylic tác dụng với bazơ tạo muối và nước. Phản ứng này được viết:
RCOOH + MOH → RCOOM + H2O
Trong đó M là kim loại kiềm. Đây là phản ứng trung hòa điển hình giữa axit và bazơ.
Phản ứng với kim loại
Axit cacboxylic phản ứng được với kim loại đứng trước hidro trong dãy hoạt động hóa học:
2RCOOH + Zn → (RCOO)2Zn + H2↑
Phản ứng này sinh ra muối và khí hidro. Tốc độ phản ứng phụ thuộc vào hoạt động của kim loại.
Phản ứng este hóa
Axit cacboxylic tác dụng với rượu tạo thành este và nước:
RCOOH + R’OH ⇌ RCOOR’ + H2O
Phản ứng este hóa là phản ứng thuận nghịch, cần xúc tác axit và đun nóng. Sản phẩm este thường có mùi thơm đặc trưng.
Ứng dụng và vai trò của axit cacboxylic
Axit cacboxylic là một trong những hợp chất hữu cơ quan trọng với nhiều ứng dụng đa dạng. Ứng dụng axit cacboxylic trải rộng từ công nghiệp đến đời sống và đóng vai trò thiết yếu trong cơ thể sống.
Ứng dụng trong công nghiệp
Trong ngành công nghiệp hóa chất, axit cacboxylic là nguyên liệu không thể thiếu. Axit axetic được sử dụng để sản xuất các loại sợi tổng hợp như axetat xenlulozơ và các chất dẻo.
Axit benzoic và muối của nó như tính chất natri cacbonat được dùng làm chất bảo quản thực phẩm an toàn. Các axit béo chuỗi dài tham gia vào quá trình sản xuất xà phòng và chất tẩy rửa.
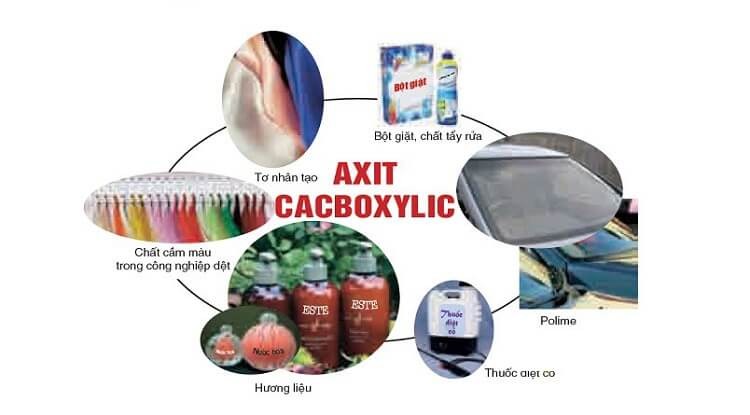
Ứng dụng trong đời sống
Axit axetic ở dạng giấm được sử dụng phổ biến trong nấu ăn và bảo quản thực phẩm. Nó tạo vị chua đặc trưng cho nhiều món ăn truyền thống.
Axit citric tự nhiên có trong cam quýt tạo hương vị tươi mát cho đồ uống. Các axit béo như omega-3, omega-6 là thành phần dinh dưỡng quan trọng trong thực phẩm chức năng.
Vai trò sinh học
Axit cacboxylic đóng vai trò then chốt trong quá trình trao đổi chất của cơ thể. Axit lactic được tạo ra trong quá trình vận động của cơ bắp.
Axit amin là đơn vị cấu tạo protein, có chứa nhóm cacboxyl đặc trưng. Các axit béo thiết yếu tham gia cấu tạo màng tế bào và điều hòa các chức năng sinh học quan trọng.
Các vitamin như axit folic, axit ascorbic (vitamin C) là những chất điều hòa quá trình chuyển hóa không thể thiếu trong cơ thể sống.
Bài tập và phương pháp giải về axit cacboxylic
Axit cacboxylic là một chủ đề quan trọng trong chương trình hóa học. Tôi sẽ hướng dẫn các em giải quyết các dạng bài tập axit cacboxylic thường gặp một cách dễ hiểu nhất.
Bài tập về viết công thức
Khi viết công thức axit cacboxylic, các em cần nhớ nhóm chức -COOH luôn ở cuối chuỗi cacbon. Tương tự như ankađien có công thức tổng quát là, axit cacboxylic cũng có quy tắc đặt tên riêng.
Ví dụ: Viết công thức axit béo có 18 cacbon
- Bước 1: Đếm số cacbon: C18
- Bước 2: Thêm nhóm -COOH vào cuối
- Bước 3: Hoàn thiện công thức: CH3-(CH2)16-COOH
Bài tập về tính chất
Tính chất quan trọng nhất của axit cacboxylic là tính axit yếu. Khi làm bài tập, các em cần chú ý:
Phản ứng với bazơ:
RCOOH + NaOH → RCOONa + H2O
Phản ứng với kim loại:
2RCOOH + Mg → (RCOO)2Mg + H2
Kinh nghiệm của tôi là vẽ sơ đồ phản ứng sẽ giúp nhớ tốt hơn việc học thuộc lòng.
Bài tập về phản ứng

Phản ứng của axit cacboxylic thường gặp trong bài tập gồm:
Phản ứng este hóa:
RCOOH + R’OH ⇌ RCOOR’ + H2O
Phản ứng thế halogen:
RCOOH + PCl5 → RCOCl + POCl3 + HCl
Để giải nhanh, các em nên chia phản ứng thành 3 nhóm:
- Phản ứng do tính axit
- Phản ứng tạo este
- Phản ứng thế
FAQ: Câu hỏi thường gặp về axit cacboxylic
Axit cacboxylic là hợp chất hữu cơ chứa nhóm chức -COOH. Đây là một trong những nhóm chức quan trọng nhất trong hóa học hữu cơ.
Tôi thường giải thích cho học sinh bằng cách ví von nhóm -COOH như một “chìa khóa” mở ra nhiều phản ứng hóa học thú vị.
Cấu tạo của nhóm -COOH gồm:
- Nhóm cacbonyl >C=O
- Nhóm hydroxyl -OH
- Hai nhóm này liên kết với nhau tạo thành -COOH
Một số đặc điểm cơ bản của axit cacboxylic:
- Là chất lỏng hoặc rắn ở điều kiện thường
- Có mùi đặc trưng, thường khó chịu
- Tan tốt trong nước nhờ liên kết hydro
- Có tính axit yếu hơn axit vô cơ
Trong quá trình giảng dạy, tôi thường lấy ví dụ về axit axetic (CH3COOH) – thành phần chính của giấm ăn để học sinh dễ hình dung và nhớ về axit cacboxylic.
Kinh nghiệm cho thấy việc kết nối kiến thức với thực tế giúp học sinh tiếp thu tốt hơn rất nhiều.
Kiến thức về công thức chung của axit cacboxylic giúp học sinh nắm vững cấu trúc phân tử và tính chất đặc trưng của nhóm hợp chất quan trọng này. Các phản ứng hóa học cơ bản như phản ứng với bazơ, kim loại và este hóa tạo nền tảng cho việc ứng dụng axit cacboxylic trong công nghiệp và đời sống. Thông qua các bài tập thực hành, học sinh có thể rèn luyện kỹ năng viết công thức, gọi tên và giải các bài toán liên quan đến axit cacboxylic.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

