Hiểu sâu công thức cấu tạo P2O5 và các tính chất hóa học cơ bản
Công thức cấu tạo P2O5 thể hiện cấu trúc phân tử độc đáo của photpho pentaoxit. Hợp chất này có vai trò quan trọng trong phản ứng hóa học với nước, bazơ và axit. P2O5 được ứng dụng rộng rãi làm chất hút ẩm trong công nghiệp và phòng thí nghiệm.
Công thức cấu tạo P2O5 và cấu trúc phân tử
P2O5 là một hợp chất vô cơ quan trọng trong hóa học. Tôi sẽ giải thích chi tiết về cấu trúc của nó.
Công thức cấu tạo P2O5 có dạng O=P-O-P=O với 3 nguyên tử oxy tạo liên kết đơn nối giữa 2 nguyên tử photpho. Mỗi nguyên tử P đều tạo liên kết đôi với 1 nguyên tử O.
Khi giảng dạy về cấu tạo P2O5, tôi thường ví von nó như một cây cầu. Hai nguyên tử P như hai trụ cầu được nối với nhau bởi cầu nối O ở giữa và có “tay vịn” là các liên kết đôi P=O ở hai bên.
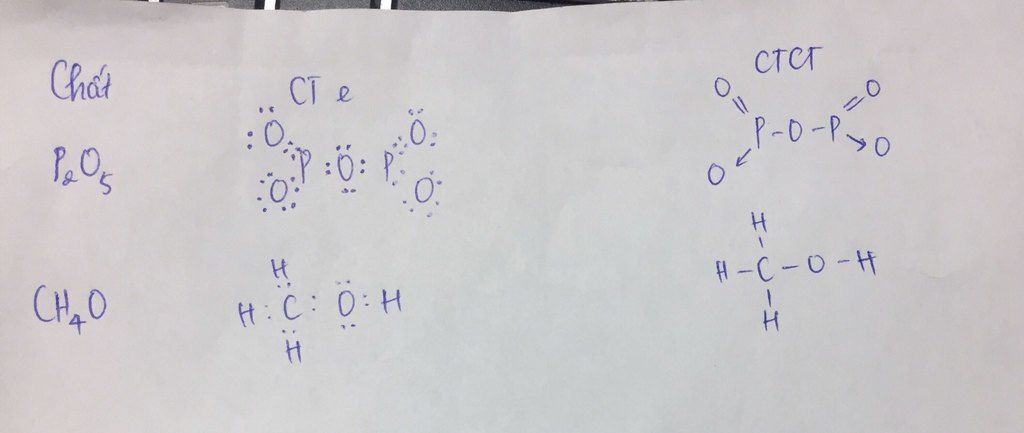
Công thức P2O5 thể hiện rõ tỉ lệ số nguyên tử trong phân tử: 2 nguyên tử P liên kết với 5 nguyên tử O. Trong đó:
- 3 nguyên tử O tạo liên kết đơn P-O-P
- 2 nguyên tử O còn lại tạo liên kết đôi P=O
Cấu trúc không gian của P2O5 có dạng hình học ba chiều. Các liên kết P-O và P=O sắp xếp theo hình tứ diện xung quanh mỗi nguyên tử P trung tâm.
Hiểu rõ cấu trúc này giúp các em dễ dàng giải thích được tính chất hóa học của P2O5 như khả năng hút ẩm mạnh hay phản ứng với nước tạo axit photphoric.
Tính chất vật lý và hóa học của P2O5
P2O5 là hợp chất vô cơ có công thức phân tử P2O5, được biết đến với tên gọi điển hình là photpho pentaoxit. Hợp chất này có vai trò quan trọng trong công nghiệp hóa chất và nghiên cứu phòng thí nghiệm.
Tương tự như công thức cấu tạo của c2h5oh, P2O5 cũng có cấu trúc phân tử đặc trưng quyết định các tính chất của nó. Các tính chất này được chia thành hai nhóm chính: tính chất vật lý và tính chất hóa học.
Tính chất vật lý đặc trưng
P2O5 tồn tại ở dạng tinh thể màu trắng trong điều kiện thường. Chất này có khối lượng riêng 2,39 g/cm3 và nhiệt độ nóng chảy 340°C.
Đặc biệt, P2O5 rất dễ hút ẩm từ không khí. Khi tiếp xúc với không khí ẩm, nó nhanh chóng tạo thành dung dịch axit photphoric đặc.
Trong quá trình giảng dạy, tôi thường nhắc học sinh cất giữ P2O5 trong bình kín có chứa silica gel để tránh hút ẩm.
Tính chất hóa học cơ bản
P2O5 có tính chất oxit axit mạnh, thể hiện qua phản ứng với nước tạo thành axit photphoric:

P2O5 + 3H2O → 2H3PO4
P2O5 phản ứng mạnh với bazơ tạo muối photphat:
P2O5 + 6NaOH → 2Na3PO4 + 3H2O
Khi nhiệt độ cao, P2O5 có thể khử được bởi cacbon:
2P2O5 + 10C → P4 + 10CO
Phản ứng của P2O5 với nước và bazơ
P2O5 là một oxit axit điển hình, có khả năng phản ứng mạnh với nước và bazơ tạo thành các sản phẩm khác nhau. Các phản ứng này rất quan trọng trong công nghiệp sản xuất phân bón và hóa chất.
P2O5 tác dụng với nước
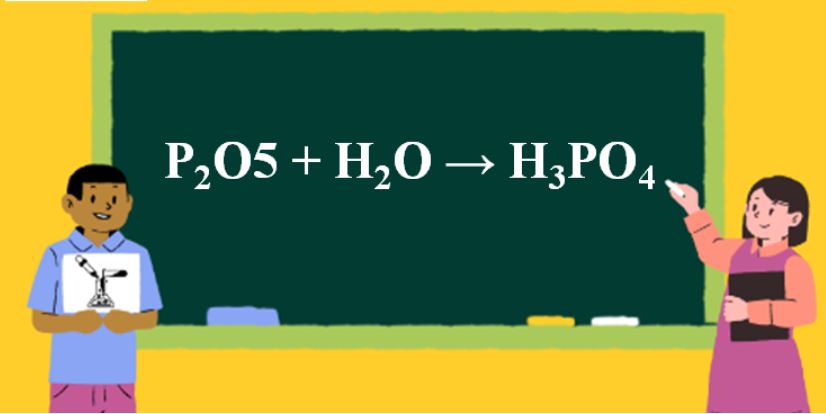
P2O5 tác dụng với nước tạo thành axit photphoric theo phương trình:
P2O5 + 3H2O → 2H3PO4
Phản ứng này xảy ra mạnh mẽ và tỏa nhiệt. Tôi thường ví von đây là phản ứng “khát nước” vì P2O5 hút ẩm rất mạnh từ không khí.
Trong quá trình giảng dạy, tôi hay gợi ý học sinh liên hệ với công thức cấu tạo c5h12 để thấy sự khác biệt trong cấu trúc phân tử.
P2O5 tác dụng với bazơ
Khi cho P2O5 tác dụng với dung dịch bazơ, phản ứng xảy ra theo hai giai đoạn:
Giai đoạn 1: P2O5 + H2O → 2HPO3
Giai đoạn 2: HPO3 + 2NaOH → Na2HPO4 + H2O
Sản phẩm cuối cùng thu được là muối photphat. Đây là phản ứng quan trọng trong sản xuất phân bón photphat.
Kinh nghiệm của tôi khi giảng dạy là luôn nhấn mạnh với học sinh về tính chất axit mạnh của P2O5 và khả năng phản ứng với bazơ để tạo muối.
Phản ứng của P2O5 với axit và oxit bazơ
P2O5 là một oxit axit điển hình, có khả năng phản ứng với cả axit và oxit bazơ. Tôi sẽ phân tích chi tiết từng loại phản ứng để các em dễ nắm bắt.
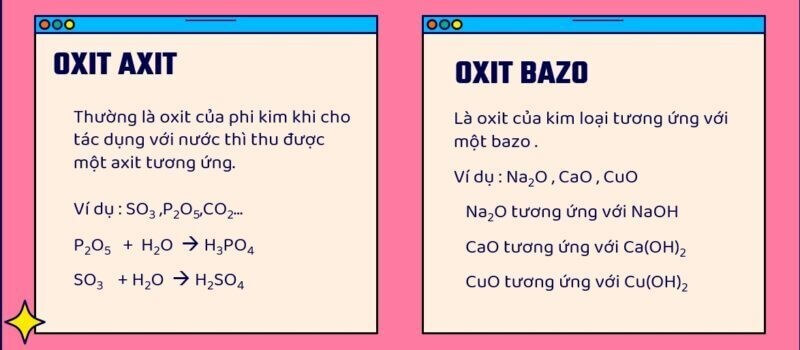
P2O5 tác dụng với axit
P2O5 tác dụng với axit tạo thành các muối photphat tương ứng. Phản ứng này diễn ra theo quy luật sau:
P2O5 + 2HX → 2HPO3X (với X là gốc axit)
Ví dụ điển hình là phản ứng với axit HCl:
P2O5 + 2HCl → 2HPO3Cl
Trong quá trình giảng dạy, tôi thường nhắc học sinh lưu ý rằng P2O5 rất dễ hút ẩm. Vì vậy khi thực hiện phản ứng cần bảo quản chất trong bình kín.
P2O5 tác dụng với oxit bazơ
P2O5 tác dụng với oxit bazơ là phản ứng tạo muối. Đây là phản ứng quan trọng trong công thức cấu tạo n2o5.
Phản ứng diễn ra theo phương trình:
P2O5 + 3Na2O → 2Na3PO4
Khi phản ứng với CaO:
P2O5 + 3CaO → Ca3(PO4)2
Kinh nghiệm của tôi cho thấy học sinh thường nhầm lẫn hệ số trong phản ứng này. Cách dễ nhớ là oxit bazơ luôn có hệ số 3, còn P2O5 có hệ số 1.
Ứng dụng của P2O5 trong thực tế
Pentaoxit photpho (P2O5) là một hợp chất vô cơ có nhiều ứng dụng quan trọng. Công thức cấu tạo P2O5 cho thấy đây là một oxit axit mạnh, dễ hút ẩm và phản ứng với nước.
Tôi thường ví von P2O5 như một “bọt biển hóa học” vì khả năng hút ẩm cực mạnh của nó. Khi tiếp xúc với nước, nó tạo thành axit photphoric (H3PO4) tương tự như công thức h2o2 là gì khi phân hủy tạo nước và oxi.
Ứng dụng trong công nghiệp
P2O5 được sử dụng rộng rãi làm chất hút ẩm trong sản xuất công nghiệp. Nó giúp loại bỏ hơi nước không mong muốn trong các quá trình sản xuất.
Trong ngành công nghiệp phân bón, P2O5 là nguyên liệu quan trọng để sản xuất phân lân. Phản ứng của nó với nước tạo ra axit photphoric dùng trong sản xuất phân bón DAP và MAP.
Ngoài ra, P2O5 còn được dùng trong công nghiệp dược phẩm để tổng hợp các hợp chất hữu cơ chứa photpho.
Ứng dụng trong phòng thí nghiệm
Trong phòng thí nghiệm, P2O5 thường được sử dụng làm chất làm khô mạnh. Nó có thể hút ẩm từ không khí và các dung môi hữu cơ một cách hiệu quả.
Qua 20 năm giảng dạy, tôi thường dùng P2O5 để làm khô các chất khí trong thí nghiệm. Chỉ cần cho khí đi qua bình chứa P2O5, độ ẩm sẽ giảm đáng kể.
P2O5 cũng được dùng làm chất xúc tác trong một số phản ứng hữu cơ. Đặc biệt trong phản ứng tách nước từ rượu để tạo thành anken.
FAQ: Câu hỏi thường gặp về P2O5
P2O5 là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp và đời sống. Tôi sẽ giải đáp các thắc mắc phổ biến về hợp chất này.
P2O5 có phản ứng với muối không?
P2O5 tác dụng với muối phụ thuộc vào bản chất của muối đó. P2O5 là một oxit axit mạnh nên có khả năng phản ứng với nhiều loại muối.
Với muối của axit yếu, P2O5 sẽ đẩy axit yếu ra khỏi muối. Ví dụ khi tác dụng với Na2CO3, P2O5 sẽ giải phóng CO2.
Với muối của axit mạnh như NaCl, P2O5 không phản ứng vì không đủ mạnh để đẩy HCl ra khỏi muối.
Cách bảo quản và sử dụng P2O5 an toàn
P2O5 cần được bảo quản trong bình kín, tránh tiếp xúc với không khí ẩm. Chất này rất dễ hút ẩm và tỏa nhiệt mạnh.
Khi sử dụng P2O5, cần đeo găng tay, kính bảo hộ và khẩu trang. Tránh để P2O5 tiếp xúc trực tiếp với da.
Trong phòng thí nghiệm, tôi thường hướng dẫn học sinh đặt P2O5 trong tủ hút và chỉ lấy ra lượng vừa đủ sử dụng. Điều này giúp hạn chế rủi ro khi thao tác với chất này.
Kiến thức về công thức cấu tạo P2O5 giúp học sinh nắm vững cấu trúc phân tử và các tính chất đặc trưng của hợp chất này. P2O5 là một oxit axit điển hình với khả năng phản ứng mạnh với nước, bazơ và nhiều chất khác. Việc nắm chắc các phản ứng hóa học cơ bản và ứng dụng thực tế của P2O5 tạo nền tảng quan trọng cho việc học tập hóa học nâng cao.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

