Thuộc lòng công thức cấu tạo NH3 và cấu trúc phân tử amoniac
Công thức cấu tạo NH3 thể hiện đặc điểm cấu trúc không gian của phân tử amoniac. Phân tử này có dạng hình học tháp tam giác với góc liên kết đặc trưng. Các liên kết trong NH3 được hình thành từ quá trình lai hóa sp3 của nguyên tử nitơ. Tính phân cực của NH3 tạo nên nhiều tính chất hóa học quan trọng.
Công thức cấu tạo NH3
Amoniac (NH3) là một hợp chất phổ biến trong tự nhiên và công nghiệp. Công thức cấu tạo NH3 có cấu trúc hình tháp tam giác với nguyên tử N ở đỉnh.
Phân tử NH3 có cấu tạo không gian như sau:
- Nguyên tử N ở trung tâm, liên kết với 3 nguyên tử H
- Góc liên kết H-N-H là 107°
- Cặp electron tự do của N nằm ở đỉnh tháp
Cấu trúc không gian của NH3 được giải thích bởi thuyết VSEPR. Nguyên tử N có 5 electron hóa trị, tạo 3 liên kết đơn với H và 1 cặp electron tự do.
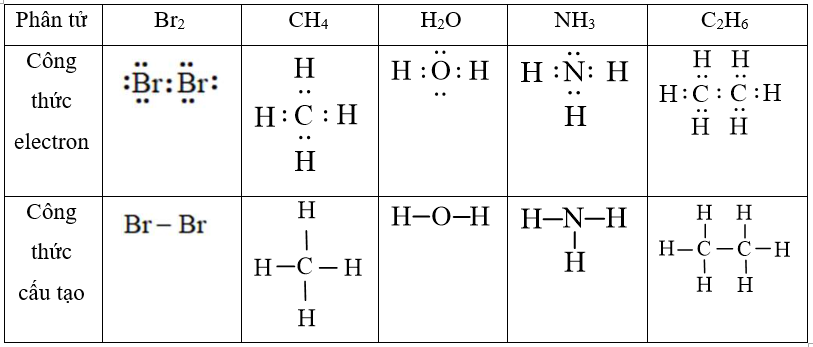
Trong quá trình giảng dạy, tôi thường ví von cấu trúc NH3 như chiếc ô 3 cạnh, với N là tay cầm ô và 3 nguyên tử H là 3 thanh ô. Cách hình dung này giúp học sinh dễ nhớ hơn.
Một điểm quan trọng là do có cặp electron tự do, phân tử NH3 có tính phân cực và có thể tham gia phản ứng cho – nhận electron. Đây là cơ sở cho nhiều ứng dụng quan trọng của NH3 trong thực tế.
Cấu tạo phân tử NH3 và các liên kết hóa học
Phân tử NH3 có cấu trúc hình tháp tam giác với nguyên tử N ở đỉnh và 3 nguyên tử H ở 3 đỉnh của tam giác đáy. Cấu tạo phân tử NH3 được hình thành từ các liên kết cộng hóa trị giữa N và H.
Để hiểu rõ hơn về cấu trúc này, ta cần phân tích từ cấu hình electron của các nguyên tử tham gia và quá trình hình thành liên kết. Tương tự như công thức cấu tạo của SO3, cấu trúc NH3 cũng tuân theo quy luật bát tử.
Cấu hình electron của nguyên tử N và H
Nguyên tử nitơ (N) có cấu hình electron: 1s2 2s2 2p3, với 5 electron hóa trị ở lớp ngoài cùng. Trong đó có 3 electron độc thân ở orbital 2p.
Nguyên tử hydro (H) có cấu hình electron đơn giản: 1s1, chỉ có 1 electron hóa trị. Đây là điều kiện thuận lợi để H tham gia liên kết với N.
Sự hình thành liên kết trong phân tử NH3
Liên kết trong NH3 được hình thành khi 3 electron độc thân của N tạo liên kết cộng hóa trị với 3 electron của 3 nguyên tử H. Mỗi liên kết N-H được tạo thành từ một cặp electron dùng chung.
Cặp electron còn lại của N không tham gia liên kết, tạo thành cặp electron tự do. Cặp electron này đóng vai trò quan trọng trong việc định hình cấu trúc không gian của phân tử.
Góc liên kết trong NH3
Góc liên kết NH3 lý thuyết là 109°28′, nhưng thực tế chỉ đạt khoảng 107°. Sự sai lệch này do ảnh hưởng của cặp electron tự do.
Cặp electron tự do có xu hướng chiếm không gian lớn hơn các cặp electron liên kết. Điều này đẩy 3 liên kết N-H xích lại gần nhau, làm giảm góc liên kết xuống thấp hơn giá trị lý thuyết.
Lai hóa sp3 và hình học phân tử NH3
Phân tử NH3 có cấu trúc không gian đặc biệt do quá trình lai hóa sp3 của nguyên tử N. Cấu trúc này ảnh hưởng trực tiếp đến tính chất hóa học của phân tử.
Quá trình lai hóa sp3 của nguyên tử N
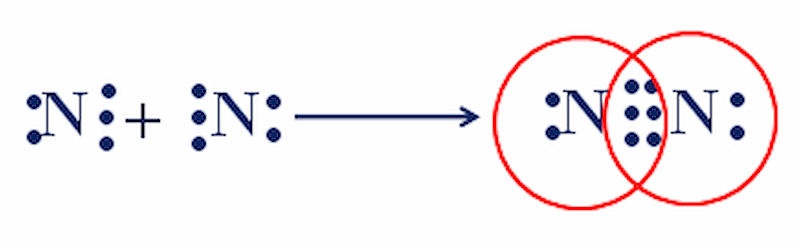
Nguyên tử N có cấu hình electron lớp ngoài cùng là 2s22p3. Khi tham gia liên kết, các orbital 2s và 2p lai hóa tạo thành 4 orbital lai hóa sp3 tương đương.
Quá trình lai hóa NH3 diễn ra khi 3 orbital sp3 tạo liên kết với 3 nguyên tử H. Orbital sp3 còn lại chứa cặp electron độc thân của N.
Tương tự như cấu trúc của công thức cấu tạo của ch3oh, quá trình lai hóa quyết định hình dạng không gian của phân tử.
Hình học phân tử dạng tháp tam giác
Hình học phân tử NH3 có dạng tháp tam giác với góc liên kết H-N-H xấp xỉ 107°. Nguyên tử N nằm ở đỉnh tháp, 3 nguyên tử H ở 3 đỉnh đáy.
Góc liên kết này nhỏ hơn góc tứ diện lý tưởng 109.5° do lực đẩy của cặp electron độc thân. Đây là điểm khác biệt so với cấu trúc tứ diện của CH4.

Cặp electron độc thân và ảnh hưởng
Cặp electron độc thân trên nguyên tử N tạo ra lực đẩy mạnh với các liên kết N-H. Điều này làm cho phân tử có tính phân cực cao.
Khả năng cho electron của cặp electron độc thân giúp NH3 dễ dàng tham gia phản ứng với axit Lewis. Đây là cơ sở cho nhiều ứng dụng quan trọng của NH3 trong công nghiệp.
Phân bố electron và tính phân cực của NH3
Phân tử NH3 có cấu trúc đặc biệt với sự phân bố electron NH3 không đều. Điều này tạo nên tính phân cực và khả năng tạo liên kết đặc trưng của phân tử.
Cấu hình electron trong phân tử NH3
Nguyên tử N có 5 electron hóa trị, tạo 3 liên kết cộng hóa trị với 3 nguyên tử H. Một cặp electron còn lại tồn tại dưới dạng cặp electron tự do.
Cấu hình electron NH3 có dạng hình tháp tam giác với góc liên kết H-N-H là 107°. Góc này nhỏ hơn góc tứ diện lý tưởng 109.5° do ảnh hưởng của cặp electron tự do.
Tương tự như cấu tạo phân tử CH3Cl, cấu trúc không gian của NH3 quyết định nhiều tính chất quan trọng của nó.
Moment lưỡng cực và tính phân cực
Phân cực NH3 xảy ra do sự phân bố điện tích không đều trong phân tử. Nguyên tử N có độ âm điện lớn hơn H nên hút electron mạnh hơn.
Moment lưỡng cực của NH3 là 1.47 D, lớn hơn nhiều so với công thức hno2 là gì. Điều này làm cho NH3 có khả năng tan tốt trong nước.
Khả năng tạo liên kết hydrogen
Cặp electron tự do trên nguyên tử N cho phép NH3 tạo liên kết hydrogen với các phân tử khác. Đây là cơ sở cho nhiều phản ứng quan trọng.
Trong dung dịch nước, NH3 tạo liên kết hydrogen với H2O tạo thành NH4OH. Quá trình này giải thích tính bazơ của dung dịch amoniac.
Kinh nghiệm giảng dạy cho thấy việc hiểu rõ cấu trúc electron giúp học sinh nắm vững các tính chất hóa học của NH3.
FAQ: Câu hỏi thường gặp về cấu tạo NH3
Phân tử NH3 có cấu trúc đặc biệt với công thức cấu tạo NH3 dạng tháp tam giác. Cấu trúc này quyết định nhiều tính chất quan trọng của amoniac.
Tương tự như buta-1 3-đien có công thức cấu tạo là, công thức cấu tạo của nh3 cũng tuân theo quy luật hình học phân tử. Ngoài ra, Công thức H2CO3 là gì cũng là một ví dụ điển hình về cấu trúc phân tử trong hóa học.
Tại sao NH3 có dạng hình học tháp tam giác?
NH3 có dạng hình học tháp tam giác do sự sắp xếp của 4 cặp electron xung quanh nguyên tử N trung tâm. Ba cặp electron tham gia liên kết với H tạo thành đáy tam giác.
Cặp electron không liên kết thứ 4 hướng lên trên đỉnh tháp. Góc liên kết H-N-H là 107° thay vì 109.5° như dự đoán do lực đẩy mạnh từ cặp electron tự do.
Vì sao NH3 có tính phân cực?
Tính phân cực của NH3 xuất phát từ sự phân bố không đều điện tích trong phân tử. Nguyên tử N có độ âm điện lớn hơn H nên hút electron mạnh hơn.
Cặp electron không liên kết tạo moment lưỡng cực hướng từ tâm N ra ngoài. Điều này làm cho phân tử NH3 có tính phân cực mạnh và dễ tạo liên kết hydro.
NH3 có mấy cặp electron liên kết và không liên kết?
NH3 có 3 cặp electron liên kết và 1 cặp electron không liên kết. Ba cặp electron liên kết tạo thành 3 liên kết cộng hóa trị N-H.
Cặp electron không liên kết nằm trên nguyên tử N đóng vai trò quan trọng. Nó quyết định hình dạng phân tử và khả năng cho electron của NH3 trong phản ứng.
Kiến thức về công thức cấu tạo NH3 giúp các em hiểu rõ bản chất của phân tử amoniac. Phân tử NH3 có cấu trúc hình học tháp tam giác với góc liên kết 107°, được hình thành từ lai hóa sp3 của nguyên tử N. Sự phân bố electron không đều tạo nên tính phân cực và khả năng tạo liên kết hydrogen đặc trưng của NH3. Đây là những kiến thức nền tảng quan trọng để học tập tốt môn hóa học.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

