Tìm hiểu công thức cấu tạo N2H4 và tính chất của hydrazin trong hóa học
Công thức cấu tạo N2H4 là nền tảng để hiểu về hydrazin trong hóa học. Phân tử này có cấu trúc không gian đặc biệt với liên kết đơn N-N. Hydrazin thể hiện tính bazơ và khử mạnh trong các phản ứng. Chất này có nhiều ứng dụng quan trọng trong công nghiệp hóa chất.
Công thức cấu tạo N2H4
N2H4 hay hydrazin là một hợp chất vô cơ có công thức cấu tạo N2H4 khá đặc biệt. Tôi sẽ giúp các em hiểu rõ cấu trúc phân tử của nó.
Trong phân tử N2H4, hai nguyên tử nitơ liên kết với nhau bằng liên kết đơn N-N. Mỗi nguyên tử nitơ còn liên kết với 2 nguyên tử hydro bằng liên kết đơn N-H.
Công thức cấu tạo của N2H4 có thể biểu diễn như sau:
H2N-NH2
Cấu trúc không gian của phân tử N2H4 có dạng zigzag, với góc liên kết H-N-H khoảng 107°. Điều này giúp giảm lực đẩy giữa các cặp electron không liên kết.
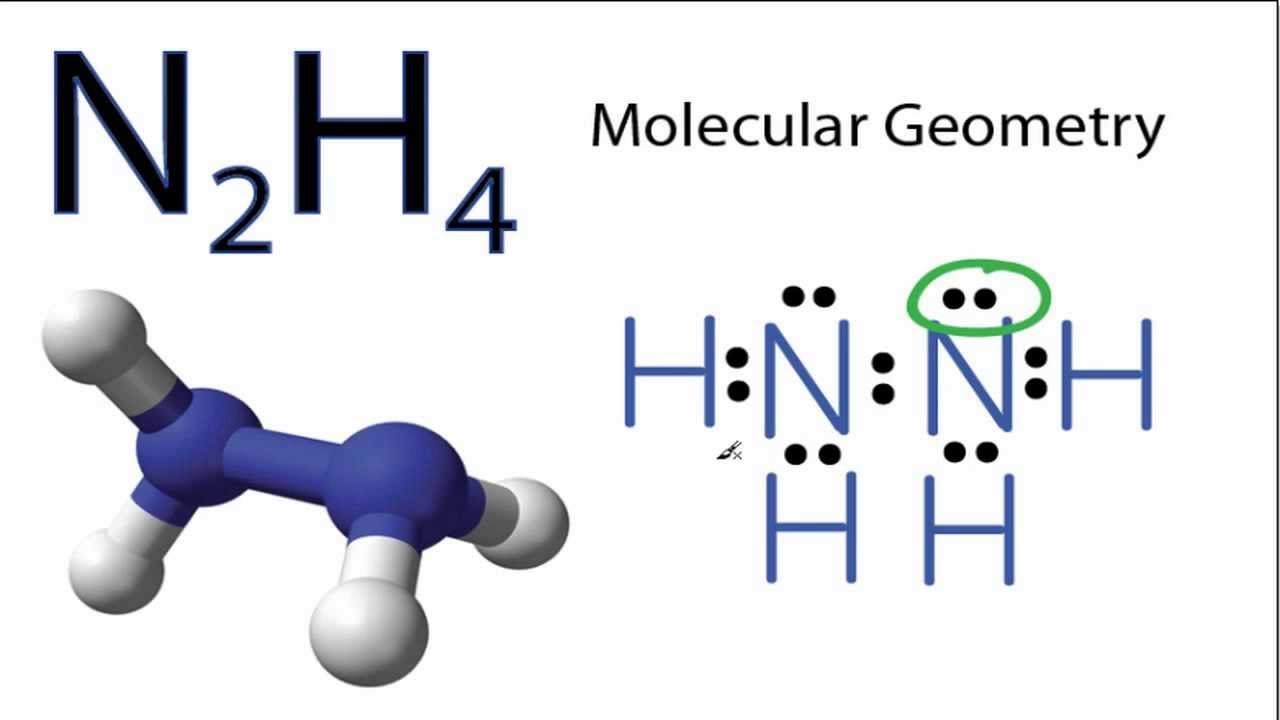
Trong quá trình giảng dạy, tôi thường ví von cấu trúc N2H4 như một chiếc thang xếp nhỏ. Hai nguyên tử N là hai thanh thang, còn các nguyên tử H là các bậc thang nối giữa chúng.
Hiểu rõ cấu trúc phân tử N2H4 sẽ giúp các em dễ dàng giải thích được nhiều tính chất hóa học của nó. Ví dụ như khả năng tạo liên kết hydro hay tính bazơ của hydrazin.
Cấu tạo phân tử N2H4 và các đặc điểm liên kết
Cấu tạo phân tử N2H4 có cấu trúc đặc biệt với hai nguyên tử nitơ liên kết với nhau và bốn nguyên tử hydro. Tương tự như cấu tạo phân tử NH3, N2H4 cũng có cặp electron tự do trên nguyên tử N.
Phân tử N2H4 có vai trò quan trọng trong nhiều ứng dụng công nghiệp và nghiên cứu khoa học. Cấu trúc này tạo nên tính chất đặc trưng của hydrazin – một hợp chất được sử dụng làm nhiên liệu tên lửa.
Cấu trúc không gian của phân tử N2H4
Phân tử N2H4 có dạng hình học zigzag, không phẳng như công thức cấu tạo của ch4. Hai nguyên tử nitơ nằm ở trung tâm và bốn nguyên tử hydro phân bố xung quanh.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc thang xoắn mini. Điều này giúp học sinh dễ hình dung và nhớ lâu hơn về hình dạng không gian của phân tử.
Các liên kết trong phân tử N2H4
Liên kết N-N trong phân tử là liên kết đơn σ, được hình thành từ sự xen phủ trực tiếp các orbital s của hai nguyên tử nitơ.
Các liên kết N-H là liên kết cộng hóa trị phân cực, do sự chênh lệch độ âm điện giữa N và H. Mỗi nguyên tử N tạo hai liên kết với hai nguyên tử H.
Góc liên kết và độ dài liên kết
Góc liên kết H-N-H trong N2H4 xấp xỉ 107°, nhỏ hơn góc tứ diện lý tưởng 109.5°. Nguyên nhân là do ảnh hưởng của cặp electron tự do trên nguyên tử N.
Độ dài liên kết N-N trong phân tử là 1.45Å, dài hơn so với liên kết N≡N trong phân tử N2 (1.09Å). Các liên kết N-H có độ dài trung bình khoảng 1.01Å.
Kinh nghiệm của tôi cho thấy việc so sánh các thông số này với các phân tử quen thuộc giúp học sinh dễ nhớ và hiểu sâu hơn về cấu trúc phân tử.
Tính chất hóa học của Hydrazin N2H4
Hydrazin N2H4 là một bazơ yếu có tính khử mạnh. Phân tử hydrazin có cấu trúc không gian hình chữ V với góc liên kết N-N-H là 106,8°.
Hydrazin có khả năng tham gia nhiều phản ứng hóa học đặc trưng. Tôi thường ví von nó như một “chiến binh” trong phòng thí nghiệm – vừa có thể “tấn công” bằng tính bazơ, vừa có thể “phòng thủ” bằng tính khử.
Tính bazơ của N2H4
N2H4 thể hiện tính bazơ do có cặp electron chưa liên kết trên nguyên tử N. Phản ứng với axit tạo muối hydrazoni:
N2H4 + HCl → N2H5Cl
Tương tự như công thức cấu tạo của nh4cl, muối hydrazoni cũng có cấu trúc ion.
Tính khử của N2H4

N2H4 là chất khử mạnh do có số oxi hóa trung gian của N. Trong môi trường bazơ, N2H4 bị oxi hóa thành N2:
N2H4 + 2OH- → N2 + 4H2O + 4e-
Trong môi trường axit, phản ứng xảy ra theo phương trình:
N2H4 → N2 + 4H+ + 4e-
Phản ứng với các chất khác
N2H4 phản ứng với nhiều chất oxi hóa mạnh như KMnO4, K2Cr2O7. Trong công nghiệp, N2H4 được dùng làm nhiên liệu tên lửa:
N2H4 + O2 → N2 + 2H2O + Q
N2H4 còn tham gia phản ứng với andehit tạo hydrazon:
N2H4 + RCHO → RCH=NNH2 + H2O
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhớ tốt nhất các phản ứng của N2H4 khi liên hệ với ứng dụng thực tế của nó.
Ứng dụng và độc tính của N2H4
Hydrazin (N2H4) là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp. Công thức cấu tạo N2H4 cho thấy đây là chất lỏng không màu với mùi đặc trưng giống amoniac.

Các ứng dụng trong công nghiệp
Hydrazin được sử dụng rộng rãi làm nhiên liệu tên lửa nhờ khả năng phân hủy tỏa nhiệt mạnh. Phản ứng này tạo ra nitrogen và hydrogen – những khí không độc hại.
Ứng dụng của N2H4 còn thể hiện trong ngành sản xuất polymer, nơi nó đóng vai trò chất khơi mào phản ứng trùng hợp. Tôi thường lấy ví dụ về quy trình sản xuất nylon để học sinh dễ hiểu vai trò của hydrazin.
Trong xử lý nước, hydrazin được dùng làm chất khử oxygen để ngăn ngừa ăn mòn. Đây là phương pháp hiệu quả bảo vệ hệ thống đường ống và nồi hơi công nghiệp.
Độc tính và biện pháp an toàn
N2H4 có độc không? Câu trả lời là có, hydrazin rất độc với cơ thể sống. Tiếp xúc trực tiếp có thể gây bỏng da, kích ứng mắt và đường hô hấp nghiêm trọng.
Khi làm việc với hydrazin, cần trang bị đầy đủ thiết bị bảo hộ như găng tay, kính, mặt nạ phòng độc. Tôi luôn nhắc nhở sinh viên thực hành phải tuân thủ nghiêm ngặt quy trình an toàn.
Trong trường hợp tiếp xúc với hydrazin, cần rửa sạch vùng bị nhiễm bằng nước sạch trong 15 phút. Nếu nuốt phải hoặc hít phải hơi hydrazin, phải đưa nạn nhân đến cơ sở y tế ngay lập tức.
FAQ: Câu hỏi thường gặp về N2H4
Hydrazin (N2H4) là một hợp chất hóa học quan trọng với nhiều ứng dụng trong công nghiệp và nghiên cứu. Tôi sẽ giải đáp các thắc mắc phổ biến về hợp chất này.
N2H4 có phải là axit không?
N2H4 không phải là axit mà là một bazơ yếu. Cấu trúc phân tử của nó gồm 2 nguyên tử nitơ và 4 nguyên tử hydro.
Khi tôi giảng dạy, tôi thường so sánh N2H4 với NH3 để học sinh dễ hiểu hơn. Giống như amoniac, hydrazin có khả năng nhận proton H+ để tạo thành ion N2H5+.
Các phản ứng của N2H4 với axit thường tạo ra muối hydrazinium, tương tự như công thức cấu tạo của h2so4 tạo muối với bazơ.
Cách nhận biết N2H4 trong phòng thí nghiệm
Công thức N2H4 là gì và cách nhận biết nó khá đơn giản. N2H4 là chất lỏng không màu với mùi đặc trưng giống amoniac.
Phương pháp nhận biết N2H4 phổ biến nhất là phản ứng với CuSO4. Khi cho dung dịch CuSO4 vào dung dịch chứa N2H4, sẽ tạo kết tủa màu xanh đặc trưng.
Một cách khác là sử dụng thuốc thử Tollens, tương tự như cách nhận biết công thức cấu tạo n2o5. N2H4 sẽ khử ion Ag+ thành Ag kim loại tạo gương bạc.
N2H4 công thức cấu tạo có dạng H2N-NH2, với hai nhóm -NH2 liên kết với nhau. Đây là cấu trúc đặc trưng giúp phân biệt với các hợp chất nitrogen khác.
Hydrazin với công thức cấu tạo N2H4 là một hợp chất quan trọng trong hóa học. Phân tử này có cấu trúc không gian đặc biệt với liên kết N-N và bốn liên kết N-H. N2H4 thể hiện tính bazơ và tính khử mạnh, được ứng dụng rộng rãi trong công nghiệp làm nhiên liệu tên lửa và chất khử. Tuy nhiên cần thận trọng khi sử dụng do tính độc của nó.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

