Điểm qua công thức cấu tạo H2O2 và những tính chất đặc trưng
Công thức cấu tạo H2O2 giải thích chi tiết cấu trúc phân tử hydro peroxit. Bài viết phân tích số liên kết, góc liên kết và tính chất đặc trưng của hợp chất này. Các ứng dụng thực tế và lưu ý an toàn khi sử dụng H2O2 được trình bày rõ ràng.
Công thức cấu tạo H2O2
Hydro peroxide (H2O2) có công thức cấu tạo H2O2 dạng chuỗi với 2 nguyên tử H và 2 nguyên tử O liên kết với nhau. Cấu trúc phân tử này tạo nên tính chất đặc biệt của nó.
Trong phân tử H2O2, hai nguyên tử oxy liên kết với nhau bằng liên kết đơn O-O. Mỗi nguyên tử oxy còn lại một electron tự do để liên kết với một nguyên tử hydro.
Công thức cấu tạo của H2O2 có thể viết dưới dạng:
H-O-O-H
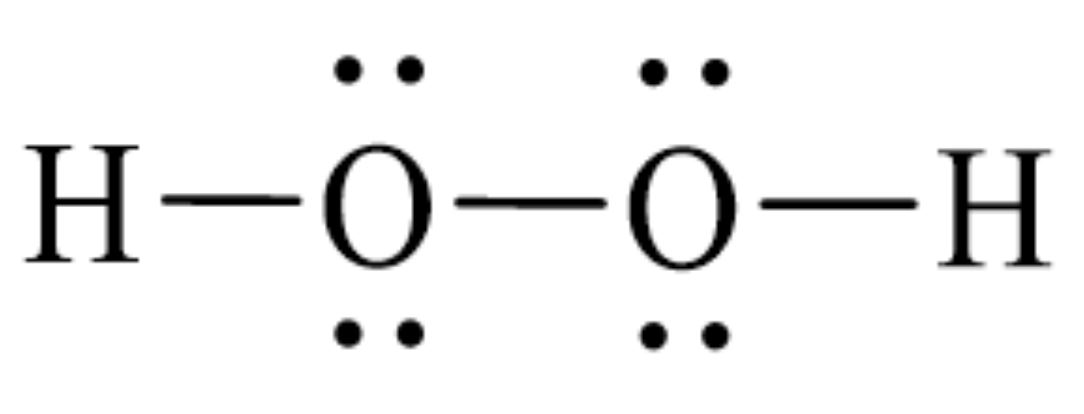 Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc cầu nối, với hai nguyên tử oxy ở giữa và hai nguyên tử hydro ở hai đầu. Điều này giúp học sinh dễ nhớ và hiểu rõ hơn về cấu trúc phân tử.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc cầu nối, với hai nguyên tử oxy ở giữa và hai nguyên tử hydro ở hai đầu. Điều này giúp học sinh dễ nhớ và hiểu rõ hơn về cấu trúc phân tử.
Khi so sánh với công thức cấu tạo h2so4, H2O2 có cấu trúc đơn giản hơn nhiều. Tuy nhiên, liên kết O-O yếu khiến H2O2 dễ phân hủy và có tính oxi hóa mạnh.
Để ghi nhớ công thức này, học sinh cần chú ý đến sự đối xứng trong cấu trúc phân tử. Hai nguyên tử H luôn nằm ở hai đầu và hai nguyên tử O liên kết với nhau ở giữa.
Cấu trúc phân tử và liên kết trong H2O2
Phân tử H2O2 (hydrogen peroxide) có cấu trúc không gian đặc biệt. Nó gồm 2 nguyên tử H và 2 nguyên tử O liên kết với nhau theo dạng xoắn.
Cấu trúc này khác hoàn toàn với công thức cấu tạo của co2 hay công thức hóa học của oxi. Điều này tạo nên tính chất đặc trưng của H2O2.
Số liên kết và electron trong phân tử H2O2
H2O2 có mấy liên kết? Phân tử H2O2 có 3 liên kết cộng hóa trị. Hai liên kết O-H và một liên kết O-O.
H2O2 có mấy electron hóa trị? Tổng số electron hóa trị là 14 electron. Mỗi nguyên tử O đóng góp 6 electron và mỗi nguyên tử H đóng góp 1 electron.
Các electron này phân bố không đều quanh các nguyên tử O và H tạo nên tính phân cực của phân tử.
Góc liên kết và độ dài liên kết
Góc liên kết H-O-O trong H2O2 khoảng 94,8 độ. Đây là góc nhỏ hơn góc liên kết trong nước.
Độ dài liên kết O-O là 1,47Å và O-H là 0,97Å. Liên kết O-O yếu hơn liên kết O-H nên dễ bị phân hủy.
Cấu trúc không gian của H2O2 có dạng xoắn với góc xoắn khoảng 111,5 độ giữa hai mặt phẳng H-O-O.
So sánh cấu trúc H2O2 với H2O
H2O2 có phải là nước không? Không, H2O2 khác biệt hoàn toàn với nước về cấu trúc phân tử.
H2O có dạng góc với góc liên kết 104,5 độ. H2O2 có cấu trúc xoắn phức tạp hơn nhiều.
Sự khác biệt về cấu trúc này dẫn đến tính chất hóa học và vật lý rất khác nhau giữa hai chất. H2O2 là chất oxi hóa mạnh trong khi H2O thì không.
Tính chất hóa học của H2O2
H2O2 là một chất lỏng không màu với nhiều tính chất hóa học đặc biệt. H2O2 có tính chất gì nổi bật nhất là khả năng vừa thể hiện tính oxi hóa vừa thể hiện tính khử trong các phản ứng.
Tương tự như công thức cấu tạo của so2, H2O2 có cấu trúc phân tử đặc biệt với liên kết O-O yếu. Điều này giúp nó dễ dàng tham gia các phản ứng hóa học.
Tính oxi hóa và khử của H2O2
H2O2 thể hiện tính oxi hóa mạnh trong môi trường axit. Nó có thể oxi hóa nhiều kim loại, phi kim và các ion có hóa trị thấp.
Trong môi trường bazơ, H2O2 lại thể hiện tính khử. Nó khử được nhiều chất oxi hóa mạnh như KMnO4, Cl2. H2O2 có phải là axit không là câu hỏi thường gặp – câu trả lời là không, nó là một bazơ yếu.
Độ bền và sự phân hủy của H2O2
H2O2 không bền trong điều kiện thường và dễ bị phân hủy thành H2O và O2. Tốc độ phân hủy tăng khi:
- Có mặt chất xúc tác như MnO2, Fe3+
- Nhiệt độ tăng cao
- Tiếp xúc với ánh sáng
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh thường nhầm lẫn giữa H2O2 và công thức co. H2O2 cần được bảo quản trong chai tối màu, nơi mát.
Phản ứng với các chất khác
H2O2 phản ứng được với nhiều chất trong tự nhiên. Với kim loại, nó tạo thành oxit kim loại và giải phóng H2.
Với các chất khử, H2O2 đóng vai trò chất oxi hóa. Ngược lại, khi tác dụng với chất oxi hóa mạnh, nó lại thể hiện tính khử.
Trong phòng thí nghiệm, tôi thường cho học sinh quan sát phản ứng giữa H2O2 với KMnO4. Màu tím của KMnO4 nhanh chóng mất đi, minh họa sinh động cho tính khử của H2O2.
Ứng dụng và độc tính của H2O2
Hydrogen peroxide (H2O2) là hợp chất hóa học có nhiều ứng dụng quan trọng. Tôi sẽ phân tích chi tiết về công dụng và độc tính của nó để bạn hiểu rõ hơn.
Các ứng dụng trong công nghiệp và đời sống
H2O2 dùng để làm gì? Đây là câu hỏi phổ biến của nhiều học sinh. Trong công nghiệp, H2O2 được sử dụng làm chất tẩy trắng giấy và vải sợi.
H2O2 có khả năng oxy hóa mạnh tương tự như cấu tạo phân tử c2h5oh nên được dùng để khử trùng vết thương, làm sạch bề mặt.
Trong phòng thí nghiệm, H2O2 thường được dùng làm tác nhân oxy hóa giống như công thức cấu tạo metan. Nó tham gia nhiều phản ứng hóa học quan trọng.
Độc tính và cách sử dụng an toàn
H2O2 có độc không? Câu trả lời là có, nhưng mức độ phụ thuộc vào nồng độ. Dung dịch H2O2 nồng độ cao có thể gây bỏng da và niêm mạc.
Theo nghiên cứu của Viện Khoa học và Công nghệ Việt Nam, H2O2 nồng độ trên 30% có thể gây tổn thương nghiêm trọng cho cơ thể.
Khi sử dụng H2O2, cần đeo găng tay và kính bảo hộ. Tránh để dung dịch tiếp xúc trực tiếp với da. Bảo quản ở nơi khô ráo, thoáng mát và xa tầm tay trẻ em.
FAQ: Câu hỏi thường gặp về H2O2
Công thức H2O2 là gì? H2O2 là công thức phân tử của hiđro peoxit, một chất lỏng không màu có tính oxy hóa mạnh. Cấu tạo phân tử gồm 2 nguyên tử hiđro và 2 nguyên tử oxi liên kết với nhau.
Tương tự như công thức cấu tạo h2co3, H2O2 có cấu trúc không gian đặc biệt. Các liên kết trong phân tử tạo thành góc 94,8 độ với nhau.
Nếu bạn muốn tìm hiểu thêm về các hợp chất tương tự như cấu tạo phân tử n2h4, có thể thấy chúng đều chứa nguyên tố hiđro.
Một số hợp chất khác như công thức hóa học của sắt 2 hiđroxit là cũng có tính chất oxy hóa khử tương tự H2O2.
Qua 20 năm giảng dạy, tôi thường giúp học sinh ghi nhớ công thức H2O2 bằng cách liên tưởng đến nước H2O. H2O2 chỉ khác H2O ở chỗ có thêm 1 nguyên tử oxi.
Hiđro peoxit với công thức cấu tạo H2O2 là hợp chất quan trọng trong hóa học. Phân tử này có cấu trúc đặc biệt với liên kết đơn O-O và hai liên kết O-H. H2O2 thể hiện tính oxi hóa và khử mạnh, được ứng dụng rộng rãi trong công nghiệp và y tế. Việc nắm vững cấu tạo và tính chất của H2O2 giúp sử dụng an toàn và hiệu quả trong thực tế.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

