Công thức cấu tạo của SO2 và các tính chất hóa học quan trọng
Công thức cấu tạo của SO2 giúp giải thích cấu trúc phân tử và tính chất đặc biệt của lưu huỳnh đioxit. Khí SO2 có vai trò quan trọng trong công nghiệp hóa chất và tác động trực tiếp đến môi trường. Các phản ứng hóa học của SO2 tạo nên nhiều hợp chất có giá trị ứng dụng trong đời sống.
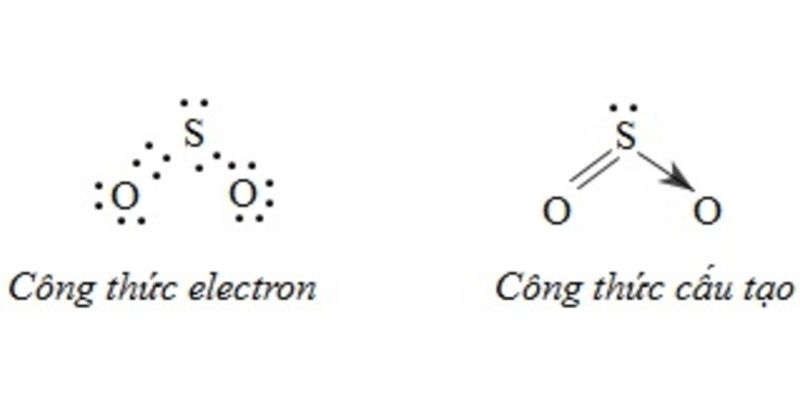
Công thức cấu tạo của SO2
SO2 (lưu huỳnh đioxit) là một phân tử có cấu tạo góc với góc liên kết O-S-O là 119,5°. Đây là một trong những hợp chất vô cơ quan trọng trong công nghiệp hóa chất.
Công thức cấu tạo của SO2 được biểu diễn như sau:
O=S=O
Trong đó:
- Nguyên tử S (lưu huỳnh) ở trung tâm
- 2 nguyên tử O (oxi) liên kết với S bằng 2 liên kết đôi
- Mỗi liên kết đôi S=O có độ dài 143 pm
Cấu trúc góc của SO2 được giải thích bởi lý thuyết đẩy electron của các cặp electron hóa trị. Nguyên tử S có 2 cặp electron liên kết và 1 cặp electron tự do, tạo nên hình dạng góc của phân tử.
Trong quá trình giảng dạy, tôi thường ví von SO2 như một chiếc boomerang – một dụng cụ ném có hình chữ V. Cách hình dung này giúp học sinh dễ nhớ cấu trúc góc đặc trưng của phân tử.
Khi vẽ công thức cấu tạo SO2, cần chú ý thể hiện rõ góc liên kết và các liên kết đôi. Điều này giúp hiểu rõ hơn về tính chất hóa học của hợp chất.
Cấu tạo phân tử SO2 và công thức electron
Phân tử SO2 có cấu tạo khá đặc biệt với 1 nguyên tử lưu huỳnh (S) và 2 nguyên tử oxy (O). Tương tự như công thức cấu tạo của co2, SO2 cũng là một phân tử có vai trò quan trọng.
Để hiểu rõ về công thức electron của SO2, chúng ta cần phân tích từng thành phần cấu tạo nên phân tử này.
Công thức electron của SO2
Nguyên tử S có cấu hình electron: [Ne]3s²3p⁴
Nguyên tử O có cấu hình electron: [He]2s²2p⁴
Khi hình thành cấu tạo phân tử SO2, các electron hóa trị của S và O tham gia liên kết tạo thành các cặp electron chung.
Liên kết trong phân tử SO2
Trong phân tử SO2, nguyên tử S tạo hai liên kết đơn với hai nguyên tử O. Mỗi liên kết đơn được tạo bởi một cặp electron chung.
Ngoài ra còn có các cặp electron độc thân trên nguyên tử O và S. Điều này tạo nên sự phân cực trong phân tử.
Hình dạng phân tử SO2
Phân tử SO2 có dạng hình chữ V với góc liên kết O-S-O khoảng 119°. Cấu trúc này là kết quả của lý thuyết đẩy electron vỏ hóa trị (VSEPR).
Các cặp electron độc thân trên nguyên tử S đẩy các liên kết S-O ra xa hơn so với góc tứ diện lý tưởng 109.5°.

Kinh nghiệm giảng dạy cho thấy học sinh thường nhớ hình dạng này bằng cách liên tưởng đến chữ V trong tiếng Việt.
Tính chất vật lý của khí SO2
Khí SO2 có nhiều tính chất vật lý đặc trưng giúp nhận biết và phân biệt với các khí khác. Tương tự như CO2 có tính chất gì, SO2 cũng là một khí có vai trò quan trọng trong công nghiệp và môi trường.
Trạng thái và màu sắc
SO2 tồn tại ở dạng khí trong điều kiện nhiệt độ và áp suất thường. Đây là một chất khí không màu, trong suốt như không khí.
Ở nhiệt độ -10°C và áp suất 1 atm, SO2 sẽ hóa lỏng thành chất lỏng không màu. Điều này giúp việc bảo quản và vận chuyển SO2 dễ dàng hơn trong công nghiệp.
Mùi đặc trưng của SO2
SO2 có mùi hắc, xốc mũi rất đặc trưng, giống như mùi của diêm cháy. Mùi này có thể gây kích ứng đường hô hấp nếu hít phải.
Với kinh nghiệm giảng dạy, tôi thường cho học sinh ngửi mùi diêm sau khi cháy để nhận biết mùi SO2. Tuy nhiên cần thực hiện cẩn thận và trong thời gian ngắn.
Độ tan trong nước
SO2 tan trong nước rất tốt. Ở 20°C, 1 thể tích nước có thể hòa tan được khoảng 40 thể tích SO2.
Khi tan trong nước, SO2 tạo thành axit sunfurơ (H2SO3) theo phương trình:
SO2 + H2O ⇌ H2SO3
Đặc tính này giúp SO2 dễ dàng bị hấp thụ bởi nước mưa, tạo thành mưa axit gây ô nhiễm môi trường.
Tính chất hóa học của SO2
SO2 có tính chất gì chủ yếu thể hiện qua các phản ứng với nước, phản ứng oxi hóa – khử và phản ứng với bazơ. SO2 là một chất khí không màu, có mùi hắc đặc trưng và dễ tan trong nước.
 Tính chất hóa học của SO2
Tính chất hóa học của SO2Phản ứng với nước
SO2 tan trong nước tạo thành axit sunfurơ theo phương trình:
SO2 + H2O ⇌ H2SO3
Axit sunfurơ là một axit yếu, không bền. Nó dễ phân hủy thành SO2 và H2O khi đun nóng. Tương tự như công thức e của h2co3, H2SO3 tồn tại chủ yếu trong dung dịch.
Phản ứng oxi hóa – khử
SO2 có tính khử mạnh trong môi trường axit. Nó khử được nhiều chất oxi hóa mạnh như KMnO4, K2Cr2O7.
Trong không khí ẩm, SO2 bị oxi hóa chậm thành SO3:
2SO2 + O2 → 2SO3
SO3 sau đó tác dụng với hơi nước tạo thành công thức cấu tạo h2so4. Đây là nguyên nhân gây mưa axit.
Phản ứng với bazơ
SO2 tác dụng với dung dịch bazơ tạo muối sunfit và hydrosunfit:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
Phản ứng này được ứng dụng để xử lý khí thải công nghiệp có chứa SO2. Tôi thường cho học sinh làm thí nghiệm sục SO2 vào dung dịch NaOH để minh họa phản ứng này.
FAQ: Câu hỏi thường gặp về SO2
Khí SO2 là một trong những chất gây ô nhiễm không khí phổ biến. Tìm hiểu các thông tin quan trọng về tác động và cách phòng tránh khí độc này.
SO2 có độc không?
SO2 có độc không là câu hỏi được nhiều người quan tâm. SO2 là một loại khí độc hại, không màu với mùi hắc đặc trưng.
Khi tiếp xúc với nồng độ SO2 từ 1-5ppm có thể gây kích ứng đường hô hấp. Nồng độ cao hơn 500ppm có nguy cơ tử vong.
SO2 còn là tác nhân gây mưa axit, tương tự như công thức cấu tạo co khi phản ứng với nước trong không khí.
Tác hại của SO2 đối với sức khỏe
SO2 tác động trực tiếp đến hệ hô hấp, gây viêm phổi và các bệnh đường hô hấp mãn tính.
Tiếp xúc lâu dài với SO2 làm tăng nguy cơ mắc bệnh tim mạch và đột quỵ. Trẻ em và người già đặc biệt nhạy cảm.
Theo WHO, phơi nhiễm SO2 làm tăng tỷ lệ nhập viện do các bệnh về đường hô hấp lên 12%.
Cách phòng tránh nhiễm độc SO2
Sử dụng khẩu trang đạt chuẩn khi ra đường, đặc biệt tại các khu vực ô nhiễm không khí nặng.
Lắp đặt hệ thống lọc không khí trong nhà và thường xuyên kiểm tra, bảo dưỡng.
Tránh hoạt động ngoài trời vào những ngày ô nhiễm cao. Theo dõi chỉ số chất lượng không khí để có biện pháp phòng tránh phù hợp.
Kiến thức về công thức cấu tạo của SO2 giúp các em nắm vững cấu trúc phân tử và tính chất của lưu huỳnh đioxit. Đây là một khí độc, có mùi hắc đặc trưng và tan tốt trong nước tạo axit sunfurơ. SO2 tham gia nhiều phản ứng hóa học quan trọng và gây ô nhiễm môi trường nghiêm trọng. Việc nắm chắc cấu tạo phân tử và tính chất của SO2 là nền tảng để học tốt chương trình hóa học phổ thông.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

