Thuộc lòng công thức cấu tạo của metan và các dạng biểu diễn cơ bản
Công thức cấu tạo của metan là nền tảng quan trọng trong hóa học hữu cơ. Phân tử metan có cấu trúc đơn giản với một nguyên tử cacbon ở trung tâm. Các liên kết trong phân tử này tuân theo quy luật hóa trị và góc liên kết đặc trưng. Bài viết phân tích chi tiết cấu trúc phân tử metan cùng các dạng biểu diễn phổ biến.
Công thức cấu tạo của metan
Metan là một trong những hợp chất hữu cơ đơn giản nhất. Công thức cấu tạo của metan gồm 1 nguyên tử carbon (C) liên kết với 4 nguyên tử hydro (H) theo dạng tứ diện đều.
Công thức phân tử: CH4
Trong đó:
- C: 1 nguyên tử carbon ở trung tâm
- H: 4 nguyên tử hydro ở 4 đỉnh tứ diện
Góc liên kết H-C-H trong phân tử metan là 109°28′. Các liên kết C-H có độ dài bằng nhau và bằng 0,109 nm. Đây là cấu trúc bền vững nhất của phân tử metan.
Khi tôi giảng dạy, tôi thường ví von cấu trúc metan như một chiếc ô tô 4 bánh. Nguyên tử carbon là người lái xe ngồi ở giữa, còn 4 nguyên tử hydro như 4 bánh xe ở 4 góc. Cách ví von này giúp học sinh dễ nhớ và hình dung cấu trúc không gian của metan.
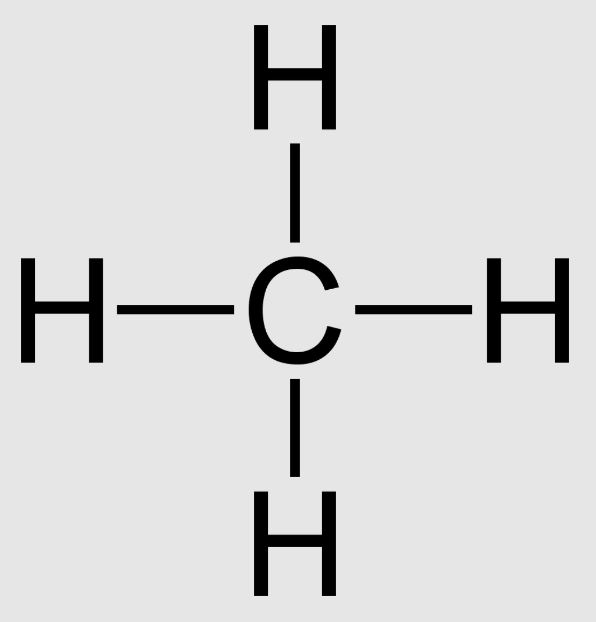
Để vẽ công thức cấu tạo metan trên giấy, ta có thể biểu diễn theo 2 cách:
- Dạng thu gọn: CH4
- Dạng đầy đủ: H-C-H với 4 liên kết C-H hướng ra 4 phía
Việc hiểu rõ cấu trúc metan là nền tảng quan trọng để học sinh nắm được các phản ứng hóa học của hydrocarbon.
Cấu tạo phân tử và đặc điểm hóa học của metan
Metan là hydrocarbon đơn giản nhất trong dãy alkane với công thức phân tử CH4. Cấu tạo phân tử metan có dạng hình học tứ diện đều, trong đó nguyên tử carbon ở trung tâm.
Phân tử metan có vai trò quan trọng trong công nghiệp hóa chất, tương tự như công thức cấu tạo của stiren và công thức của methanol được sử dụng làm nguyên liệu sản xuất nhiều hợp chất hữu cơ.
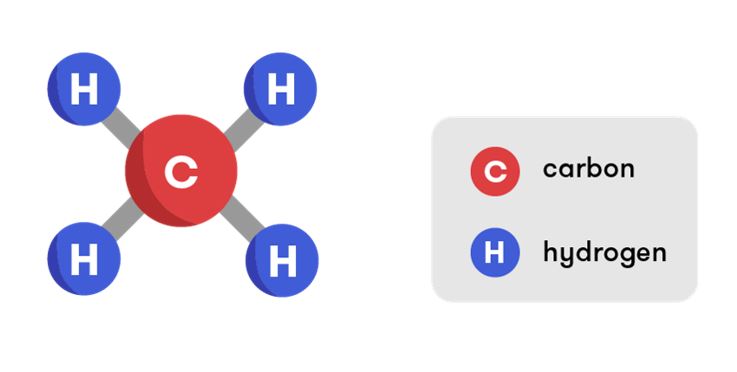
Cấu tạo phân tử metan
Trong phân tử metan, nguyên tử carbon trung tâm liên kết với 4 nguyên tử hydro theo cấu trúc tứ diện đều. Góc liên kết H-C-H là 109°28′, tạo nên cấu trúc không gian 3 chiều đặc trưng.
Khoảng cách liên kết C-H trong metan là 0,109 nm, ngắn hơn so với các alkane khác. Điều này làm cho phân tử metan rất bền vững về mặt cấu trúc.
Liên kết trong phân tử metan
Các liên kết trong metan là liên kết cộng hóa trị đơn C-H. Mỗi liên kết được hình thành khi electron hóa trị của carbon và hydro chồng lấp orbital.
Carbon sử dụng orbital lai hóa sp3 để tạo 4 liên kết đều nhau với hydro. Sự lai hóa này tạo ra góc liên kết đặc trưng và cấu trúc không gian đối xứng.
Năng lượng liên kết C-H trong metan là 435 kJ/mol, cao hơn nhiều so với các liên kết C-H thông thường khác.
Các đặc điểm hóa học cơ bản của metan
Metan là chất khí không màu, không mùi ở điều kiện thường. Nhiệt độ sôi của metan là -161,5°C và nhiệt độ nóng chảy là -182,5°C.
Do cấu trúc phân tử đối xứng cao, metan có moment lưỡng cực bằng 0. Điều này khiến metan không tan trong nước nhưng tan tốt trong dung môi không phân cực.
Metan tham gia phản ứng thế với halogen dưới tác dụng của ánh sáng hoặc nhiệt độ. Trong công nghiệp, phản ứng này được ứng dụng để sản xuất các dẫn xuất halogen của metan.
Các dạng biểu diễn công thức của metan
Metan là một trong những hợp chất hữu cơ đơn giản nhất. Nó có nhiều cách biểu diễn khác nhau để thể hiện cấu trúc phân tử.
Công thức phân tử của metan
Công thức phân tử metan là CH4, gồm 1 nguyên tử carbon liên kết với 4 nguyên tử hydro. Đây là dạng biểu diễn đơn giản nhất cho thấy thành phần nguyên tố và tỉ lệ của chúng trong phân tử.
Trong quá trình giảng dạy, tôi thường ví von CH4 như một gia đình nhỏ với “bố C” ở giữa và 4 “con H” vây quanh. Cách này giúp học sinh dễ nhớ và hứng thú hơn với môn học.
Công thức cấu tạo thu gọn
Công thức của metan dạng cấu tạo thu gọn được viết là CH3-H hoặc H-CH3. Cách viết này cho thấy rõ hơn về liên kết giữa các nguyên tử.
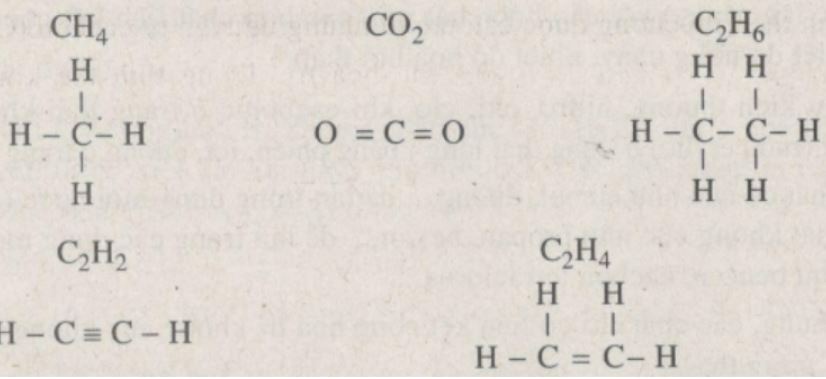
Kinh nghiệm cho thấy học sinh thường nhầm lẫn với công thức metanol. Để phân biệt, cần lưu ý metanol có thêm nhóm -OH.
Công thức electron và không gian
Công thức metan dạng electron thể hiện các electron hóa trị tham gia liên kết, với 4 cặp electron dùng chung giữa C và H.
Trong không gian, metan có dạng tứ diện đều như cấu tạo butan. Các liên kết C-H tạo góc 109°28′ với nhau, giúp phân tử ổn định nhất.
Tôi thường dùng mô hình phân tử để minh họa cấu trúc không gian. Điều này giúp học sinh hình dung rõ hơn về vị trí các nguyên tử trong phân tử.
Hướng dẫn viết công thức cấu tạo metan chi tiết
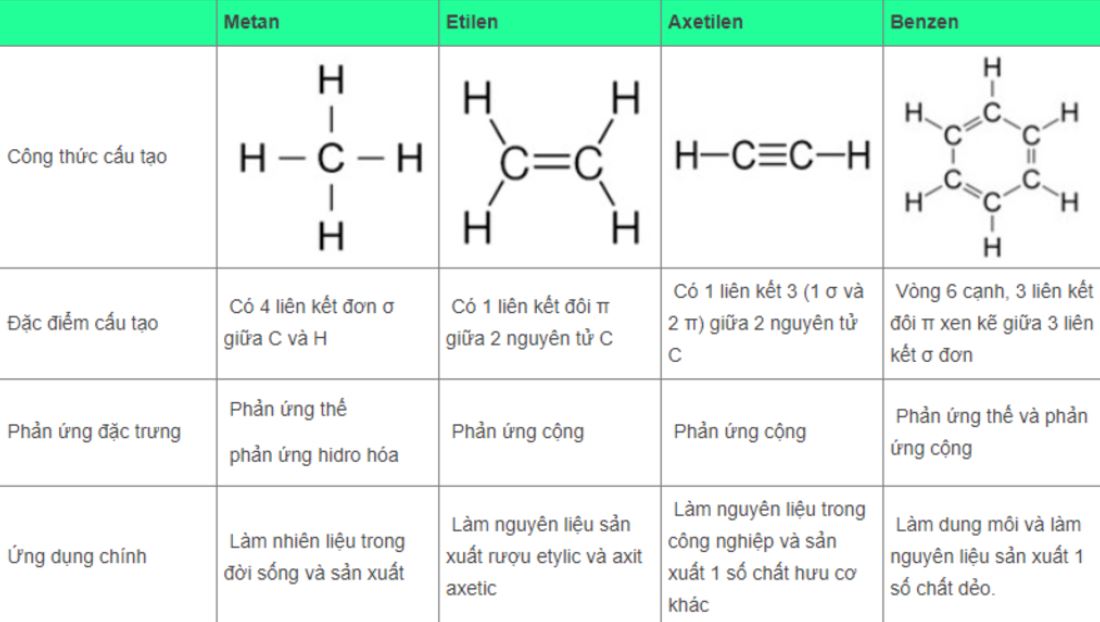
Công thức cấu tạo metan là CH4, gồm 1 nguyên tử cacbon liên kết với 4 nguyên tử hiđro. Đây là hydrocarbon đơn giản nhất trong dãy ankane.
Để viết công thức cấu tạo của metan một cách chính xác, ta cần nắm vững các quy tắc cơ bản. Tôi sẽ hướng dẫn chi tiết từng bước thực hiện.
Các bước viết công thức cấu tạo
Bước 1: Xác định nguyên tử cacbon trung tâm và vẽ thành hình vuông.
Bước 2: Từ nguyên tử C, vẽ 4 liên kết đơn theo 4 hướng vuông góc.
Bước 3: Gắn 4 nguyên tử H vào 4 đầu liên kết.
Tương tự như cách viết công thức cấu tạo của metyl fomat, ta cần đảm bảo các góc liên kết bằng nhau.
Lưu ý khi viết công thức
Khi viết công thức cấu tạo metan, cần chú ý góc giữa các liên kết là 109°28′.
Các liên kết C-H phải có độ dài bằng nhau, thể hiện sự đối xứng của phân tử.
Tương tự như công thức cấu tạo của etilen glicol, ta cần thể hiện rõ các electron hóa trị.
Bài tập thực hành
Vẽ công thức cấu tạo metan theo 2 dạng:
- Dạng thu gọn: CH4
- Dạng đầy đủ: Thể hiện rõ các liên kết đơn C-H
Kiểm tra lại các góc liên kết và độ dài liên kết có đều không.
Thực hành nhiều lần sẽ giúp ghi nhớ và vẽ nhanh, chính xác hơn.
FAQ: Câu hỏi thường gặp về công thức metan
Metan là một trong những hợp chất hữu cơ đơn giản nhất và phổ biến nhất. Công thức hóa học của metan là CH4, gồm 1 nguyên tử carbon liên kết với 4 nguyên tử hydro.
Sự khác biệt giữa các dạng công thức metan
Metan có thể được biểu diễn bằng nhiều dạng công thức khác nhau. Mỗi dạng thể hiện một khía cạnh cấu trúc riêng của phân tử.
Công thức phân tử CH4 cho biết thành phần nguyên tố và số nguyên tử. Công thức cấu tạo CH3-H thể hiện liên kết giữa nhóm metyl và hydro.
Công thức electron và công thức không gian giúp minh họa sự sắp xếp không gian của các nguyên tử. Điều này tương tự như cách metyl metacrylat có công thức là được biểu diễn.
Ứng dụng của metan trong thực tế
Metan đóng vai trò quan trọng trong nhiều lĩnh vực công nghiệp. Nó là thành phần chính của khí thiên nhiên, được sử dụng làm nhiên liệu đốt.
Trong công nghiệp hóa chất, metan là nguyên liệu sản xuất hydro và các hợp chất như công thức buta-1,3-đien. Nó cũng được dùng để sản xuất công thức cao su buna s.
Trong nông nghiệp, metan sinh ra từ quá trình phân hủy chất hữu cơ được thu gom làm khí sinh học. Công thức hoá học của metan giúp ta hiểu rõ hơn về tính chất và ứng dụng của nó.
Cách nhận biết metan
Metan là khí không màu, không mùi và nhẹ hơn không khí. Để nhận biết metan, ta có thể dựa vào phản ứng cháy đặc trưng với ngọn lửa màu xanh nhạt.
Trong phòng thí nghiệm, metan được nhận biết qua phản ứng với dung dịch brom. Phản ứng này tương tự như cách xác định công thức hoá học của ketamin.
Metan còn có thể được phát hiện bằng các thiết bị đo khí chuyên dụng. Các thiết bị này rất quan trọng trong việc đảm bảo an toàn khi làm việc với khí metan.
Kiến thức về công thức cấu tạo của metan là nền tảng quan trọng để học sinh nắm vững cấu trúc phân tử hydrocarbon đơn giản nhất. Các dạng biểu diễn công thức metan từ phân tử đến không gian giúp học sinh hình dung rõ cấu trúc phân tử và liên kết hóa học. Với hướng dẫn chi tiết về cách viết công thức và các bài tập thực hành, học sinh có thể áp dụng kiến thức vào giải quyết các bài toán hóa học cơ bản.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

