Phân tích công thức cấu tạo của HNO2 và các tính chất quan trọng
Công thức cấu tạo của HNO2 thể hiện đầy đủ các liên kết hóa học trong phân tử axit nitơ. Phân tử này có cấu trúc đặc biệt với góc liên kết và sự phân bố electron độc đáo. Các tính chất vật lý, hóa học của HNO2 đóng vai trò quan trọng trong nhiều ứng dụng thực tế.
Công thức cấu tạo của HNO2
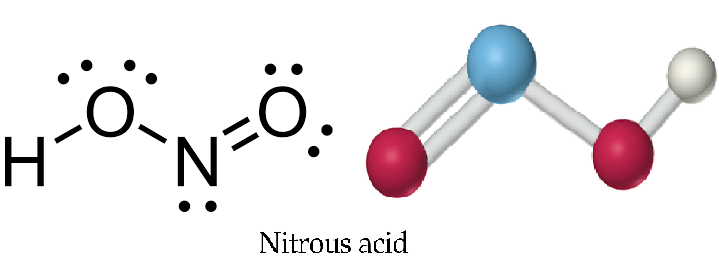
Axit nitrơ HNO2 có công thức cấu tạo của HNO2 dạng góc với nguyên tử N ở trung tâm. Cấu trúc phân tử này rất đặc biệt và thường gây khó khăn cho học sinh khi vẽ.
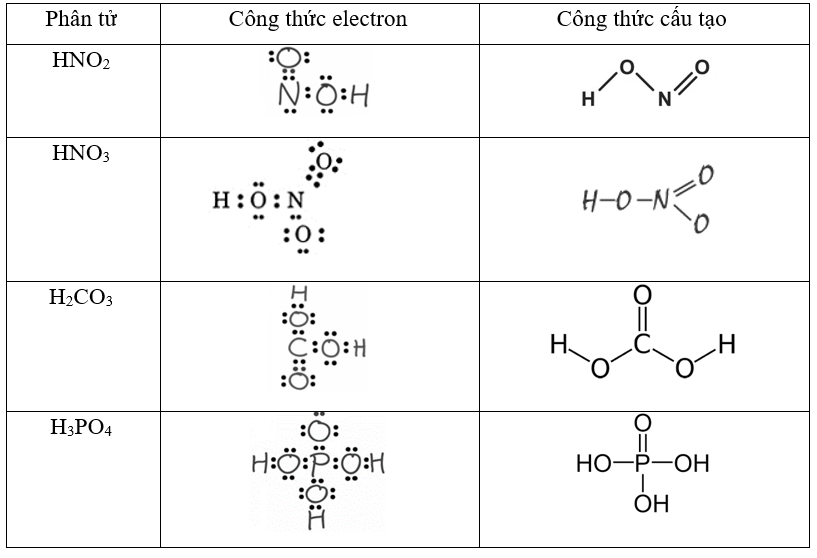
Công thức cấu tạo của HNO2 được biểu diễn như sau:
O=N-O-H
Trong đó:
- Nguyên tử N liên kết với 2 nguyên tử O và 1 nguyên tử H
- Một liên kết đôi N=O
- Một liên kết đơn N-O
- Một liên kết đơn O-H
Qua 20 năm giảng dạy, tôi thường hướng dẫn học sinh vẽ theo 3 bước đơn giản:
- Vẽ nguyên tử N ở giữa
- Vẽ liên kết đôi với O bên trái
- Vẽ nhóm -OH bên phải
Cấu trúc góc này giúp phân tử HNO2 có độ phân cực cao và tính axit trung bình. Đây là một trong những axit yếu phổ biến mà các em thường gặp trong chương trình hóa học phổ thông.
Cấu tạo phân tử và liên kết trong HNO2
Axit nitrơ HNO2 là một phân tử có cấu trúc phẳng với nguyên tử N ở trung tâm. Cấu tạo phân tử HNO2 gồm 1 liên kết N-H, 1 liên kết đơn N-O và 1 liên kết đôi N=O.
Tương tự như công thức cấu tạo SO2, phân tử HNO2 có các liên kết cộng hóa trị phân cực. Các liên kết này hình thành do sự chênh lệch độ âm điện giữa các nguyên tử.
Liên kết trong HNO2 được tạo nên bởi sự xen phủ các orbital nguyên tử. Liên kết N=O hình thành từ 1 liên kết σ và 1 liên kết π, trong khi N-O và N-H là các liên kết σ đơn.
Cấu hình electron của HNO2
Nguyên tử N trong phân tử có cấu hình electron là [He]2s22p3. Khi tham gia liên kết, N sử dụng 3 electron hóa trị để tạo liên kết với H và 2 nguyên tử O.
Cấu hình electron HNO2 cho thấy nguyên tử N có 1 cặp electron tự do không tham gia liên kết. Điều này ảnh hưởng đến hình dạng không gian của phân tử, tương tự như liên kết trong NH3.
Số cặp electron và góc liên kết trong HNO2
HNO2 có mấy cặp electron là câu hỏi quan trọng để xác định hình học phân tử. Phân tử có tổng cộng 4 cặp electron, gồm 3 cặp liên kết và 1 cặp tự do.
Góc liên kết HNO2 bị ảnh hưởng bởi lực đẩy giữa các cặp electron. Góc O-N-O xấp xỉ 120° do lực đẩy của liên kết đôi N=O, trong khi góc H-N-O nhỏ hơn do ảnh hưởng của cặp electron tự do.
Dạng hình học của phân tử HNO2
Phân tử HNO2 có dạng hình phẳng tam giác méo. Sự méo này do ảnh hưởng của cặp electron tự do trên nguyên tử N và liên kết đôi N=O.
Dạng hình học này giúp giảm thiểu lực đẩy giữa các cặp electron, tạo nên cấu trúc bền vững nhất cho phân tử. Các góc liên kết không bằng nhau do sự phân bố không đều của mật độ electron.
Công thức electron và cấu trúc Lewis của HNO2
Axit nitrơ HNO2 có công thức electron HNO2 khá đặc biệt với 1 nguyên tử H, 1 nguyên tử N và 2 nguyên tử O. Cấu trúc Lewis của nó thể hiện rõ sự phân bố electron và liên kết giữa các nguyên tử.
Tương tự như công thức electron của h2co3, cấu trúc Lewis của HNO2 có các electron hóa trị được biểu diễn bằng các chấm xung quanh nguyên tử. Mỗi nguyên tử O có 6 electron hóa trị, N có 5 electron và H có 1 electron.
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh thường nhầm lẫn cấu trúc này với cấu tạo phân tử h2so4. Để phân biệt, cần nhớ HNO2 chỉ có 1 nguyên tử H.
Phân bố electron trong phân tử HNO2
Trong phân tử HNO2, electron được phân bố không đều giữa các nguyên tử. Nguyên tử N ở trung tâm liên kết với 1 nguyên tử H và 2 nguyên tử O.
Nguyên tử O thứ nhất liên kết đơn với N và mang điện âm một phần do có 2 cặp electron tự do. Nguyên tử O thứ hai tạo liên kết đôi với N và cũng có 2 cặp electron tự do.
Các kiểu liên kết trong HNO2
Phân tử HNO2 có cả liên kết cộng hóa trị phân cực và không phân cực. Liên kết N-H là liên kết cộng hóa trị phân cực do độ âm điện của N lớn hơn H.
Liên kết N-O đơn có tính phân cực do độ âm điện của O lớn hơn N. Liên kết đôi N=O có tính chất cộng hóa trị không phân cực do sự chia sẻ electron đều giữa hai nguyên tử.
Sự kết hợp các kiểu liên kết khác nhau tạo nên tính chất axit của HNO2. Đây là điểm quan trọng giúp học sinh hiểu được bản chất hóa học của hợp chất này.
Tính chất và ứng dụng của axit nitơ HNO2
Axit nitơ HNO2 là một axit yếu, không bền trong điều kiện thường. Nó có cấu tạo gồm một nguyên tử N liên kết với một nhóm OH và một nguyên tử O. Tương tự như công thức cấu tạo của n2o5, axit nitơ HNO2 có cấu trúc phân tử đặc trưng.
Tính chất vật lý của HNO2
Ở nhiệt độ phòng, HNO2 tồn tại ở dạng chất lỏng không màu. Nó có mùi hắc đặc trưng và dễ tan trong nước. Giống như công thức cấu tạo của h2o2, HNO2 không bền và dễ phân hủy khi tiếp xúc với ánh sáng.
Điểm nóng chảy của HNO2 là -17°C và điểm sôi khoảng 20°C. Do đó, chất này thường được bảo quản ở dạng dung dịch loãng trong phòng thí nghiệm.
Tính chất hóa học của HNO2
HNO2 có tính chất gì đặc trưng? Đầu tiên, nó là một axit yếu với hằng số phân ly Ka = 4,5 × 10-4. Trong dung dịch nước, HNO2 phân ly theo phương trình:
HNO2 + H2O ⇌ H3O+ + NO2-
HNO2 có tính oxi hóa mạnh, tương tự như công thức cấu tạo của p2o5. Nó có thể oxi hóa nhiều kim loại và phi kim trong điều kiện thích hợp.
Ứng dụng của HNO2 trong thực tế
HNO2 được sử dụng rộng rãi trong công nghiệp hóa chất. Nó là chất trung gian quan trọng trong sản xuất muối nitrit và các hợp chất hữu cơ chứa nhóm -NO2.
Trong phòng thí nghiệm, HNO2 thường được dùng làm tác nhân nitro hóa. Nó có khả năng chuyển hóa các amin thơm thành muối diazonium – một trung gian quan trọng trong tổng hợp hữu cơ.
Ngoài ra, HNO2 còn được ứng dụng trong công nghiệp nhuộm vải và sản xuất thuốc nhuộm azo. Tuy nhiên, cần thận trọng khi sử dụng do tính không bền và độc tính của nó.
FAQ: Câu hỏi thường gặp về HNO2
Axit nitơ là một chất quan trọng trong hóa học. Tôi sẽ giải đáp các thắc mắc phổ biến về hợp chất này.
HNO2 là gì và có vai trò như thế nào?
Công thức HNO2 là axit nitơ – một axit yếu không bền trong môi trường nước. Nó có cấu tạo gồm nguyên tử H liên kết với nhóm NO2.
Axit nitơ đóng vai trò quan trọng trong nhiều phản ứng hóa học. Nó là chất trung gian để sản xuất muối nitrit và các hợp chất hữu cơ.
Trong công nghiệp, HNO2 được sử dụng để tổng hợp thuốc nhuộm và chất bảo quản thực phẩm. Tôi thường lấy ví dụ về natri nitrit – chất bảo quản thịt được tạo ra từ HNO2.
Cách nhận biết HNO2 trong phòng thí nghiệm
Axit nitơ có thể được nhận biết qua phản ứng với KMnO4. Dung dịch KMnO4 tím sẽ mất màu khi tác dụng với HNO2.
Một phương pháp khác là dùng giấy quỳ tím. HNO2 làm giấy quỳ tím chuyển sang màu đỏ do tính axit của nó.
Trong quá trình giảng dạy, tôi thường cho học sinh thực hiện thí nghiệm với dung dịch KI. HNO2 sẽ oxi hóa I- thành I2 tạo màu nâu đặc trưng.
Kiến thức về công thức cấu tạo của HNO2 giúp học sinh nắm vững cấu trúc phân tử, liên kết và tính chất của axit nitơ. Phân tử HNO2 có cấu trúc góc với góc liên kết 120° và các liên kết đơn, đôi đặc trưng. Đây là một axit yếu với nhiều ứng dụng quan trọng trong công nghiệp hóa chất. Các thông tin về cấu tạo electron và tính chất của HNO2 là nền tảng để học tập tốt môn hóa học.
Bài viết liên quan
Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

