Điểm qua công thức cấu tạo của CH4 và cấu trúc phân tử metan cơ bản
Công thức cấu tạo của CH4 thể hiện cấu trúc phân tử metan với một nguyên tử carbon ở tâm. Bốn nguyên tử hydro tạo thành hình tứ diện đều xung quanh. Các liên kết đơn C-H có độ dài và góc liên kết bằng nhau. Phân tử metan có cấu trúc đối xứng cao.
Công thức cấu tạo của CH4
Methane (CH4) là một trong những hợp chất hữu cơ đơn giản nhất. Công thức cấu tạo của CH4 thể hiện rõ cách các nguyên tử liên kết với nhau.
Trong phân tử CH4, nguyên tử carbon (C) nằm ở trung tâm và tạo 4 liên kết đơn với 4 nguyên tử hydro (H). Cấu trúc không gian của CH4 có dạng tứ diện đều.
Công thức cấu tạo của CH4 có thể biểu diễn theo 2 cách:
Công thức cấu tạo phẳng:
H-C-H
|
H-H
Công thức cấu tạo không gian:
Các nguyên tử H nằm ở 4 đỉnh của một tứ diện đều, nguyên tử C nằm ở tâm. Góc giữa các liên kết C-H là 109°28′.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc CH4 như một chiếc ô có 4 cạnh đều nhau. Điều này giúp học sinh dễ hình dung và nhớ được cấu trúc không gian của phân tử.
Khi vẽ công thức cấu tạo CH4, các em cần chú ý:
- Vẽ nguyên tử C ở trung tâm
- Vẽ 4 liên kết đơn C-H theo hướng tứ diện
- Các góc liên kết phải bằng nhau
- Độ dài các liên kết C-H phải bằng nhau
Cấu tạo phân tử CH4 và các liên kết hóa học
Phân tử metan CH4 là một trong những hợp chất hữu cơ đơn giản nhất. Nó có cấu trúc đặc biệt với một nguyên tử carbon ở trung tâm và bốn nguyên tử hydro xung quanh.
Cấu trúc này tạo nên hình dạng tứ diện đều, giúp phân tử có độ đối xứng cao và ổn định. Các liên kết trong phân tử đóng vai trò quan trọng trong việc xác định tính chất hóa học của metan.
Cấu tạo phân tử metan CH4
Cấu tạo phân tử metan gồm một nguyên tử carbon sp3 ở trung tâm liên kết với 4 nguyên tử hydro. Mỗi nguyên tử hydro đều nằm ở 4 đỉnh của một hình tứ diện đều.
Trong quá trình giảng dạy, tôi thường ví von cấu trúc này như một chiếc ô có 4 cạnh đều nhau. Điều này giúp học sinh dễ hình dung và nhớ lâu hơn.
Cấu trúc này tương tự như công thức cấu tạo của c4h10 nhưng đơn giản hơn nhiều.
Các liên kết trong phân tử CH4
Liên kết trong CH4 là kiểu liên kết cộng hóa trị đơn C-H. Mỗi liên kết được hình thành từ sự xen phủ orbital sp3 của carbon với orbital 1s của hydro.
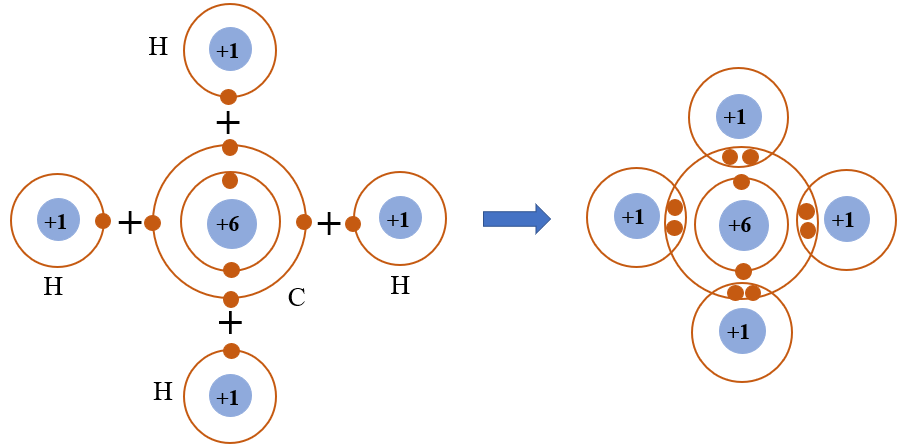
Độ dài liên kết C-H trong metan là 0,109 nm và năng lượng liên kết là 413 kJ/mol. Các giá trị này tương đương với những phân tử tương tự như công thức cấu tạo ch3cl.
Bốn liên kết C-H có độ dài và năng lượng bằng nhau, tạo nên sự cân bằng hoàn hảo cho phân tử.
Góc liên kết trong CH4
Góc liên kết CH4 là 109°28′, đây là góc tứ diện chuẩn. Giá trị này được xác định bởi sự sắp xếp không gian của các orbital lai hóa sp3.
Góc này giúp các nguyên tử hydro nằm càng xa nhau càng tốt, giảm thiểu lực đẩy tĩnh điện. Đây là lý do khiến metan có cấu trúc bền vững.
Trong thực tế giảng dạy, tôi thường dùng mô hình phân tử để minh họa góc này. Học sinh có thể tự tay đo đạc và kiểm chứng.
Cấu trúc không gian và hình dạng phân tử CH4
Phân tử CH4 (metan) có cấu trúc không gian CH4 đặc trưng với một nguyên tử carbon ở trung tâm. Nguyên tử carbon này liên kết với 4 nguyên tử hydro theo cấu trúc hình học đặc biệt.
Để hiểu rõ hơn về cấu trúc này, bạn có thể tham khảo cách viết công thức cấu tạo c4h8 với các liên kết tương tự.
Cấu trúc không gian của CH4
Trong phân tử CH4, nguyên tử carbon trung tâm có 4 electron hóa trị. Mỗi electron này tham gia liên kết với 1 nguyên tử hydro tạo thành liên kết cộng hóa trị.
Các orbital lai hóa sp3 của carbon hướng về 4 đỉnh của một tứ diện đều. Góc giữa các liên kết C-H là 109°28′, tạo nên cấu trúc 3D đặc trưng.
Độ dài liên kết C-H trong phân tử CH4 là 1.09Å. Đây là khoảng cách tối ưu giúp phân tử đạt trạng thái bền vững nhất.
Hình dạng tứ diện đều của phân tử CH4
Hình dạng phân tử CH4 là một tứ diện đều hoàn hảo. Nguyên tử carbon nằm ở tâm của tứ diện.
Bốn nguyên tử hydro định vị tại 4 đỉnh của tứ diện. Khoảng cách từ mỗi nguyên tử H đến nguyên tử C trung tâm bằng nhau.
Cấu trúc tứ diện đều này giúp phân tử CH4 có tính đối xứng cao. Điều này giải thích cho nhiều tính chất vật lý và hóa học đặc trưng của metan.
Cấu hình electron và lai hóa trong phân tử CH4
Phân tử CH4 có cấu trúc hình học tứ diện đều. Điều đặc biệt là cấu hình electron CH4 được hình thành từ quá trình lai hóa sp3 của nguyên tử carbon trung tâm.
Để hiểu rõ hơn về cấu trúc phân tử metan, chúng ta cần phân tích sự phân bố electron và quá trình lai hóa. Tương tự như h2so4 đặc hay loãng, cấu trúc CH4 cũng tuân theo quy luật bát tử.
Sự phân bố electron trong CH4
Nguyên tử carbon có cấu hình electron lớp ngoài cùng là 2s22p2. Trong đó orbital 2s chứa 2 electron và 2 electron còn lại phân bố ở 2 orbital 2p.
Khi tạo liên kết với hydro, carbon phải tạo ra 4 orbital lai hóa tương đương. Quá trình này giống với sự hình thành liên kết trong công thức cấu tạo của n2h4.
Mỗi orbital lai hóa của carbon sẽ chứa 1 electron độc thân. Các electron này sẽ tạo liên kết với 4 nguyên tử hydro theo cấu trúc tứ diện đều.
Quá trình lai hóa sp3 của nguyên tử carbon
Orbital 2s và ba orbital 2p của carbon kết hợp tạo thành 4 orbital lai hóa sp3. Quá trình lai hóa CH4 diễn ra theo các bước:
Bước 1: Một electron từ orbital 2s được kích thích lên orbital 2p trống.
Bước 2: Orbital 2s và ba orbital 2p lai hóa tạo thành 4 orbital sp3 tương đương.
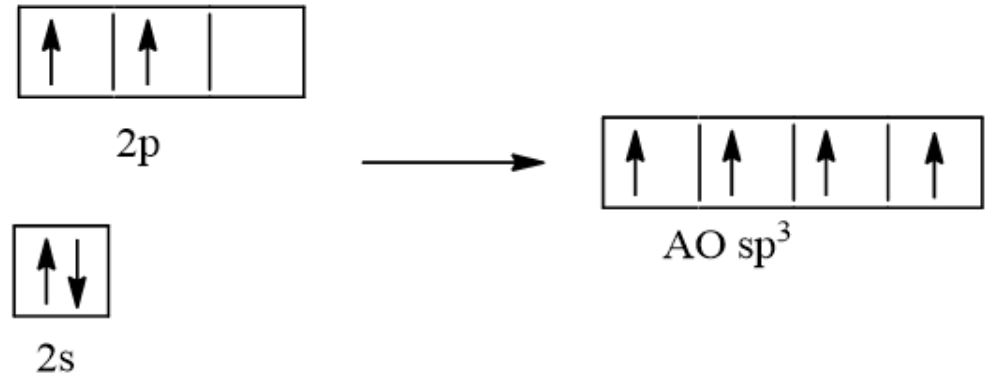
Bước 3: Bốn orbital sp3 định hướng trong không gian theo hình tứ diện đều với góc liên kết 109°28′.
Kết quả là phân tử CH4 có cấu trúc đối xứng cao với 4 liên kết C-H tương đương. Đây là cơ sở để giải thích nhiều tính chất hóa học của metan.
Cách vẽ mô hình phân tử CH4 đơn giản và chính xác
Vẽ mô hình phân tử CH4 là kỹ năng quan trọng giúp học sinh hiểu rõ cấu trúc không gian của phân tử metan. Tôi sẽ hướng dẫn chi tiết cách vẽ đơn giản và chính xác nhất.
Phân tử CH4 có cấu trúc tứ diện đều, tương tự như công thức cấu tạo của ch3oh. Nguyên tử carbon nằm ở tâm và 4 nguyên tử hydro ở 4 đỉnh tứ diện.
Góc liên kết giữa các nguyên tử H-C-H là 109°28′, tạo nên hình dạng đối xứng hoàn hảo giống như công thức cấu tạo của nh4cl.
Các bước vẽ mô hình phân tử CH4
Bước 1: Vẽ nguyên tử carbon ở tâm bằng một chấm đen hoặc vòng tròn nhỏ.
Bước 2: Từ tâm C, vẽ 4 đoạn thẳng hướng ra 4 góc tứ diện với góc 109°28′.
Bước 3: Ở đầu mỗi đoạn thẳng, vẽ nguyên tử hydro bằng chấm tròn nhỏ hơn carbon.
Bước 4: Thể hiện liên kết đơn C-H bằng đoạn thẳng nối giữa C và H.
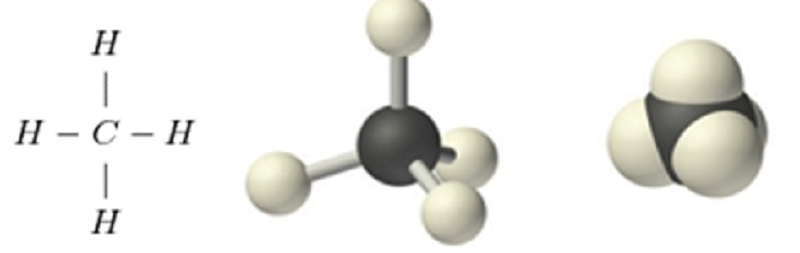
Lưu ý khi vẽ mô hình phân tử CH4
Khi vẽ trên mặt phẳng giấy 2D, cần thể hiện độ sâu của cấu trúc 3D bằng các nét vẽ khác nhau. Nét liền thể hiện liên kết nằm trên mặt phẳng.
Nét đứt thể hiện liên kết hướng ra phía sau mặt phẳng. Nét tam giác thể hiện liên kết hướng về phía trước mặt phẳng.
Độ dài các liên kết C-H phải bằng nhau vì đây là cấu trúc đối xứng. Góc giữa các liên kết cũng phải chính xác 109°28′ để đảm bảo tính đúng đắn của mô hình.
FAQ: Câu hỏi thường gặp về công thức cấu tạo CH4
Phân tử CH4 có cấu trúc đặc biệt và nhiều điểm thú vị. Tôi sẽ giải đáp các thắc mắc phổ biến về công thức cấu tạo CH4 mà học sinh thường gặp phải.
Tại sao CH4 có dạng hình học tứ diện?
Cấu trúc tứ diện của CH4 là kết quả của sự lai hóa sp3. Nguyên tử carbon trung tâm có 4 orbital lai hóa sp3 hướng về 4 đỉnh của một tứ diện đều.
Góc giữa các liên kết C-H là 109°28′, tạo ra cấu trúc bền vững nhất. Điều này giúp giảm lực đẩy tĩnh điện giữa các nguyên tử H.
Các liên kết trong CH4 có độ dài bằng nhau không?
Tất cả các liên kết C-H trong phân tử metan đều có độ dài bằng nhau, khoảng 1.09Å. Điều này là do 4 orbital lai hóa sp3 hoàn toàn tương đương nhau.
Mỗi orbital sp3 tạo liên kết σ với orbital 1s của nguyên tử H. Năng lượng liên kết C-H trong CH4 là 413 kJ/mol.
Vì sao CH4 là phân tử không phân cực?
CH4 là phân tử không phân cực do tính đối xứng cao của cấu trúc tứ diện. Các moment lưỡng cực của 4 liên kết C-H triệt tiêu lẫn nhau.
Độ âm điện của C (2.5) và H (2.1) khá gần nhau. Sự phân bố điện tích trong phân tử khá đồng đều.
Cấu trúc đối xứng và sự phân bố điện tích đồng đều khiến viết công thức cấu tạo của ch4 luôn thể hiện tính không phân cực của phân tử.
Phân tử metan với công thức cấu tạo của CH4 thể hiện cấu trúc không gian tứ diện đều hoàn hảo. Các liên kết C-H có độ dài bằng nhau và góc liên kết 109,5° tạo nên sự đối xứng. Quá trình lai hóa sp3 của nguyên tử carbon trung tâm và sự phân bố đều của các electron hóa trị giải thích cho tính chất hóa học đặc trưng của metan. Mô hình phân tử CH4 đơn giản giúp học sinh dễ dàng nắm bắt và vận dụng kiến thức cơ bản này.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

