Tìm hiểu công thức cấu tạo của CH3Cl và đặc điểm cấu trúc phân tử
Công thức cấu tạo của CH3Cl thể hiện đặc điểm cấu trúc không gian của phân tử methyl clorua. Phân tử này có cấu trúc hình tứ diện với nguyên tử carbon ở tâm. Các liên kết trong phân tử tạo nên tính phân cực đặc trưng và ứng dụng quan trọng trong công nghiệp hóa chất.
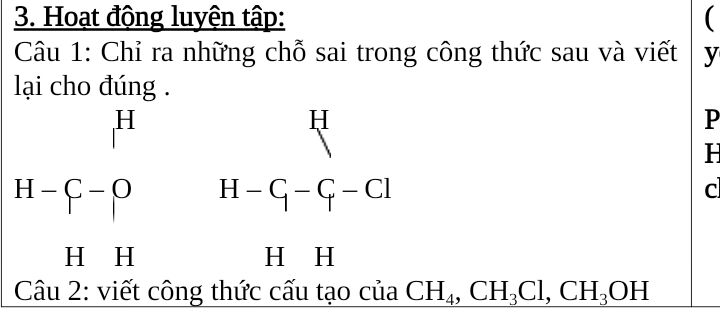
Công thức cấu tạo của CH3Cl
Công thức cấu tạo của CH3Cl là một phân tử methyl clorua với cấu trúc không gian hình tứ diện. Nguyên tử carbon ở trung tâm liên kết với 3 nguyên tử hydro và 1 nguyên tử clo.
Cấu trúc phân tử CH3Cl có thể được biểu diễn bằng công thức:
H
|
H-C-Cl
|
H
Trong đó:
- Nguyên tử C nằm ở trung tâm
- 3 nguyên tử H tạo thành góc 109°28′ với nhau
- Nguyên tử Cl tạo góc 109°28′ với các liên kết C-H
Từ kinh nghiệm giảng dạy, tôi thường ví von cấu trúc này như một chiếc ô 3 cạnh, với cán ô là liên kết C-Cl. Cách hình dung này giúp học sinh dễ nhớ và hiểu rõ hơn về hình học không gian của phân tử.
Các liên kết trong phân tử CH3Cl đều là liên kết cộng hóa trị đơn. Liên kết C-Cl có độ dài 1.78Å, dài hơn so với liên kết C-H (1.09Å) do nguyên tử Cl có kích thước lớn hơn H.
Cấu tạo phân tử CH3Cl và các liên kết hóa học
Phân tử CH3Cl có cấu tạo khá đơn giản nhưng rất quan trọng trong hóa học hữu cơ. Tôi sẽ phân tích chi tiết từng thành phần để các em dễ hiểu hơn.
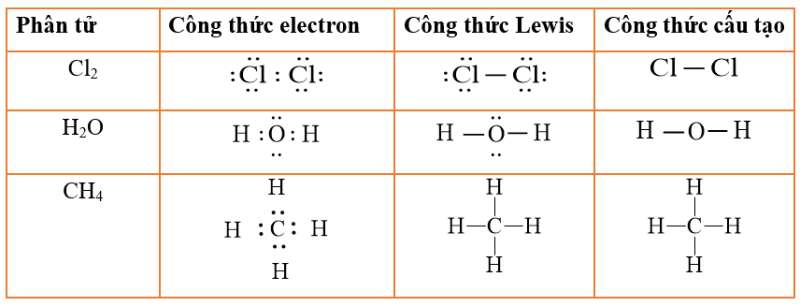
Các nguyên tử trong phân tử CH3Cl
Phân tử CH3Cl bao gồm 1 nguyên tử cacbon (C), 3 nguyên tử hydro (H) và 1 nguyên tử clo (Cl). Cấu hình electron của các nguyên tử này khá tương đồng với công thức cấu tạo CH4.
Nguyên tử cacbon đóng vai trò trung tâm với 4 electron hóa trị. Ba electron tham gia liên kết với hydro và một electron liên kết với clo.
Liên kết trong phân tử CH3Cl
Cấu tạo phân tử CH3Cl được hình thành từ hai loại liên kết cộng hóa trị. Liên kết C-H là liên kết cộng hóa trị không phân cực.
Liên kết C-Cl là liên kết cộng hóa trị phân cực do độ âm điện của clo lớn hơn cacbon. Điều này tạo nên tính phân cực của phân tử.
Hình dạng phân tử CH3Cl
Liên kết trong CH3Cl tạo nên cấu trúc hình tứ diện méo. Ba liên kết C-H nằm trên một mặt phẳng, tạo góc 120° với nhau.
Hình dạng phân tử CH3Cl có liên kết C-Cl vuông góc với mặt phẳng chứa ba liên kết C-H. Góc liên kết H-C-Cl xấp xỉ 109.5°.
Kinh nghiệm giảng dạy cho thấy việc vẽ mô hình phân tử bằng bút màu sẽ giúp học sinh dễ nhớ cấu trúc không gian của CH3Cl.
Đặc điểm cấu trúc electron và lai hóa của CH3Cl
Phân tử CH3Cl có cấu trúc electron và lai hóa đặc trưng quyết định tính chất hóa học của nó. Cấu trúc này được xác định bởi sự phân bố electron hóa trị và kiểu lai hóa của các orbital nguyên tử.
Electron hóa trị và orbital phân tử
Electron hóa trị CH3Cl bao gồm 7 electron từ nguyên tử C và Cl tham gia liên kết. Nguyên tử carbon đóng góp 4 electron hóa trị, trong khi nguyên tử clo đóng góp 1 electron.

Orbital phân tử được hình thành từ sự xen phủ các orbital nguyên tử 2s, 2p của carbon và 3p của clo. Sự xen phủ này tạo ra các orbital phân tử có năng lượng thấp hơn orbital nguyên tử ban đầu.
Sự lai hóa trong phân tử CH3Cl
Lai hóa CH3Cl xảy ra khi orbital 2s và ba orbital 2p của carbon kết hợp tạo thành 4 orbital lai hóa sp3. Quá trình này giúp carbon có thể tạo được 4 liên kết cộng hóa trị với các nguyên tử khác.
Trong phân tử CH3Cl, các công thức cấu tạo của ch3oh cho thấy 3 orbital sp3 tham gia liên kết với hydro và 1 orbital sp3 liên kết với clo. Sự lai hóa sp3 tạo ra cấu trúc hình tứ diện đều.
Góc liên kết trong phân tử
Góc liên kết CH3Cl có giá trị xấp xỉ 109.5° giữa các liên kết C-H và C-Cl. Góc này là kết quả của sự sắp xếp không gian của 4 orbital lai hóa sp3 theo hình tứ diện.
Tuy nhiên, do nguyên tử Cl có kích thước lớn hơn H nên góc liên kết thực tế sẽ bị biến dạng nhẹ. Các góc H-C-H vẫn gần với 109.5° trong khi góc H-C-Cl có xu hướng nhỏ hơn một chút.
Tính chất phân cực và ứng dụng của CH3Cl
Phân tử CH3Cl có cấu trúc phân tử đặc biệt tạo nên tính phân cực độc đáo. Tương tự như công thức cấu tạo NH3, CH3Cl có sự phân bố điện tích không đều trong phân tử.
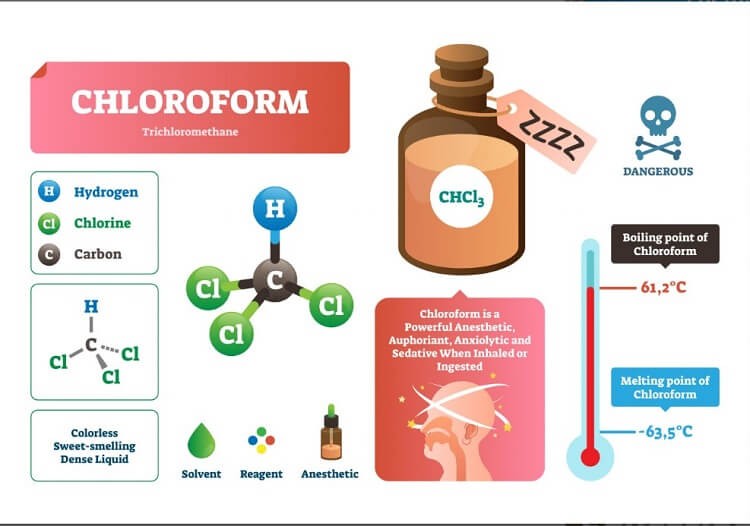
Cấu trúc này khác biệt so với công thức cấu tạo so3 do sự hiện diện của liên kết C-Cl có tính phân cực mạnh.
Độ phân cực của phân tử CH3Cl
Độ phân cực CH3Cl phụ thuộc vào sự chênh lệch độ âm điện giữa C và Cl. Nguyên tử Cl có độ âm điện 3,0 trong khi C có độ âm điện 2,5.
Moment lưỡng cực của CH3Cl được tính theo công thức:
μ = q × r
Trong đó:
- μ: moment lưỡng cực
- q: điện tích
- r: khoảng cách giữa các điện tích
Giá trị moment lưỡng cực của CH3Cl là 1,87 D, cho thấy đây là phân tử phân cực trung bình.
Các ứng dụng trong thực tế
Công thức cấu tạo của ch3cl đã giúp các nhà khoa học hiểu rõ về tính chất và ứng dụng của nó. CH3Cl được sử dụng rộng rãi trong công nghiệp hóa chất.
Trong ngành sản xuất silicon, CH3Cl là nguyên liệu quan trọng để tổng hợp các hợp chất silicone. Theo số liệu từ Hiệp hội Hóa chất Mỹ, khoảng 90% CH3Cl được dùng cho mục đích này.
CH3Cl còn được ứng dụng làm dung môi trong các phản ứng hữu cơ. Tuy nhiên, việc sử dụng cần tuân thủ nghiêm ngặt các quy định an toàn do tính độc của nó.
FAQ: Câu hỏi thường gặp về CH3Cl
Phân tử CH3Cl có nhiều đặc điểm thú vị và thường xuất hiện trong các câu hỏi của học sinh. Tôi sẽ giải đáp một số thắc mắc phổ biến về hợp chất này.
Sự khác biệt giữa CH3Cl và các halogen hữu cơ khác
CH3Cl có cấu trúc đơn giản hơn so với các halogen hữu cơ khác. Nó chỉ chứa một nguyên tử Cl liên kết với nhóm methyl.
Điểm nổi bật là khả năng phản ứng thế nucleophil của CH3Cl diễn ra nhanh hơn. Nguyên nhân do liên kết C-Cl ngắn và yếu hơn các liên kết C-Br hay C-I.
So với các dẫn xuất halogen phức tạp như cấu tạo buta-1,3-đien, CH3Cl có tính đối xứng cao hơn. Điều này ảnh hưởng đến tính chất vật lý và hóa học của nó.
Tại sao CH3Cl có tính phân cực?
Tính phân cực của CH3Cl xuất phát từ sự chênh lệch độ âm điện. Nguyên tử Cl có độ âm điện lớn hơn C và H.
Khi liên kết với C, Cl kéo electron về phía mình. Hiện tượng này tạo ra một đầu âm (gần Cl) và một đầu dương (gần CH3).
Cấu trúc này tương tự như trong NH4Cl là gì, tạo nên moment lưỡng cực làm cho phân tử có tính phân cực.
Cách xác định hình dạng phân tử CH3Cl
Hình dạng của CH3Cl được xác định dựa trên lý thuyết VSEPR. Nguyên tử C trung tâm có 4 cặp electron liên kết.
Các cặp electron này đẩy nhau để đạt khoảng cách xa nhất. Kết quả tạo thành hình tứ diện đều.
Ba nguyên tử H và một nguyên tử Cl nằm ở 4 đỉnh của tứ diện. Góc liên kết H-C-H và H-C-Cl xấp xỉ 109.5°.
Kiến thức về công thức cấu tạo của CH3Cl giúp học sinh nắm vững cấu trúc phân tử methyl clorua. Phân tử này có dạng tứ diện với nguyên tử carbon ở tâm, tạo liên kết với 3 nguyên tử hydro và 1 nguyên tử clo. Sự lai hóa sp3 của carbon cùng với góc liên kết 109,5° tạo nên tính phân cực đặc trưng. Đây là kiến thức nền tảng để học sinh tiếp cận các hợp chất hữu cơ phức tạp hơn.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

