Nắm kỹ công thức canxi cacbonat và các tính chất quan trọng CaCO3
Công thức canxi cacbonat là kiến thức nền tảng trong chương trình hóa học phổ thông. Hợp chất này tồn tại phổ biến trong tự nhiên dưới dạng đá vôi, đá phấn. Nó đóng vai trò quan trọng trong nhiều ngành công nghiệp và đời sống hàng ngày. Chúng ta hãy cùng tìm hiểu chi tiết về cấu tạo, tính chất và ứng dụng của hợp chất này.
Công thức canxi cacbonat và cấu tạo phân tử
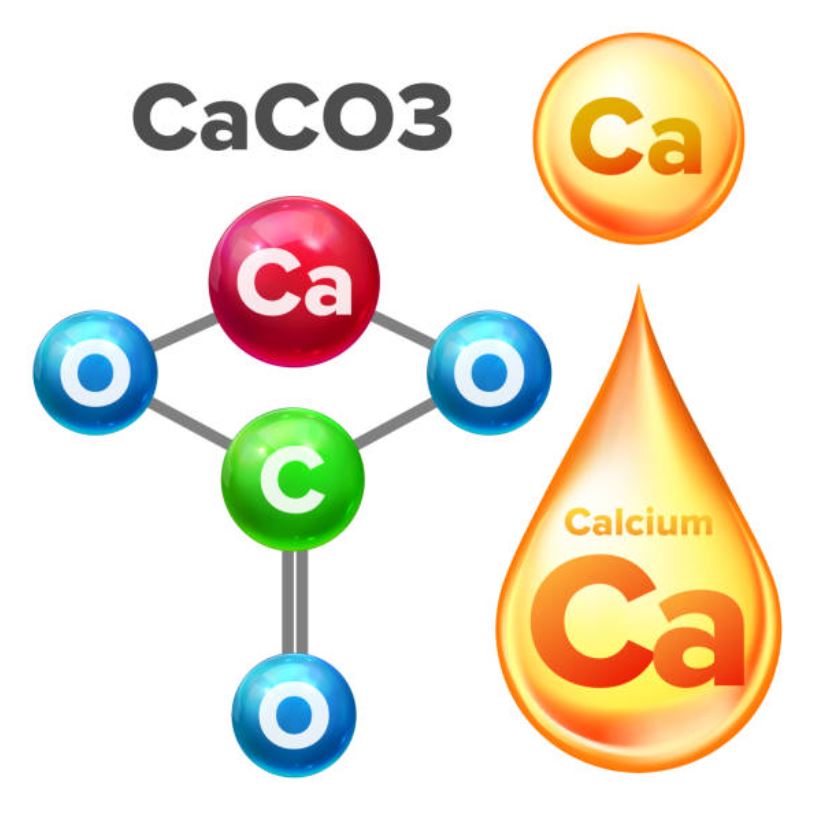
Công thức canxi cacbonat là CaCO3. Đây là một hợp chất vô cơ phổ biến trong tự nhiên, tồi tại dưới dạng đá vôi, đá phấn và đá cẩm thạch.
Về cấu tạo phân tử, CaCO3 gồm một ion Ca2+ liên kết với một ion CO32-. Ion cacbonat CO32- có cấu trúc phẳng tam giác với nguyên tử cacbon ở tâm và 3 nguyên tử oxi ở 3 đỉnh.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ cấu tạo phân tử CaCO3 bằng cách liên tưởng đến hình dáng chiếc bánh pizza tam giác. Phần đế bánh chính là ion CO32-, còn phần nhân Ca2+ nằm phía trên.
CaCO3 là một chất rắn màu trắng, không tan trong nước. Khi nung nóng ở nhiệt độ cao, nó phân hủy thành canxi oxit (CaO) và khí cacbon đioxit (CO2) theo phương trình:
CaCO3 → CaO + CO2
Đây là phản ứng nhiệt phân quan trọng trong công nghiệp sản xuất vôi sống. Tôi thường nhấn mạnh với học sinh rằng phản ứng này chỉ xảy ra ở nhiệt độ trên 825°C.
Tính chất vật lý và hóa học của canxi cacbonat
Canxi cacbonat là một hợp chất vô cơ quan trọng trong tự nhiên và công nghiệp. Chất này tồn tại phổ biến dưới dạng đá vôi, đá phấn và đá cẩm thạch. Việc nắm vững các tính chất của nó giúp ứng dụng hiệu quả trong thực tế.
Tính chất vật lý đặc trưng của CaCO3
Canxi cacbonat tính chất vật lý nổi bật là chất rắn màu trắng, không mùi. Hợp chất này có cấu trúc tinh thể đặc trưng với 3 dạng thù hình: calcite, aragonite và vaterite.

Điểm nóng chảy của CaCO3 là 825°C, khối lượng riêng 2,71 g/cm3. Chất này không tan trong nước tinh khiết nhưng tan được trong nước có chứa CO2.
Trong tự nhiên, CaCO3 thường tồn tại dưới dạng công thức đá bọt với cấu trúc xốp đặc biệt. Đây là kết quả của quá trình phong hóa tự nhiên kéo dài.
Các phản ứng hóa học quan trọng của canxi cacbonat
Canxi cacbonat phản ứng mạnh với axit tạo muối canxi tương ứng, giải phóng khí CO2:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Phản ứng này được ứng dụng để nhận biết đá vôi trong phòng thí nghiệm. Khi nhỏ dung dịch axit lên mẫu đá vôi sẽ thấy sủi bọt khí CO2.
Ngoài ra, CaCO3 còn tham gia phản ứng trao đổi với các muối khác. Ví dụ phản ứng với Na2CO3 tạo CaCO3 kết tủa:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Sự phân hủy nhiệt của CaCO3
Canxi cacbonat hóa học phân hủy ở nhiệt độ cao theo phương trình:
CaCO3 → CaO + CO2↑ (t° > 825°C)
Quá trình này đóng vai trò quan trọng trong công nghiệp sản xuất vôi sống. Sản phẩm CaO được ứng dụng rộng rãi trong xây dựng và sản xuất.
Phản ứng phân hủy nhiệt có tính thuận nghịch. Khi nhiệt độ giảm xuống, CaO có thể tái hợp với CO2 tạo lại CaCO3.
Phương pháp điều chế và sản xuất canxi cacbonat trong công nghiệp
Canxi cacbonat là hợp chất vô cơ quan trọng trong công nghiệp hóa chất. Việc sản xuất canxi cacbonat công nghiệp đòi hỏi quy trình chặt chẽ và kiểm soát chất lượng nghiêm ngặt.
Trong quá trình giảng dạy, tôi thường giải thích cho sinh viên rằng canxi cacbonat có thể được điều chế bằng nhiều phương pháp khác nhau. Mỗi phương pháp có những ưu nhược điểm riêng và phù hợp với các mục đích sử dụng khác nhau.
Canxi cacbonat thường được sản xuất từ đá vôi tự nhiên hoặc tổng hợp trong phòng thí nghiệm. Quá trình này có liên quan mật thiết đến công thức của natri cacbonat trong một số phương pháp điều chế.

Quy trình sản xuất CaCO3 từ đá vôi
Đá vôi tự nhiên được khai thác và nghiền nhỏ thành bột mịn. Quá trình này cần được thực hiện cẩn thận để đảm bảo kích thước hạt đồng đều.
Sau đó, đá vôi được nung ở nhiệt độ cao (900-1000°C) để tạo thành vôi sống (CaO):
CaCO3 → CaO + CO2
Vôi sống được tôi luyện qua quá trình thủy hóa tạo vôi tôi:
CaO + H2O → Ca(OH)2
Cuối cùng, cho CO2 đi qua dung dịch Ca(OH)2 để tạo CaCO3:
Ca(OH)2 + CO2 → CaCO3 + H2O
Các phương pháp tổng hợp trong phòng thí nghiệm
Phương pháp phổ biến nhất là cho các muối canxi tan trong nước tác dụng với muối cacbonat. Phản ứng tạo kết tủa CaCO3 màu trắng:
CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl
Một phương pháp khác là sục khí CO2 vào dung dịch nước vôi trong Ca(OH)2:
Ca(OH)2 + CO2 → CaCO3 + H2O
Kinh nghiệm cho thấy cần kiểm soát tốc độ sục khí và nồng độ dung dịch để thu được sản phẩm có độ tinh khiết cao. Kết tủa CaCO3 cần được lọc, rửa sạch và sấy khô ở nhiệt độ thích hợp.
Ứng dụng của canxi cacbonat trong đời sống và công nghiệp
Canxi cacbonat là một hợp chất vô cơ có công thức hóa học CaCO3. Hợp chất này có vai trò quan trọng trong nhiều lĩnh vực khác nhau của đời sống và sản xuất công nghiệp.
Ứng dụng trong xây dựng và vật liệu
CaCO3 là thành phần chính trong sản xuất xi măng và vôi xây dựng. Khi nung nóng ở nhiệt độ cao, nó phân hủy thành CaO – thành phần quan trọng của xi măng Portland.
Trong ngành công nghiệp giấy, canxi cacbonat ứng dụng làm chất độn và tạo độ trắng cho giấy. Tôi thường lấy ví dụ về việc sản xuất giấy trắng để giải thích cho học sinh hiểu rõ hơn về tầm quan trọng của hợp chất này.

Ngoài ra, CaCO3 còn được sử dụng trong sản xuất thủy tinh, gốm sứ và các vật liệu composite. Các sản phẩm này đều cần đến tính năng ổn định nhiệt và độ bền cơ học của canxi cacbonat.
Ứng dụng trong y học và thực phẩm
Trong y học, CaCO3 được sử dụng làm thuốc kháng axit dạ dày và bổ sung canxi. Tương tự như phân kali là gì, canxi cacbonat cũng đóng vai trò quan trọng trong việc cân bằng dinh dưỡng.
Ngành công nghiệp thực phẩm sử dụng CaCO3 làm phụ gia thực phẩm E170. Chất này giúp tăng độ đặc cho sữa, làm chất độn trong kẹo và thực phẩm chức năng.
Ứng dụng trong công nghiệp hóa chất
CaCO3 là nguyên liệu quan trọng trong sản xuất nhiều hóa chất khác như công thức hóa học của kali xyanua. Quá trình này đòi hỏi kiểm soát chặt chẽ các điều kiện phản ứng.
Trong xử lý nước thải, canxi cacbonat được sử dụng để điều chỉnh độ pH và loại bỏ kim loại nặng. Kinh nghiệm giảng dạy cho thấy học sinh thường nhớ ứng dụng này qua các thí nghiệm thực tế về xử lý nước.
Ngành công nghiệp luyện kim cũng sử dụng CaCO3 làm chất trợ dung trong quá trình luyện thép. Hợp chất này giúp loại bỏ tạp chất và cải thiện chất lượng sản phẩm cuối cùng.
FAQ: Câu hỏi thường gặp về canxi cacbonat
Các thắc mắc phổ biến về canxi cacbonat thường xoay quanh tính an toàn và cách sử dụng hiệu quả. Tôi sẽ giải đáp chi tiết từng vấn đề để bạn hiểu rõ hơn về hợp chất này.
Canxi cacbonat có độc không?
Canxi cacbonat là hợp chất an toàn khi sử dụng đúng liều lượng. Tôi đã có kinh nghiệm hướng dẫn nhiều học sinh về tính chất của nó.
Ở dạng tinh khiết, canxi cacbonat không gây độc cho cơ thể. Nó còn được dùng làm thực phẩm chức năng bổ sung canxi.
Tuy nhiên, việc sử dụng quá liều có thể gây ra các tác dụng phụ như đầy hơi, táo bón hoặc khó tiêu.
Phân biệt canxi cacbonat với các hợp chất canxi khác
Canxi cacbonat có công thức CaCO3, màu trắng và ít tan trong nước. Đây là điểm khác biệt với canxi clorua dễ tan.
Khi nung nóng, canxi cacbonat phân hủy thành canxi oxit và khí CO2. Phản ứng này không xảy ra với các muối canxi khác.
So với canxi gluconat hay canxi citrat, canxi cacbonat có hàm lượng canxi nguyên tố cao hơn. Điều này giúp giảm số viên uống cần thiết.
Cách bảo quản và sử dụng canxi cacbonat an toàn
Bảo quản canxi cacbonat cần tránh nơi ẩm ướt và nhiệt độ cao. Tôi khuyên học sinh nên đặt trong hộp kín, tránh ánh nắng trực tiếp.
Khi sử dụng làm thực phẩm chức năng, nên uống sau bữa ăn để tăng khả năng hấp thu. Liều dùng phổ biến là 500-1000mg/ngày.
Người có tiền sử sỏi thận cần thận trọng và tham khảo ý kiến bác sĩ trước khi dùng. Điều này giúp tránh các biến chứng không mong muốn.
Chất hóa học công thức canxi cacbonat đóng vai trò quan trọng trong nhiều lĩnh vực. Hợp chất này có cấu tạo đơn giản nhưng sở hữu nhiều tính chất đặc biệt và phản ứng hóa học đa dạng. Các phương pháp điều chế CaCO3 trong phòng thí nghiệm và sản xuất công nghiệp đã được nghiên cứu kỹ lưỡng. Với những ứng dụng thiết thực trong xây dựng, y học và công nghiệp hóa chất, canxi cacbonat là một hợp chất thiết yếu của nền công nghiệp hiện đại.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

