Tìm hiểu công thức benzen và cấu trúc phân tử đặc biệt trong hóa học
Công thức benzen là một trong những cấu trúc đặc biệt nhất của hóa học hữu cơ. Phân tử này có cấu tạo vòng 6 cạnh với 3 liên kết pi luân chuyển. Các đặc điểm cấu tạo độc đáo tạo nên tính chất hóa học đa dạng của benzen trong phòng thí nghiệm và công nghiệp.
Công thức benzen và cấu tạo phân tử
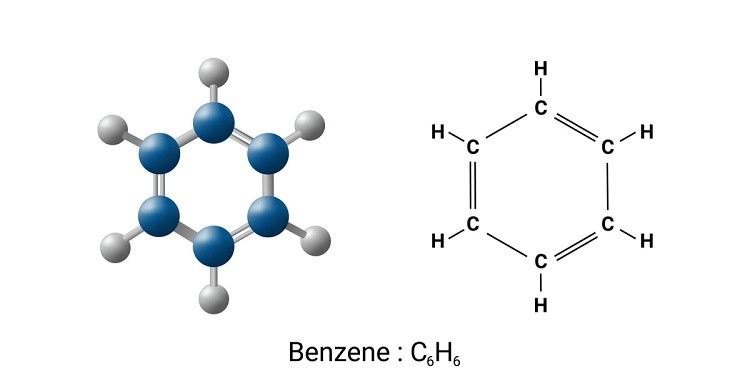
Benzen là một hợp chất thơm có công thức benzen là C6H6. Đây là một phân tử có cấu trúc vòng 6 cạnh đặc biệt với 6 nguyên tử cacbon.
Cấu tạo phân tử benzen gồm 6 nguyên tử cacbon xếp thành vòng lục giác đều. Mỗi nguyên tử cacbon liên kết với 1 nguyên tử hydro và tạo liên kết với 2 nguyên tử cacbon kế cận.
Điều đặc biệt là các liên kết trong vòng benzen luân phiên đơn và đôi. Tuy nhiên, thực tế các electron π được phân bố đều trên toàn bộ vòng.
Trong quá trình giảng dạy, tôi thường ví von vòng benzen như một “chiếc bánh pizza” tròn. Các electron π giống như phô mai được phết đều khắp mặt bánh.
công thức chung của ankin benzen là một dẫn xuất quan trọng của benzen. Nó được tạo thành khi thay thế các nguyên tử H bằng các nhóm thế khác nhau.
Để học sinh dễ nhớ, tôi thường nhấn mạnh 3 đặc điểm của benzen:
- Vòng 6 cạnh đều
- 6 nguyên tử C và 6 nguyên tử H
- Các electron π được giải phóng và phân bố đều
Cấu trúc đặc biệt này giúp benzen có tính bền vững cao và là nền tảng cho nhiều hợp chất thơm quan trọng trong công nghiệp hóa chất.
Cấu trúc đặc biệt của phân tử benzen
Phân tử benzen có cấu trúc benzen độc đáo với vòng 6 cạnh và hệ thống liên kết pi đặc biệt. Đây là nền tảng cho nhiều hợp chất thơm quan trọng như phenol có công thức là và cấu tạo anilin.
Cấu trúc vòng 6 cạnh
Vòng benzen gồm 6 nguyên tử carbon xếp thành hình lục giác đều. Mỗi nguyên tử carbon liên kết với 1 nguyên tử hydro bên ngoài vòng.
Các góc liên kết trong vòng benzen đều bằng 120°. Điều này tạo nên sự ổn định cao cho phân tử.
Khoảng cách giữa các nguyên tử carbon trong vòng benzen là 1,39Å. Con số này nằm giữa độ dài liên kết đơn C-C (1,54Å) và liên kết đôi C=C (1,34Å).
Liên kết pi trong phân tử benzen
Các electron pi trong benzen được phân bố đều trên toàn bộ vòng 6 cạnh. Chúng tạo thành một đám mây electron pi liên tục.
Theo thuyết cộng hưởng, cấu tạo benzen có hai dạng cộng hưởng tương đương. Hai dạng này luân phiên chuyển đổi qua lại.
Sự phân bố đều của electron pi làm cho tất cả liên kết C-C trong benzen có độ dài bằng nhau. Đây là đặc điểm quan trọng tạo nên tính bền vững của phân tử.
Tính thơm của benzen
Tính thơm là đặc trưng của benzen và các dẫn xuất. Nó xuất phát từ hệ thống liên kết pi liên hợp vòng.
Benzen rất bền vững với phản ứng cộng. Thay vào đó, nó ưa tham gia phản ứng thế điện tử.
Năng lượng cộng hưởng của benzen khoảng 36 kcal/mol. Đây là nguyên nhân khiến benzen bền vững hơn nhiều so với các alkene thông thường.
Tính chất và đặc điểm của benzen
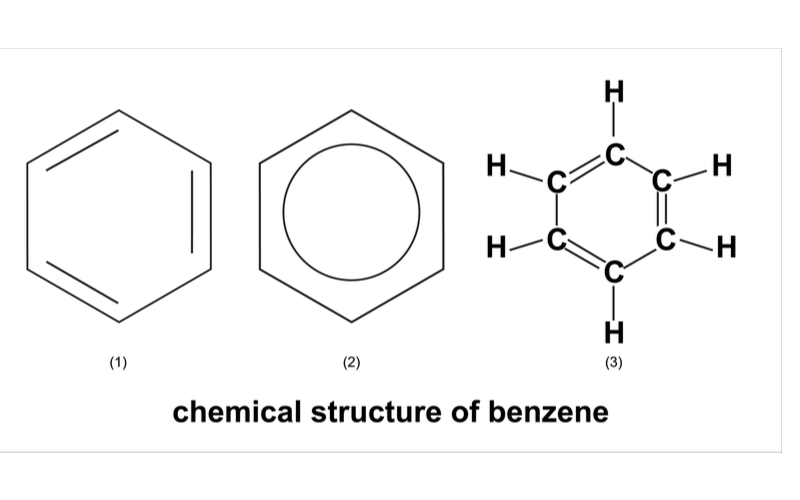
Benzen là hợp chất thơm đơn giản nhất, có công thức phân tử C6H6. Cấu trúc phân tử benzen gồm 6 nguyên tử cacbon liên kết với nhau tạo thành vòng lục giác đều.
Các electron π trong phân tử benzen được giải phóng và tạo thành đám mây electron π phân bố đều trên và dưới mặt phẳng vòng benzen. Đặc điểm cấu trúc này giúp phân tử benzen có độ bền cao.
Tính chất vật lý
Benzen là chất lỏng không màu ở điều kiện thường, có mùi thơm đặc trưng. Nhiệt độ sôi của benzen là 80,1°C và nhiệt độ nóng chảy là 5,5°C.

Benzen không tan trong nước do tính không phân cực của phân tử. Tuy nhiên, nó tan tốt trong các dung môi hữu cơ không phân cực như công thức amin.
Tính chất hóa học
Các phản ứng hóa học của benzen phụ thuộc vào cấu trúc đặc biệt của vòng thơm. Vòng benzen có xu hướng bảo toàn tính thơm thông qua phản ứng thế thay vì phản ứng cộng.
Phản ứng thế
Phản ứng thế là phản ứng đặc trưng của benzen, tương tự như isopren công thức cấu tạo. Trong phản ứng này, nguyên tử H trên vòng benzen được thay thế bởi nhóm thế khác.
Phản ứng thế halogen hóa xảy ra khi có mặt xúc tác FeCl3 hoặc AlCl3. Phản ứng thế nitro hóa diễn ra với hỗn hợp axit HNO3 và H2SO4 đặc.
Phản ứng cộng
Phản ứng cộng của benzen chỉ xảy ra trong điều kiện đặc biệt như ánh sáng hoặc nhiệt độ cao. Phản ứng cộng hydro tạo thành cyclohexan khi có xúc tác Ni, Pt hoặc Pd.
Phản ứng cộng halogen tạo thành hexahalogenocyclohexan khi có ánh sáng. Các phản ứng cộng làm mất tính thơm của vòng benzen.
Ứng dụng của benzen trong công nghiệp và đời sống
Benzen là một hợp chất thơm quan trọng với nhiều ứng dụng đa dạng. Công thức benzen C6H6 có cấu trúc vòng 6 cạnh đặc biệt giúp nó trở thành nguyên liệu không thể thiếu trong nhiều ngành công nghiệp.
Với tư cách là một dung môi hữu cơ phổ biến, benzen công thức đơn giản nhưng lại có khả năng hòa tan tốt nhiều chất. Tôi thường ví von benzen như một “người bạn đa năng” trong phòng thí nghiệm hóa học.
Ứng dụng trong tổng hợp hữu cơ
Benzen đóng vai trò then chốt trong việc tổng hợp nhiều hợp chất hữu cơ quan trọng. Nó là tiền chất để sản xuất các amino acid như công thức valin và các chất phụ gia thực phẩm như công thức bột ngọt.
Trong quá trình giảng dạy, tôi thường nhấn mạnh khả năng phản ứng thế của benzen. Phản ứng với propen theo công thức phân tử của propen tạo ra cumene – tiền chất quan trọng trong công nghiệp.
Ứng dụng trong công nghiệp
Benzen được sử dụng rộng rãi trong sản xuất nhựa, cao su tổng hợp và các vật liệu polyme. Theo số liệu từ Hiệp hội Hóa học Mỹ, mỗi năm ngành công nghiệp tiêu thụ hơn 50 triệu tấn benzen.
Trong ngành dệt may, benzen là nguyên liệu chính để sản xuất nylon và các loại sợi tổng hợp. Nó cũng được dùng làm dung môi trong sản xuất sơn, mực in và chất tẩy rửa công nghiệp.
Kinh nghiệm của tôi cho thấy việc nắm vững tính chất và ứng dụng của benzen giúp sinh viên hiểu sâu hơn về hóa học hữu cơ công nghiệp.
FAQ: Câu hỏi thường gặp về benzen
Benzen là một hợp chất hữu cơ thơm quan trọng trong công nghiệp hóa chất. Tương tự như metanol có công thức là, benzen có nhiều ứng dụng trong sản xuất. Cùng tìm hiểu một số câu hỏi phổ biến về hợp chất này.
Benzen có độc không?
Benzen là chất độc nguy hiểm, có thể gây ung thư máu khi tiếp xúc lâu dài. Việc hít phải hơi benzen có thể gây chóng mặt, buồn nôn và đau đầu.
Tiếp xúc với nồng độ cao có thể dẫn đến tử vong. Giống như công thức paracetamol, benzen cần được bảo quản và sử dụng đúng cách.
Benzen tan trong nước không?
Benzen không tan trong nước do cấu trúc phân tử không phân cực. Tuy nhiên, benzen tan tốt trong các dung môi hữu cơ như ether, cloroform.
Đặc tính này giúp benzen được sử dụng làm dung môi trong nhiều phản ứng hữu cơ quan trọng.
Làm sao để nhận biết benzen?
Có thể nhận biết benzen qua mùi thơm đặc trưng và khả năng cháy với ngọn lửa sáng có nhiều muội đen.
Benzen còn có thể được nhận biết bằng phản ứng với brom tạo thành dibrombenzen. Phản ứng này xảy ra chậm và cần có xúc tác bột sắt.
Kiến thức về công thức benzen là nền tảng quan trọng trong hóa học hữu cơ. Cấu trúc vòng 6 cạnh đặc biệt với 3 liên kết pi tạo nên tính thơm đặc trưng và độ bền vững cao của phân tử. Các phản ứng thế và cộng của benzen cùng những ứng dụng rộng rãi trong công nghiệp đã khẳng định vai trò then chốt của hợp chất này trong ngành hóa học và đời sống.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

