Tổng quan về công thức amoniac và các tính chất hóa học cơ bản
Công thức amoniac NH3 là một trong những hợp chất quan trọng bậc nhất của ngành công nghiệp hóa chất. Phân tử amoniac có cấu trúc hình tháp tam giác với liên kết đặc biệt. Chất khí này tan tốt trong nước và có nhiều ứng dụng thiết yếu trong sản xuất phân bón, thuốc nhuộm.
Công thức amoniac
Amoniac là một hợp chất vô cơ phổ biến trong tự nhiên và công nghiệp. Công thức hoá học của amoniac là NH3, gồm 1 nguyên tử nitơ (N) liên kết với 3 nguyên tử hiđro (H).
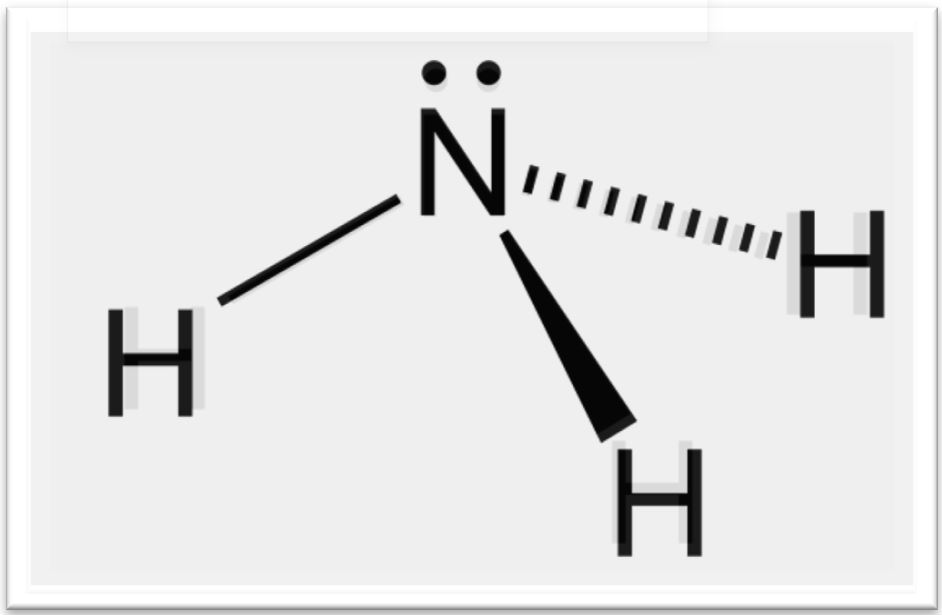
Cấu tạo phân tử NH3 có dạng tháp tam giác, trong đó nguyên tử N ở đỉnh và 3 nguyên tử H ở 3 đỉnh của tam giác đáy. Góc liên kết H-N-H là 107°, nhỏ hơn góc tứ diện lý tưởng 109.5°.
Trong quá trình giảng dạy, tôi thường giúp học sinh ghi nhớ công thức amoniac bằng cách liên tưởng đến chiếc ô 3 cạnh – với N là người cầm ô và 3 nguyên tử H như 3 cạnh của chiếc ô che mưa.
Phân tử NH3 có cấu trúc phân cực do sự chênh lệch độ âm điện giữa N và H. Điều này giải thích khả năng tan tốt trong nước và tạo liên kết hydro của amoniac. Đây là kiến thức quan trọng để hiểu các tính chất hoá học của NH3.
Khi viết phương trình phản ứng, cần chú ý NH3 thường đóng vai trò bazơ yếu theo thuyết Brønsted–Lowry:
NH3 + H2O ⇌ NH4+ + OH-
Phương trình này thể hiện sự nhường proton từ H2O cho NH3, tạo thành ion NH4+ và OH-.
Cấu tạo và tính chất hóa học của amoniac
Amoniac là chất gì? Amoniac (NH3) là một hợp chất hóa học phổ biến, tồn tại ở dạng khí không màu với mùi khai đặc trưng. Chất này đóng vai trò quan trọng trong nhiều ngành công nghiệp và đời sống.
Cấu tạo phân tử amoniac
Phân tử NH3 có cấu trúc hình tháp tam giác với nguyên tử N ở đỉnh và 3 nguyên tử H ở 3 đỉnh của tam giác đáy. Góc liên kết H-N-H là 107°, nhỏ hơn góc tứ diện lý tưởng 109,5°.
Cấu hình electron của nguyên tử N là [He]2s22p3, có 3 electron hóa trị chưa ghép đôi tham gia liên kết với H. Điều này tương tự như trong công thức amin khi N liên kết với các gốc hydrocarbon.
Liên kết trong phân tử amoniac
Liên kết N-H trong NH3 là liên kết cộng hóa trị có cực. Nguyên tử N có độ âm điện lớn hơn H nên hút electron mạnh hơn, tạo nên sự phân cực trong phân tử.
Cặp electron tự do của N không tham gia liên kết tạo nên moment lưỡng cực, khiến phân tử có khả năng tạo liên kết hydrogen với nước. Đặc điểm này khác với công thức benzen – một phân tử không phân cực.
Các tính chất vật lý của amoniac
NH3 là chất khí ở điều kiện thường, có khối lượng riêng nhẹ hơn không khí. Nhiệt độ sôi -33,4°C và nhiệt độ nóng chảy -77,7°C.
Tính chất của amoniac nổi bật là khả năng tan rất tốt trong nước do tạo được liên kết hydrogen. Một thể tích nước có thể hòa tan tới 700 thể tích NH3 ở 20°C.
Phản ứng hóa học đặc trưng của amoniac
NH3 thể hiện tính bazơ yếu khi tác dụng với nước tạo NH4OH:
NH3 + H2O ⇌ NH4+ + OH-
Amoniac tham gia phản ứng trung hòa với axit:
NH3 + HCl → NH4Cl
Phản ứng oxi hóa NH3 tạo NO là cơ sở của phương pháp Ostwald sản xuất axit nitric công nghiệp:
4NH3 + 5O2 → 4NO + 6H2O
Phương pháp điều chế và sản xuất amoniac trong công nghiệp
Amoniac là hợp chất quan trọng trong công nghiệp hóa chất. Công thức amoniac NH3 được tổng hợp từ khí nitơ và hidro theo phương pháp Haber-Bosch.
Quá trình sản xuất amoniac công nghiệp đòi hỏi nhiều điều kiện nghiêm ngặt. Tương tự như công thức metanol, việc tối ưu các thông số kỹ thuật rất quan trọng.
Phản ứng tổng hợp amoniac
Phản ứng tổng hợp amoniac diễn ra theo phương trình:
N2 + 3H2 ⇌ 2NH3 + Q
Đây là phản ứng thuận nghịch tỏa nhiệt. Khí N2 được lấy từ không khí qua chưng cất phân đoạn. Khí H2 thu được từ quá trình reforming khí thiên nhiên hoặc công thức butan.
Tốc độ phản ứng phụ thuộc vào nồng độ các chất tham gia. Cách viết công thức amoniac cần tuân theo quy tắc hóa trị và cân bằng electron.
Điều kiện tối ưu cho phản ứng
Nhiệt độ tối ưu cho phản ứng là 450-500°C. Ở nhiệt độ cao hơn, cân bằng chuyển dịch theo chiều thuận không thuận lợi.
Áp suất cao 150-300 atm giúp tăng hiệu suất phản ứng. Xúc tác Fe3O4 với chất xúc tiến K2O, Al2O3 làm tăng tốc độ phản ứng.
Tỷ lệ N2:H2 = 1:3 theo hệ số phương trình phản ứng. Loại bỏ tạp chất CO, H2O để tránh ngộ độc xúc tác.
Quy trình sản xuất công nghiệp
Không khí được nén và làm sạch qua tháp hấp thụ. Khí thiên nhiên được reforming tạo H2 và loại CO bằng hơi nước.
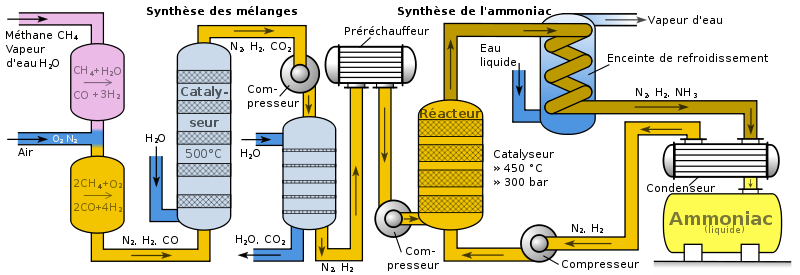
Hỗn hợp N2 và H2 được nén đến áp suất cao. Phản ứng diễn ra trong tháp tổng hợp nhiều tầng có làm mát trung gian.
Sản phẩm NH3 được hóa lỏng và tách ra khỏi hỗn hợp khí chưa phản ứng. Khí còn lại được tuần hoàn trở lại tháp tổng hợp.
Ứng dụng quan trọng của amoniac trong đời sống và công nghiệp
Công thức amoniac là NH3 – một hợp chất vô cơ quan trọng trong công nghiệp hóa chất. Với những ứng dụng của amoniac đa dạng, hợp chất này đóng vai trò then chốt trong nhiều lĩnh vực sản xuất và đời sống.
Sản xuất phân đạm
Amoniac là nguyên liệu chính để sản xuất phân đạm, loại phân bón thiết yếu trong nông nghiệp. Quá trình này tạo ra các sản phẩm như urê, amoni nitrat và amoni sulfat.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về amoni gluconat công thức để minh họa cho học sinh về phản ứng tạo muối amoni. Điều này giúp các em hiểu rõ hơn về bản chất hóa học của quá trình.
Sản xuất axit nitric
Amoniac phản ứng với oxygen tạo thành NO, sau đó chuyển hóa thành NO2 và cuối cùng là HNO3. Quá trình này được gọi là phương pháp Ostwald, một trong những quy trình công nghiệp quan trọng.

Tương tự như công thức aspirin là gì, việc nắm vững các phản ứng trong quy trình sản xuất axit nitric rất quan trọng với sinh viên ngành hóa.
Các ứng dụng khác
Amoniac được sử dụng làm chất làm lạnh trong các hệ thống điều hòa công nghiệp. Hợp chất này còn là nguyên liệu sản xuất các loại sợi tổng hợp như nylon.
Trong y tế, dung dịch amoniac loãng được dùng làm thuốc kích thích hô hấp. Ngoài ra, amoniac còn được sử dụng trong sản xuất thuốc nhuộm và chất tẩy rửa.
FAQ: Câu hỏi thường gặp về amoniac
Amoniac là hợp chất hóa học phổ biến trong công nghiệp và đời sống. Tôi sẽ giải đáp những thắc mắc thường gặp về tính chất của chất này.
Amoniac có độc không và cách phòng tránh?
Amoniac có độc không khi tiếp xúc trực tiếp với nồng độ cao. Khí amoniac có thể gây kích ứng đường hô hấp, mắt và da.
Để phòng tránh tác hại của amoniac, cần thực hiện các biện pháp bảo vệ:
- Đeo khẩu trang, kính bảo hộ khi làm việc với amoniac
- Đảm bảo thông thoáng không khí trong phòng thí nghiệm
- Rửa sạch vùng da tiếp xúc với nước nếu bị dính amoniac
Đặc điểm mùi của amoniac
Amoniac có mùi gì rất đặc trưng – mùi khai nồng, xốc mũi. Mùi này tương tự như trong nước tiểu lên men.
Trong quá trình giảng dạy, tôi thường ví von mùi amoniac giống như mùi nước tiểu mèo. Điều này giúp học sinh dễ nhận biết và ghi nhớ.
Mùi amoniac có thể phát hiện được ngay cả ở nồng độ rất thấp, như công thức cấu tạo của axit glutamic và valin có công thức là.
Khả năng tan của amoniac trong nước
Amoniac có tan trong nước không là câu hỏi phổ biến. Amoniac tan rất tốt trong nước tạo dung dịch bazơ NH4OH.
Khả năng tan của amoniac trong nước phụ thuộc vào nhiệt độ và áp suất, tương tự như cấu tạo tơ tằm.
Dung dịch amoniac trong nước có tính bazơ mạnh và được ứng dụng rộng rãi trong công nghiệp, đặc biệt là sản xuất công thức của anilin.
Kiến thức về công thức amoniac NH3 là nền tảng quan trọng trong chương trình hóa học phổ thông và đại học. Phân tử amoniac có cấu tạo đơn giản nhưng đóng vai trò then chốt trong công nghiệp sản xuất phân bón và hóa chất. Việc nắm vững cấu tạo, tính chất và ứng dụng của amoniac giúp người học hiểu sâu hơn về hóa học nitơ và các hợp chất vô cơ quan trọng.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

