Ghi nhớ công thức amin và các tính chất hóa học quan trọng
Công thức amin là nền tảng để hiểu về nhóm hợp chất hữu cơ chứa nitơ. Các dạng amin đơn chức, đa chức có vai trò quan trọng trong tổng hợp hóa học. Chúng tạo nên protein thiết yếu và nhiều hợp chất sinh học trong cơ thể sống.
Công thức amin và cấu tạo phân tử
Amin là dẫn xuất của amoniac (NH3), trong đó một hoặc nhiều nguyên tử H được thay thế bằng gốc hydrocarbon. Công thức amin có dạng tổng quát là:
R-NH2 (amin bậc 1)
R2NH (amin bậc 2)
R3N (amin bậc 3)
Trong đó R là gốc hydrocarbon, có thể giống hoặc khác nhau. Tôi thường giải thích cho học sinh bằng cách so sánh với một gia đình – NH3 như người mẹ và các gốc R như những đứa con thay thế vị trí của H.
Về cấu tạo phân tử, công thức của amin có đặc điểm quan trọng là nguyên tử N có một cặp electron tự do. Điều này giúp amin có tính bazơ và khả năng phản ứng đặc trưng.
Ví dụ điển hình về amin bậc 1:
CH3NH2 (methylamin)
C2H5NH2 (ethylamin)
Khi giảng dạy, tôi thường nhấn mạnh với học sinh rằng cấu tạo không gian của amin có dạng tứ diện với nguyên tử N ở tâm. Ba liên kết của N tạo thành hình chóp tam giác.
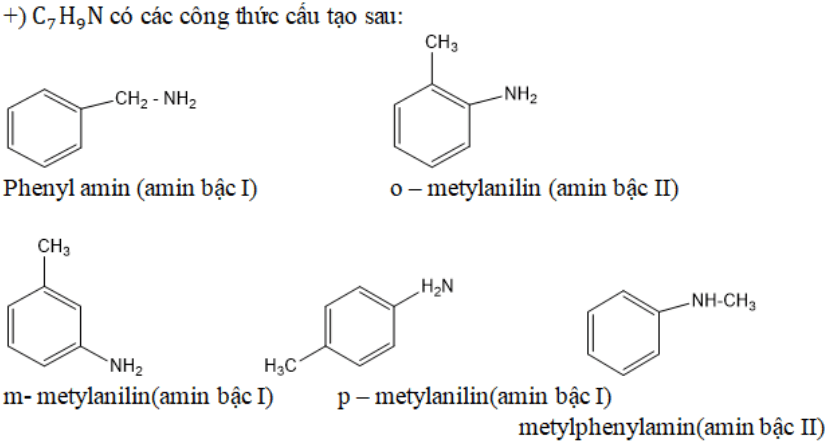
Một mẹo nhỏ để nhớ bậc của amin: đếm số gốc R gắn với N, có bao nhiêu gốc R thì đó là amin bậc ấy. Cách này giúp học sinh dễ dàng phân biệt các loại amin trong bài tập.
Phân loại và công thức chung của amin
Amin là dẫn xuất của amoniac (NH3), trong đó một hoặc nhiều nguyên tử H được thay thế bằng gốc hydrocarbon. Công thức chung của amin có dạng R-NH2, với R là gốc hydrocarbon.
Để hiểu rõ hơn về cấu tạo và tính chất của amin, ta cần nắm vững cách phân loại amin theo số nhóm chức và theo bậc.
Amin đơn chức, hai chức và đa chức
Dựa vào số nhóm -NH2 trong phân tử, amin được chia thành 3 loại chính:
Amin đơn chức chỉ chứa một nhóm -NH2, như công thức của anilin C6H5NH2. Đây là loại amin phổ biến nhất trong tự nhiên và công nghiệp.
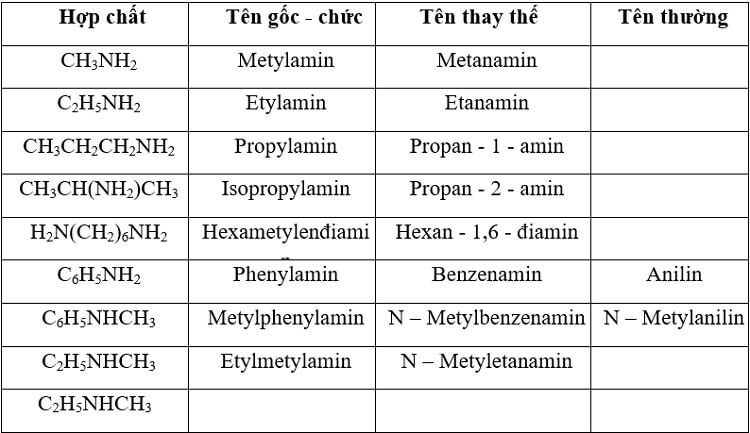
Amin hai chức có hai nhóm -NH2 trong phân tử. Ví dụ như etylendiamin H2N-CH2-CH2-NH2 được sử dụng làm chất xúc tác trong công nghiệp polymer.
Amin đa chức chứa từ ba nhóm -NH2 trở lên. Các amino acid như công thức valin là ví dụ điển hình cho amin đa chức.
Amin bậc một, bậc hai và bậc ba
Căn cứ vào số nguyên tử H trong NH3 bị thay thế bởi gốc hydrocarbon:
Amin bậc một (R-NH2): Một nguyên tử H bị thay thế. Ví dụ: CH3NH2 (methylamin).
Amin bậc hai (R2NH): Hai nguyên tử H bị thay thế. Ví dụ: (CH3)2NH (dimethylamin).
Amin bậc ba (R3N): Ba nguyên tử H bị thay thế. Ví dụ: (CH3)3N (trimethylamin).
Công thức chung của từng loại amin
Mỗi loại amin có công thức chung riêng biệt:
Amin bậc một: R-NH2 (R là gốc alkyl hoặc aryl)
Công thức tổng quát: CnH2n+1NH2 (với n ≥ 1)
Amin bậc hai: R2NH hoặc R-NH-R’
Công thức tổng quát: (CnH2n+1)2NH (với n ≥ 1)
Amin bậc ba: R3N hoặc R2N-R’
Công thức tổng quát: (CnH2n+1)3N (với n ≥ 1)
Cách viết công thức và gọi tên amin đơn chức
Công thức amin đơn chức có cấu tạo gồm gốc hidrocacbon và nhóm -NH2. Việc nắm vững quy tắc viết và gọi tên giúp học sinh dễ dàng tiếp cận nhóm hợp chất này.
Quy tắc viết công thức phân tử
Công thức phân tử của amin đơn chức có dạng CnH2n+3N. Trong đó n là số nguyên dương thể hiện số nguyên tử cacbon.
Ví dụ với n = 2, ta có C2H7N là công thức phân tử của etylamin. Tương tự như ankan công thức chung, công thức này giúp xác định nhanh thành phần nguyên tố.
Quy tắc viết công thức cấu tạo
Cách viết công thức amin cần tuân thủ 2 nguyên tắc cơ bản. Nhóm -NH2 luôn gắn với cacbon no. Các liên kết hóa học phải thể hiện đúng hóa trị.
Với amin thơm như công thức của benzen, nhóm -NH2 gắn trực tiếp vào vòng benzen. Đây là điểm khác biệt so với amin no.
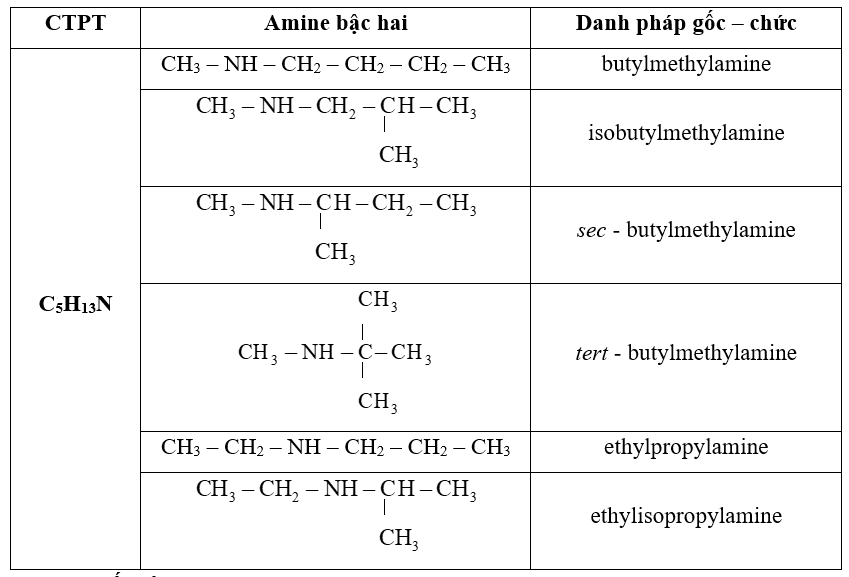
Tôi thường hướng dẫn học sinh vẽ khung cacbon trước. Sau đó điền các nguyên tử H và nhóm -NH2 vào vị trí thích hợp.
Nguyên tắc gọi tên amin
Cách gọi tên amin dựa trên tên gốc hidrocacbon và thêm hậu tố “amin”. Với amin thơm, thêm tiền tố “amino-” vào tên benzen.
Ví dụ: CH3-NH2 là metylamin, C6H5-NH2 là aminobenzen (anilin). Tôi thường cho học sinh liên hệ với tên gốc hidrocacbon để nhớ lâu hơn.
Với amin bậc cao, cần chỉ rõ vị trí nhóm -NH2. Điều này giúp phân biệt các đồng phân cấu tạo của amin.
Tính chất hóa học đặc trưng của amin
Công thức amin là một trong những kiến thức quan trọng giúp hiểu rõ về tính chất của chúng. Amin có nhiều tính chất hóa học đặc biệt, trong đó nổi bật là tính bazơ và khả năng phản ứng thế trong nhân thơm.
Tính bazơ của amin
Amin thể hiện tính chất amin bazơ do có cặp electron tự do trên nguyên tử N. Khi tôi giảng dạy, tôi thường ví von N như một “người mẹ” luôn sẵn sàng cho đi electron của mình.
Mức độ bazơ của amin phụ thuộc vào:
- Bậc của amin (amin bậc 1 < amin bậc 2 < amin bậc 3)
- Tính electron của các nhóm thế
- Hiệu ứng cộng hưởng trong phân tử
Phản ứng với axit
Amin phản ứng với axit tạo thành muối amoni. Phản ứng này diễn ra nhanh và mạnh mẽ.
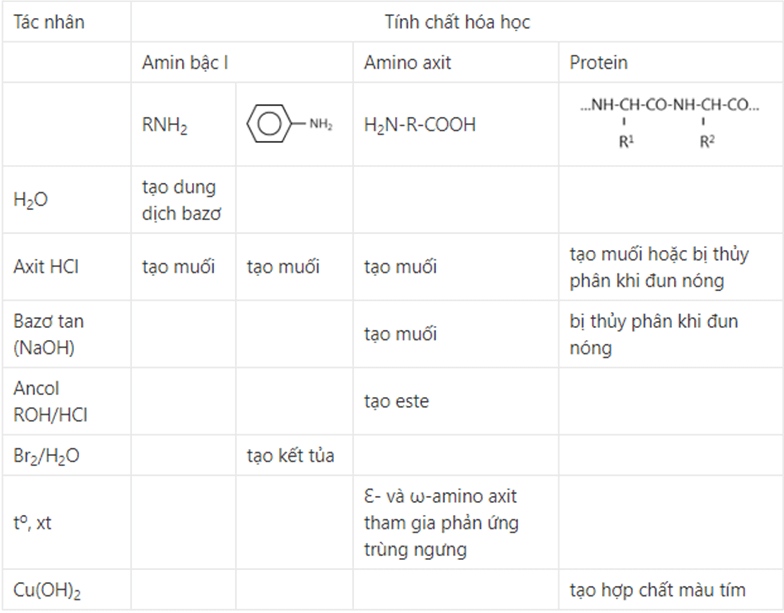
Công thức tổng quát:
R-NH2 + HX → [R-NH3]+X-
Đây là phản ứng quan trọng trong tổng hợp nhiều loại thuốc như paracetamol cấu trúc và công thức của aspirin.
Phản ứng thế trong nhân thơm
Amin thơm có khả năng định hướng ortho và para trong phản ứng thế. Nhóm -NH2 làm tăng hoạt tính của vòng benzen.
Phản ứng bromhóa anilin là ví dụ điển hình:
C6H5NH2 + 3Br2 → C6H2Br3NH2 + 3HBr
Trong 20 năm giảng dạy, tôi nhận thấy học sinh thường nhớ tốt hơn khi liên hệ với các ứng dụng thực tế như quá trình tổng hợp thuốc nhuộm.
Ứng dụng của các hợp chất amin trong thực tế
Các hợp chất amin với công thức amin là gì luôn là câu hỏi được nhiều học sinh quan tâm. Amin là hợp chất hữu cơ chứa nhóm -NH2 với công thức phân tử của amin điển hình là R-NH2. Nhóm hợp chất này có vai trò quan trọng trong nhiều lĩnh vực khác nhau.
Amin trong công nghiệp
Amin được sử dụng rộng rãi trong sản xuất các loại nhựa, sợi tổng hợp và chất tẩy rửa. Tôi thường lấy ví dụ về nylon – một loại sợi tổng hợp phổ biến được tạo ra từ phản ứng của diamin với axit dicacboxylic.

Trong ngành công nghiệp dệt may, các hợp chất amin đóng vai trò là chất trung gian để tổng hợp thuốc nhuộm. Chúng tạo ra màu sắc đa dạng và bền màu cho vải vóc.
Amin trong y học và dược phẩm
Nhiều loại thuốc kháng sinh, giảm đau và kháng viêm đều chứa nhóm amin trong cấu trúc. Một ví dụ điển hình là nicotine – một alkaloid có trong thuốc lá.
Các amino acid – những phân tử chứa cả nhóm amin và nhóm cacboxyl là thành phần cơ bản tạo nên protein trong cơ thể. Chúng tham gia vào quá trình tổng hợp protein và các phản ứng sinh hóa quan trọng.
Amin trong đời sống
Amin xuất hiện trong nhiều thực phẩm hàng ngày như thịt, cá, trứng dưới dạng protein. Một số amin đơn giản như butan là gì và công thức ete thường được sử dụng làm dung môi trong các sản phẩm tẩy rửa.
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh rằng putrescine và cadaverine – hai amin có mùi khó chịu được tạo ra khi thực phẩm bị phân hủy. Đây là dấu hiệu để nhận biết thực phẩm đã hỏng.
Ngoài ra, amin còn có mặt trong các chất điều vị như monosodium glutamate (MSG) giúp tăng hương vị món ăn. Tuy nhiên cần sử dụng với liều lượng vừa phải để đảm bảo an toàn sức khỏe.
FAQ: Câu hỏi thường gặp về amin
Amin là một trong những hợp chất hữu cơ quan trọng. Tôi sẽ giải đáp các thắc mắc thường gặp về công thức của amin đơn chức và tính chất của chúng.
Sự khác biệt giữa amin bậc 1, 2 và 3?
Amin bậc 1 có một nhóm R gắn với nguyên tử N, có công thức amin dạng R-NH2. Đây là dạng đơn giản nhất của amin.
Amin bậc 2 có hai nhóm R gắn với N, công thức là R2NH. Các nhóm R có thể giống hoặc khác nhau.
Amin bậc 3 có ba nhóm R gắn với N, công thức là R3N. Đây là dạng phức tạp nhất trong các loại amin.
Làm sao nhận biết amin trong phòng thí nghiệm?
Amin có mùi tanh đặc trưng như mùi cá ươn. Đây là dấu hiệu dễ nhận biết nhất.
Khi cho amin tác dụng với quỳ tím ẩm, quỳ sẽ chuyển sang màu xanh do tính bazơ của amin.
Phản ứng với dung dịch HCl sẽ tạo khói trắng NH4Cl. Đây là phản ứng đặc trưng để nhận biết amin.
Tại sao amin có tính bazơ?
Nguyên tử N trong phân tử amin có một cặp electron tự do. Cặp electron này có thể nhận proton H+ từ môi trường.
Khi nhận proton H+, amin tạo thành ion amoni R-NH3+. Quá trình này thể hiện tính bazơ của amin.
Tính bazơ của amin phụ thuộc vào khả năng cho electron của nhóm R. Nhóm R càng cho electron mạnh, amin càng bazơ.
Kiến thức về công thức amin là nền tảng quan trọng trong chương trình hóa học hữu cơ. Các dạng amin đơn chức, đa chức và cách phân loại theo bậc giúp phân biệt rõ đặc điểm cấu tạo của từng loại. Tính bazơ và khả năng phản ứng đặc trưng của amin tạo nên vai trò thiết yếu trong công nghiệp, y dược và đời sống. Việc nắm vững cấu tạo, tính chất và ứng dụng của amin là cơ sở để học tốt môn hóa học.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

