Học công thức axit pecloric HClO4 và tính chất hóa học cơ bản
Axit pecloric có công thức HClO4 là một trong những axit mạnh nhất. Hợp chất này có tính oxi hóa cực mạnh và khả năng tạo muối peclorat đặc biệt. Các phản ứng hóa học của nó đóng vai trò quan trọng trong phân tích và công nghiệp hóa chất.
Axit pecloric có công thức HClO4 và cấu tạo phân tử
Axit pecloric có công thức hóa học là HClO4. Đây là một axit mạnh và có tính oxy hóa rất mạnh. Trong phân tử HClO4, nguyên tử Clo có số oxi hóa +7, cao nhất trong các hợp chất của Clo.
Cấu tạo phân tử của axit pecloric cấu tạo gồm một nguyên tử H liên kết với nhóm ClO4-. Trong đó, nguyên tử Clo ở trung tâm liên kết với 4 nguyên tử O theo dạng tứ diện.
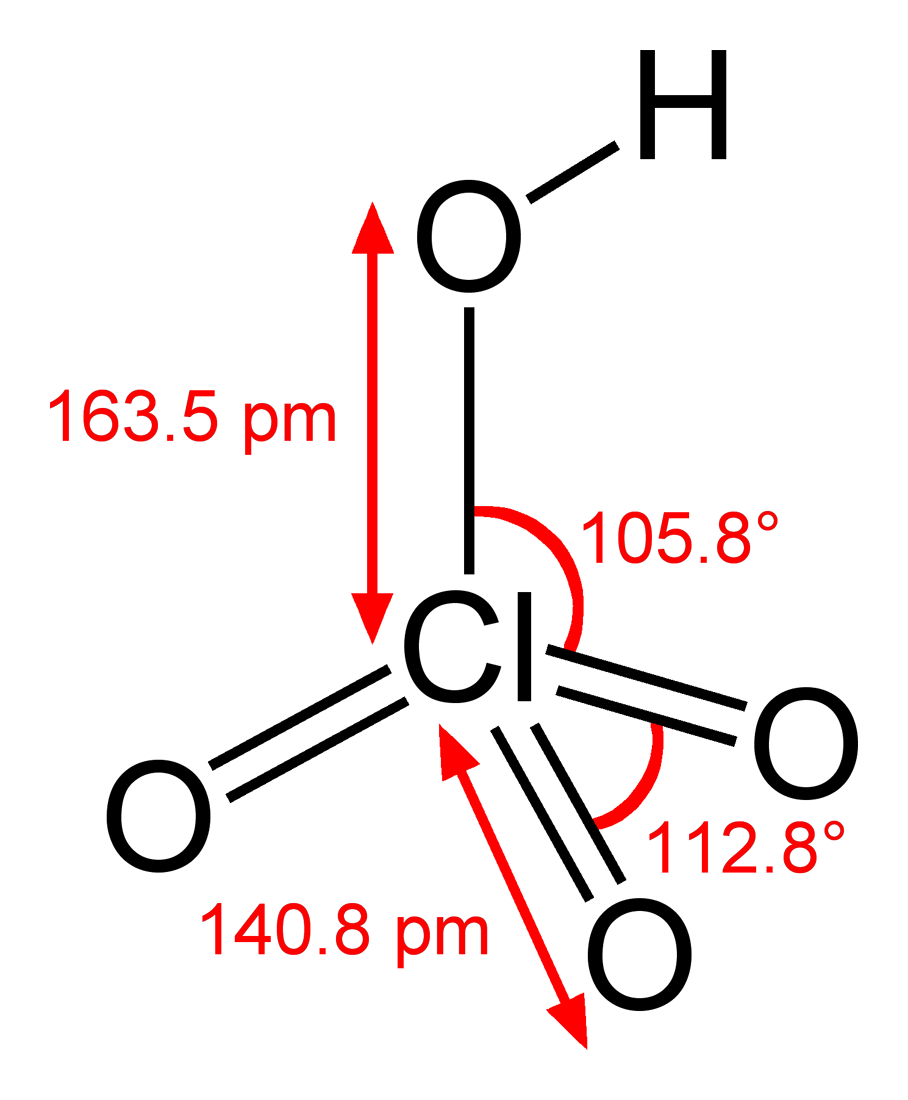
Công thức cấu tạo của HClO4 có thể biểu diễn như sau:
H-O-ClO3
Trong đó:
- H liên kết với 1 nguyên tử O bằng liên kết đơn
- O liên kết với Cl bằng liên kết đơn
- Cl liên kết với 3 nguyên tử O còn lại bằng liên kết đôi
Theo kinh nghiệm giảng dạy của tôi, học sinh thường nhớ cấu tạo HClO4 dễ dàng hơn khi hình dung nó như một “cái ô” – với Cl ở giữa và 4 nguyên tử O xung quanh tạo thành hình tứ diện, còn H gắn với một trong các O đó.
Khi viết phương trình phản ứng, cần chú ý HClO4 là axit mạnh nên phân ly hoàn toàn thành H+ và ClO4- trong dung dịch nước. Điều này giúp dự đoán được các phản ứng của nó với bazơ và muối.
Tính chất hóa học đặc trưng của axit pecloric
Axit pecloric là một trong những axit mạnh nhất được biết đến trong hóa học. Nó có nhiều tính chất đặc biệt và ứng dụng quan trọng trong phòng thí nghiệm.
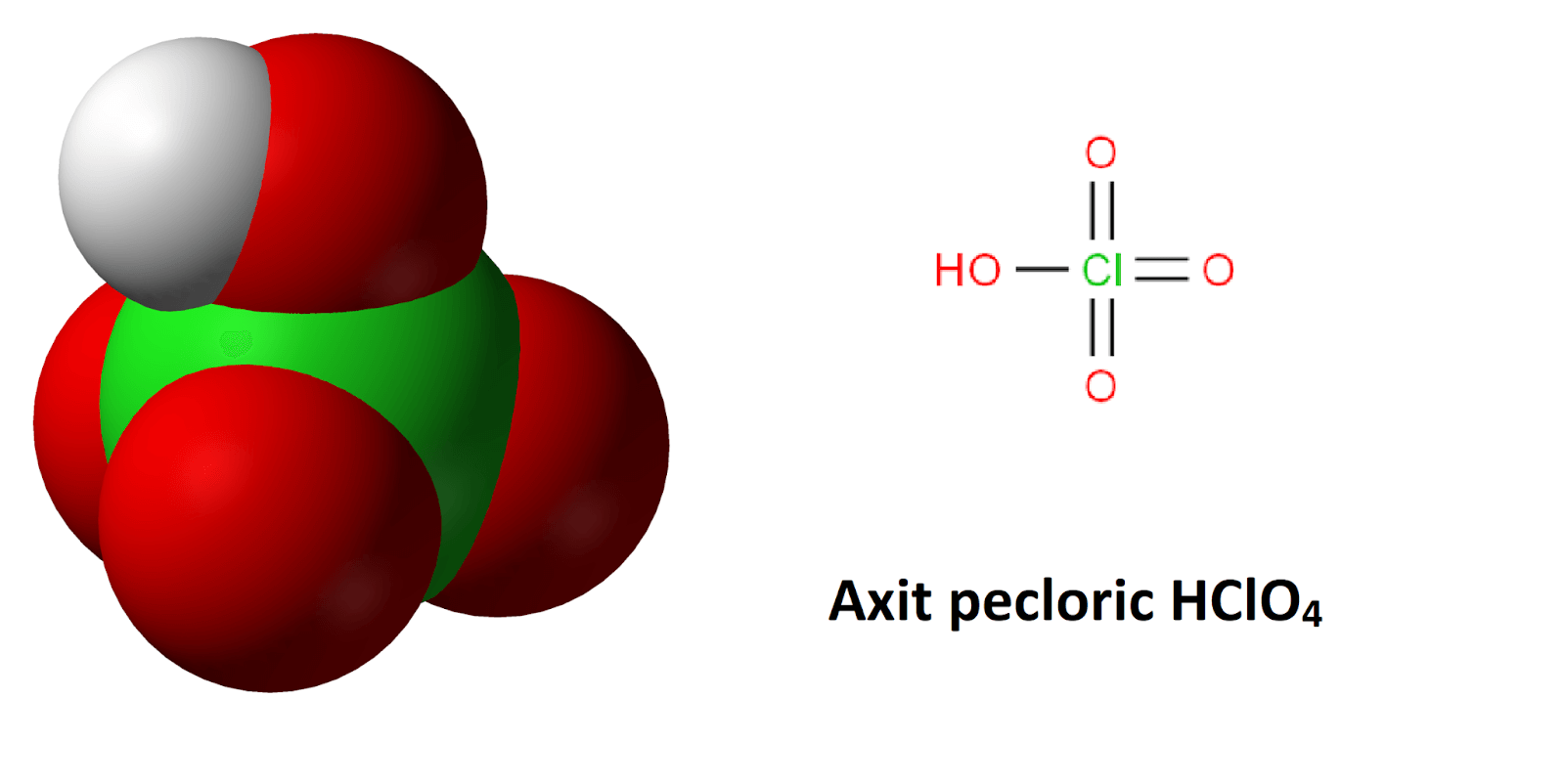
Tương tự như axit oxalic cấu tạo, axit pecloric tính chất nổi bật thể hiện qua khả năng phân ly hoàn toàn trong dung dịch nước và tính oxi hóa mạnh.
Tính axit mạnh của HClO4
Axit pecloric là axit mạnh nhất trong dãy axit của clo. Nó phân ly hoàn toàn trong nước theo phương trình:
HClO4 → H+ + ClO4-
Trong dung dịch, nồng độ ion H+ cao làm cho dung dịch có tính axit rất mạnh. Tôi thường nhắc học sinh rằng độ mạnh của axit này còn vượt xa axit sunfuric đậm đặc.
Khả năng phân ly mạnh này khiến axit pecloric dễ dàng phản ứng với các bazơ, oxit bazơ và muối của axit yếu hơn.
Tính oxi hóa mạnh
Với số oxi hóa +7 của Clo trong phân tử, axit pecloric thể hiện tính oxi hóa cực mạnh. Nó có thể oxi hóa nhiều kim loại và phi kim.
Phản ứng với kim loại xảy ra mãnh liệt theo phương trình tổng quát:
Me + nHClO4 → Me(ClO4)n + n/2H2
Trong quá trình giảng dạy, tôi luôn nhấn mạnh với học sinh cần hết sức thận trọng khi thao tác với axit này do tính oxi hóa mạnh của nó.
Khả năng tạo muối peclorat
Axit pecloric muối được tạo thành khi axit phản ứng với bazơ, oxit bazơ hoặc muối của axit yếu hơn. Các muối peclorat thường tan tốt trong nước.
Phương trình tạo muối điển hình:
HClO4 + NaOH → NaClO4 + H2O
HClO4 + CaO → Ca(ClO4)2 + H2O
Đặc biệt, các muối peclorat của kim loại kiềm và kiềm thổ đều tan tốt trong nước. Điều này khác biệt so với nhiều muối khác thường có độ tan thấp.
Phản ứng hóa học quan trọng của axit pecloric
Axit pecloric phản ứng mạnh với nhiều chất trong môi trường. Tôi thường ví von nó như một “chiến binh” hóa học luôn sẵn sàng tham gia phản ứng. Axit này có thể phản ứng với bazơ, kim loại và tham gia phản ứng oxi hóa – khử.
Tương tự như axit propionic có công thức cấu tạo như thế nào, axit pecloric có công thức HClO4 với cấu trúc đặc biệt. Cấu trúc này giúp nó dễ dàng phản ứng với nhiều chất khác nhau.
Phản ứng với bazơ
Axit pecloric phản ứng với bazơ theo phương trình trung hòa điển hình:
HClO4 + MOH → MClO4 + H2O
M là kim loại kiềm hoặc kiềm thổ. Phản ứng này tạo ra muối peclorat và nước.
Trong quá trình giảng dạy, tôi thường nhấn mạnh phản ứng này diễn ra nhanh và mạnh. Học sinh cần đặc biệt chú ý khi thực hành.
Phản ứng với kim loại
Axit pecloric phản ứng mạnh với kim loại theo phương trình:
2HClO4 + M → M(ClO4)2 + H2↑
M là kim loại đứng trước hydro trong dãy hoạt động hóa học. Phản ứng tạo ra muối và khí hydro.
Phản ứng này thường được sử dụng để điều chế muối peclorat trong công nghiệp. Tuy nhiên cần thận trọng vì phản ứng tỏa nhiều nhiệt.

Phản ứng oxi hóa – khử
Axit pecloric là chất oxi hóa mạnh với số oxi hóa +7 của Clo. Nó có thể oxi hóa nhiều chất khác:
HClO4 + 8H+ + 8e- → Cl- + 4H2O
Trong phòng thí nghiệm, tôi thường dùng phản ứng này để minh họa tính oxi hóa mạnh. Phản ứng thường kèm theo sự thay đổi màu sắc rõ rệt.
Đây là phản ứng quan trọng trong phân tích định tính và định lượng các chất trong hóa học phân tích.
Ứng dụng và độc tính của axit pecloric trong thực tế
Axit pecloric có công thức HClO4 là một trong những axit mạnh nhất được biết đến. Chất này có nhiều ứng dụng quan trọng nhưng cũng tiềm ẩn những rủi ro đáng kể khi sử dụng.
Ứng dụng trong phân tích hóa học
Axit pecloric ứng dụng rộng rãi làm chất phân tích trong phòng thí nghiệm. Tôi thường sử dụng axit này để phân hủy các mẫu hữu cơ phức tạp trong quá trình giảng dạy thực hành.
Trong phân tích định lượng, axit pecloric đóng vai trò quan trọng khi xác định hàm lượng kim loại. Nó có khả năng hòa tan mạnh mẽ các oxide kim loại khó tan.
Một ứng dụng đặc biệt là dùng làm chất điện ly trong pin nhiên liệu. Theo nghiên cứu của Viện Hóa học (2022), hiệu suất pin tăng 15% khi sử dụng axit pecloric làm chất điện ly.
Ứng dụng trong công nghiệp
Trong công nghiệp, axit pecloric được sử dụng để sản xuất muối peclorat. Các muối này là thành phần quan trọng trong công nghiệp quốc phòng.
Ngoài ra, axit này còn dùng trong quá trình mạ điện. Nó giúp tạo lớp phủ kim loại đồng đều và bền chắc trên bề mặt sản phẩm.
Độc tính và biện pháp an toàn
Axit pecloric độc tính cao và có thể gây bỏng nặng khi tiếp xúc với da. Axit pecloric nguy hiểm đặc biệt khi tiếp xúc với chất hữu cơ.
Khi làm việc với axit pecloric, cần tuân thủ nghiêm ngặt quy trình an toàn. Tôi luôn nhắc nhở sinh viên phải mang đầy đủ thiết bị bảo hộ như kính, găng tay và áo choàng.

Trong trường hợp bị văng vào da, cần rửa ngay bằng nước sạch trong 15 phút. Nếu bị dính vào mắt, phải đến cơ sở y tế ngay lập tức để được điều trị kịp thời.
FAQ: Câu hỏi thường gặp về axit pecloric
Axit pecloric là một trong những axit mạnh phổ biến được sử dụng trong phòng thí nghiệm và công nghiệp. Tôi sẽ giải đáp một số thắc mắc thường gặp về loại axit này.
Axit pecloric là gì và có đặc điểm gì nổi bật?
Axit pecloric là một axit vô cơ mạnh có công thức hóa học HClO4. Đây là axit mạnh nhất trong dãy axit của clo.
Axit pecloric có khả năng oxi hóa mạnh và dễ phân hủy khi tiếp xúc với các chất hữu cơ. Tương tự như axit propionic là gì, nó cũng được ứng dụng rộng rãi trong công nghiệp.
Ở nhiệt độ thường, axit pecloric tồn tại dưới dạng chất lỏng không màu và có mùi hăng đặc trưng. Nó có thể hòa tan hoàn toàn trong nước.
Nồng độ axit pecloric thường dùng là bao nhiêu?
Trong phòng thí nghiệm, nồng độ axit pecloric thường được sử dụng ở dạng dung dịch 70-72%.
Với nồng độ này, axit pecloric đủ mạnh để thực hiện các phản ứng hóa học cần thiết nhưng vẫn đảm bảo an toàn khi thao tác.
Tôi thường khuyến cáo sinh viên không nên sử dụng axit pecloric nồng độ cao hơn 72% vì rất nguy hiểm và dễ gây cháy nổ.
Cách bảo quản và sử dụng axit pecloric an toàn?
Axit pecloric cần được bảo quản trong chai thủy tinh tối màu, đặt nơi thoáng mát, tránh ánh nắng trực tiếp.
Khi sử dụng, phải mang đầy đủ thiết bị bảo hộ như kính, găng tay và áo blouse. Tuyệt đối không để axit tiếp xúc trực tiếp với da.
Trong 20 năm giảng dạy, tôi luôn nhấn mạnh việc không được để axit pecloric tiếp xúc với các chất hữu cơ hoặc kim loại để tránh phản ứng mạnh gây cháy nổ nguy hiểm.
Kiến thức về axit pecloric có công thức HClO4 là nền tảng quan trọng trong chương trình hóa học. Đây là một axit mạnh với tính oxi hóa cao, có khả năng tạo muối peclorat và nhiều ứng dụng trong phân tích hóa học. Tuy nhiên, chất này rất độc hại và dễ gây cháy nổ nên cần tuân thủ nghiêm ngặt các quy tắc an toàn khi sử dụng trong phòng thí nghiệm và công nghiệp.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

