Nghiên cứu axit pecloric có công thức và tính chất hóa học cơ bản
Axit pecloric có công thức HClO4 là một trong những axit mạnh nhất. Nó có tính oxi hóa cực mạnh và tạo muối peclorat bền vững. Các phản ứng hóa học đặc trưng của axit này rất đa dạng. Việc sử dụng và bảo quản đòi hỏi các biện pháp an toàn nghiêm ngặt.
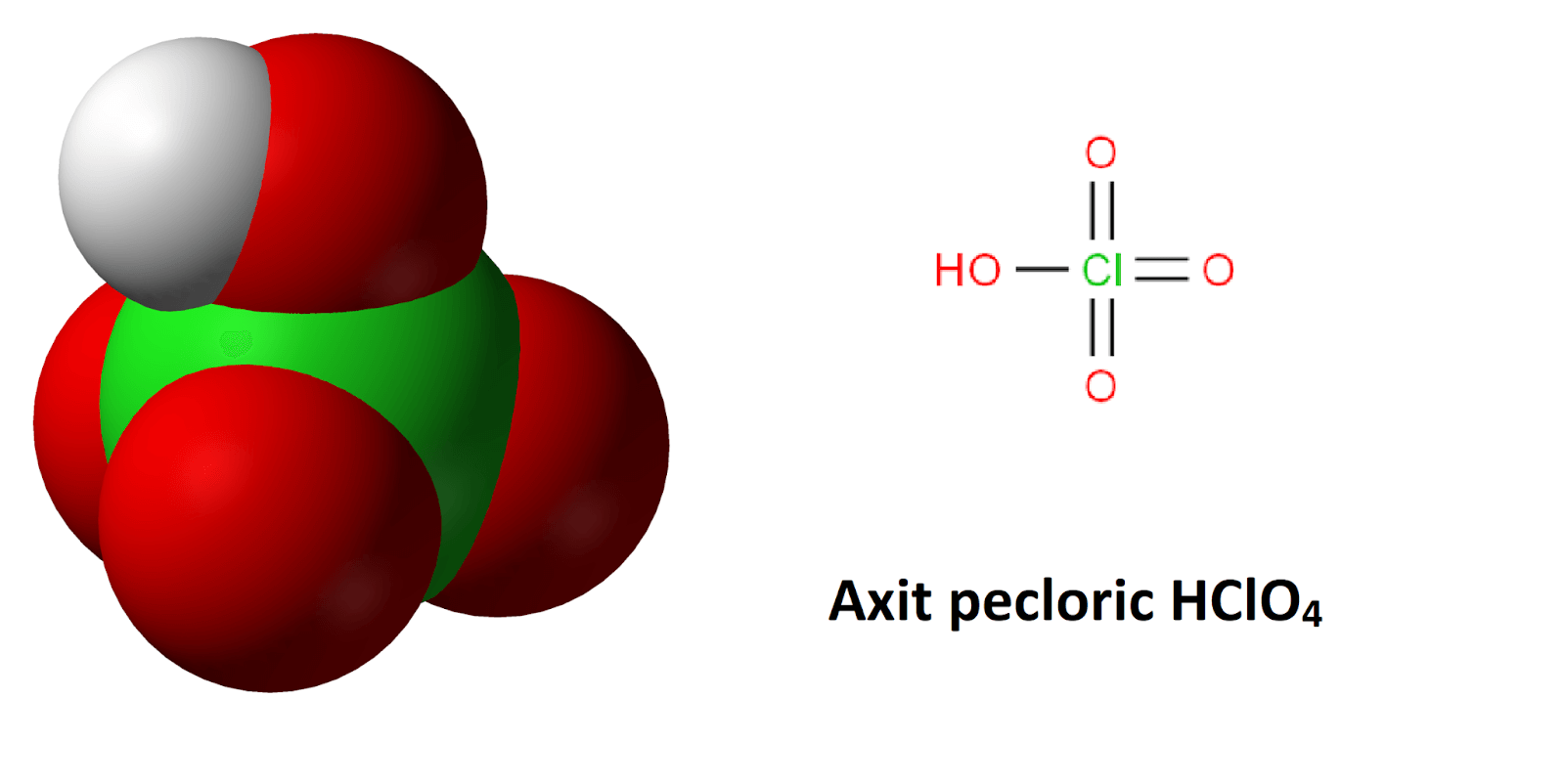
Axit pecloric có công thức HClO4 và cấu tạo phân tử
Axit pecloric có công thức hóa học là HClO4. Đây là một axit mạnh và có tính oxy hóa rất mạnh. Trong phân tử HClO4, nguyên tử Clo có số oxi hóa +7, cao nhất trong các hợp chất của Clo.
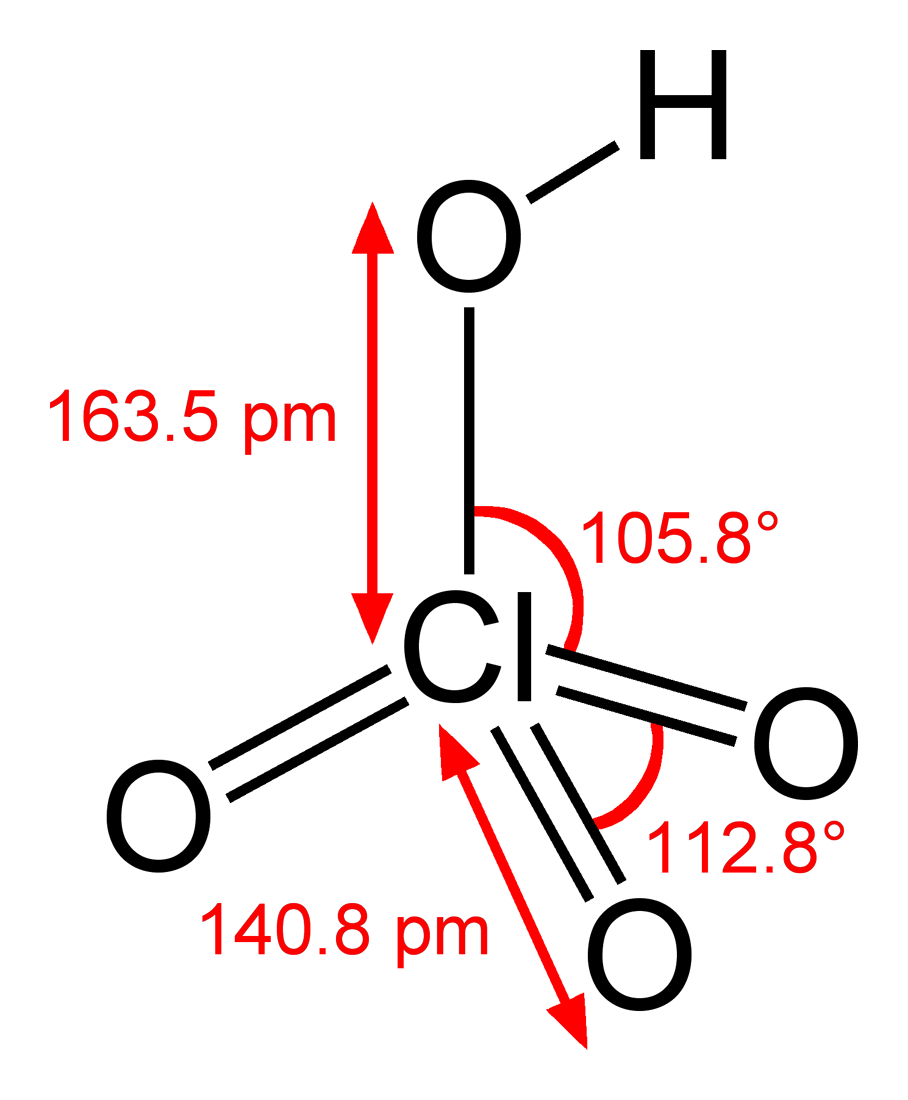
Cấu tạo phân tử của axit pecloric cấu tạo gồm một nguyên tử H liên kết với nhóm ClO4-. Trong đó, nguyên tử Clo ở trung tâm liên kết với 4 nguyên tử O theo dạng tứ diện.
Công thức cấu tạo của HClO4 có thể biểu diễn như sau:
H-O-ClO3
Trong đó:
- Liên kết H-O là liên kết đơn
- Một nguyên tử O liên kết đơn với Cl
- Ba nguyên tử O còn lại liên kết kép với Cl
Tôi thường giúp học sinh ghi nhớ cấu tạo này bằng cách hình dung một “cái ô” với Cl ở giữa, 3 nguyên tử O tạo thành “tán ô” và 1 nguyên tử O gắn với H tạo thành “cán ô”.
Tính chất hóa học đặc trưng của axit pecloric
Axit pecloric là một trong những axit mạnh nhất được biết đến trong hóa học. Nó có nhiều tính chất đặc biệt và ứng dụng quan trọng trong phòng thí nghiệm.
Tương tự như axit oxalic cấu tạo, axit pecloric tính chất nổi bật thể hiện qua khả năng phân ly hoàn toàn trong dung dịch nước và tính oxi hóa mạnh.
Tính axit mạnh của HClO4
Axit pecloric là axit mạnh nhất trong dãy axit của clo. Nó phân ly hoàn toàn trong nước theo phương trình:
HClO4 → H+ + ClO4-
Trong dung dịch, nồng độ ion H+ cao làm cho dung dịch có tính axit rất mạnh. Tôi thường nhắc học sinh rằng độ mạnh của axit tăng dần theo thứ tự: HClO < HClO2 < HClO3 < HClO4.
Tính oxi hóa mạnh
Axit pecloric thể hiện tính oxi hóa mạnh do có số oxi hóa của Clo là +7. Trong phản ứng với các chất khử, nó dễ dàng nhận electron và bị khử về các mức thấp hơn.
Phản ứng điển hình:
2HClO4 + H2S → 2HCl + H2SO4
Kinh nghiệm giảng dạy cho thấy học sinh dễ nhớ tính oxi hóa mạnh khi liên hệ với số oxi hóa cao nhất của Clo.
Khả năng tạo muối peclorat
Axit pecloric muối được tạo thành khi phản ứng với bazơ, oxit bazơ hoặc kim loại. Muối peclorat thường tan tốt trong nước và bền vững.
Phương trình tổng quát:
HClO4 + MOH → MClO4 + H2O
(M là kim loại kiềm)
Các muối peclorat có tính oxi hóa mạnh và được ứng dụng làm chất oxi hóa trong công nghiệp hóa chất.
Các phản ứng hóa học quan trọng của axit pecloric
Axit pecloric phản ứng mạnh với nhiều chất trong môi trường. Đây là một axit mạnh có tính oxi hóa cao, thường được sử dụng trong phòng thí nghiệm và công nghiệp. Tương tự như axit propionic có công thức cấu tạo như thế nào, axit pecloric có công thức HClO4 với cấu trúc đặc biệt.
Phản ứng với bazơ
Axit pecloric phản ứng với bazơ theo cơ chế trung hòa điển hình. Phản ứng này tạo ra muối peclorat và nước:
HClO4 + NaOH → NaClO4 + H2O
Phản ứng xảy ra nhanh chóng và mạnh mẽ do tính axit mạnh của HClO4. Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh về việc cẩn thận khi thực hiện phản ứng này do tính ăn mòn cao.
Phản ứng với kim loại
Khi tiếp xúc với kim loại, axit pecloric phản ứng mạnh giải phóng khí
2HClO4 + Zn → Zn(ClO4)2 + H2↑
Phản ứng này thường được sử dụng để điều chế muối peclorat kim loại. Tuy nhiên cần thận trọng vì phản ứng tỏa nhiệt mạnh và có thể gây nguy hiểm.
Phản ứng oxi hóa – khử
Axit pecloric là chất oxi hóa mạnh nhờ có số oxi hóa +7 của Clo. Phản ứng với chất khử như Fe2+:
Fe2+ + HClO4 → Fe3+ + Cl- + H2O
Trong môi trường axit, phản ứng này diễn ra theo nhiều giai đoạn phức tạp. Kinh nghiệm cho thấy nên thực hiện phản ứng ở nhiệt độ thấp để kiểm soát tốt hơn.
Ứng dụng và độc tính của axit pecloric trong thực tế
Axit pecloric có công thức HClO4 là một trong những axit mạnh nhất được biết đến. Chất này có nhiều ứng dụng quan trọng nhưng cũng tiềm ẩn những rủi ro độc hại cần lưu ý.
Ứng dụng trong công nghiệp và phòng thí nghiệm
Axit pecloric ứng dụng rộng rãi trong phân tích hóa học với vai trò là chất oxy hóa mạnh. Tôi thường sử dụng nó để phân hủy các mẫu hữu cơ khó phân hủy trong phòng thí nghiệm.
Trong công nghiệp, axit pecloric được dùng để sản xuất muối peclorat. Các muối này là thành phần quan trọng trong công nghiệp pháo hoa và nhiên liệu tên lửa.
Một ứng dụng đặc biệt là điện phân với điện cực chì peclorat. Phương pháp này giúp tạo ra lớp phủ chì dioxide bền vững trên bề mặt kim loại.
Nguy cơ độc hại và cách phòng tránh
Axit pecloric độc tính cao và có thể gây bỏng nặng khi tiếp xúc với da. Hơi axit có thể gây kích ứng đường hô hấp nghiêm trọng.
Axit pecloric nguy hiểm khi tiếp xúc với các chất hữu cơ, có thể gây cháy nổ. Theo báo cáo của Viện An toàn và Sức khỏe Nghề nghiệp Mỹ (NIOSH), đã có nhiều vụ tai nạn nghiêm trọng liên quan đến việc sử dụng không đúng cách axit này.

Để đảm bảo an toàn, cần tuân thủ nghiêm ngặt quy trình làm việc với axit pecloric:
- Sử dụng tủ hút chuyên dụng
- Trang bị đầy đủ bảo hộ lao động
- Bảo quản riêng biệt, tránh tiếp xúc với chất hữu cơ
- Xử lý chất thải đúng quy định
FAQ: Câu hỏi thường gặp về axit pecloric
Axit pecloric là gì và các đặc điểm của nó luôn là chủ đề được nhiều người quan tâm. Tôi sẽ giải đáp những thắc mắc phổ biến nhất về loại axit này.
Nồng độ axit pecloric thường dùng là bao nhiêu?
Axit pecloric nồng độ thường được sử dụng ở mức 70-72% trong phòng thí nghiệm. Đây là nồng độ tối ưu cho hầu hết các phản ứng hóa học.
Trong công nghiệp, nồng độ thấp hơn khoảng 50-60% được ưu tiên sử dụng vì tính an toàn. Tôi thường khuyến cáo sinh viên nên bắt đầu với nồng độ thấp trước.
Axit pecloric có những tác dụng gì?
Axit pecloric có công thức HClO4 là chất oxy hóa mạnh trong phân tích hóa học. Tương tự như axit propionic là gì, nó có vai trò quan trọng.
Trong phòng thí nghiệm, axit này dùng để phân tích kim loại và hợp chất vô cơ. Qua 20 năm giảng dạy, tôi nhận thấy đây là thuốc thử không thể thiếu.
Trong công nghiệp, nó được dùng để sản xuất muối peclorat và chất điện phân. Các ứng dụng này đòi hỏi kỹ thuật an toàn nghiêm ngặt.
Cách bảo quản axit pecloric an toàn
Axit pecloric cần được bảo quản trong chai thủy tinh tối màu, tránh ánh sáng trực tiếp. Nhiệt độ lý tưởng là 15-25°C.
Tôi luôn nhắc sinh viên đặt chai axit trong khay nhựa chống tràn. Điều này giúp hạn chế rủi ro khi có sự cố.
Phòng bảo quản phải thông thoáng, tránh xa nguồn nhiệt và chất dễ cháy. Kiểm tra định kỳ tình trạng chai đựng để phát hiện rò rỉ sớm.
Chất hóa học axit pecloric có công thức HClO4 là một axit vô cơ mạnh với tính oxi hóa cao. Nó có cấu trúc phân tử đặc biệt và tham gia nhiều phản ứng quan trọng với bazơ, kim loại. Trong công nghiệp và phòng thí nghiệm, axit này được sử dụng rộng rãi nhưng cần tuân thủ nghiêm ngặt quy tắc an toàn do tính ăn mòn và độc hại của nó. Việc nắm vững tính chất, phản ứng và cách sử dụng an toàn giúp phát huy tối đa giá trị của hợp chất này.
Bài viết liên quan

Tìm hiểu carbohydrate công thức hóa học và phản ứng đặc trưng
Tìm hiểu carbohydrate công thức hóa học qua cấu tạo, phân loại và phản ứng đặc trưng. Khám phá cấu trúc glucozơ, saccarozơ cùng các phương pháp nhận biết đường đơn, đường đôi trong phòng thí nghiệm.

Nắm rõ công thức hóa học của dầu diesel và tính chất quan trọng
Tìm hiểu chi tiết công thức hóa học của dầu diesel, cấu tạo phân tử và thành phần hydrocarbon C10-C22. Khám phá tính chất vật lý, độ cháy, độc tính và ứng dụng trong đời sống.
Kiến thức về natri propionat công thức và ứng dụng trong thực phẩm
Tìm hiểu chi tiết về natri propionat công thức cấu tạo, phương pháp điều chế, tính chất và ứng dụng làm chất bảo quản thực phẩm an toàn, được giải thích đơn giản dễ hiểu.
Nắm kỹ axit lactic công thức và ứng dụng trong đời sống hàng ngày
Tìm hiểu về axit lactic công thức cấu tạo, tính chất hóa học đặc trưng và vai trò quan trọng trong cơ thể. Khám phá ứng dụng trong sản xuất thực phẩm, mỹ phẩm và công nghiệp.
Tổng quan về phenyl acrylat công thức và ứng dụng trong hóa học
Tìm hiểu chi tiết về phenyl acrylat công thức cấu tạo, phương pháp tổng hợp, tính chất vật lý, hóa học và ứng dụng trong công nghiệp polymer. Hướng dẫn điều chế an toàn.
Phân tích công thức cấu tạo C3H6O3 và vai trò của axit lactic trong cơ thể
Tìm hiểu chi tiết công thức cấu tạo C3H6O3 và các dạng đồng phân, đặc biệt là axit lactic phổ biến trong sữa chua và cơ thể. Khám phá tính chất, ứng dụng và vai trò sinh học quan trọng.

