Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Công thức Faraday hóa giúp tính toán chính xác khối lượng chất trong phản ứng điện phân. Các định luật này đóng vai trò nền tảng cho quá trình điện phân trong công nghiệp. Thầy sẽ hướng dẫn chi tiết cách áp dụng công thức qua nhiều bài tập thực tế.
Công thức Faraday hóa học và ý nghĩa trong điện phân
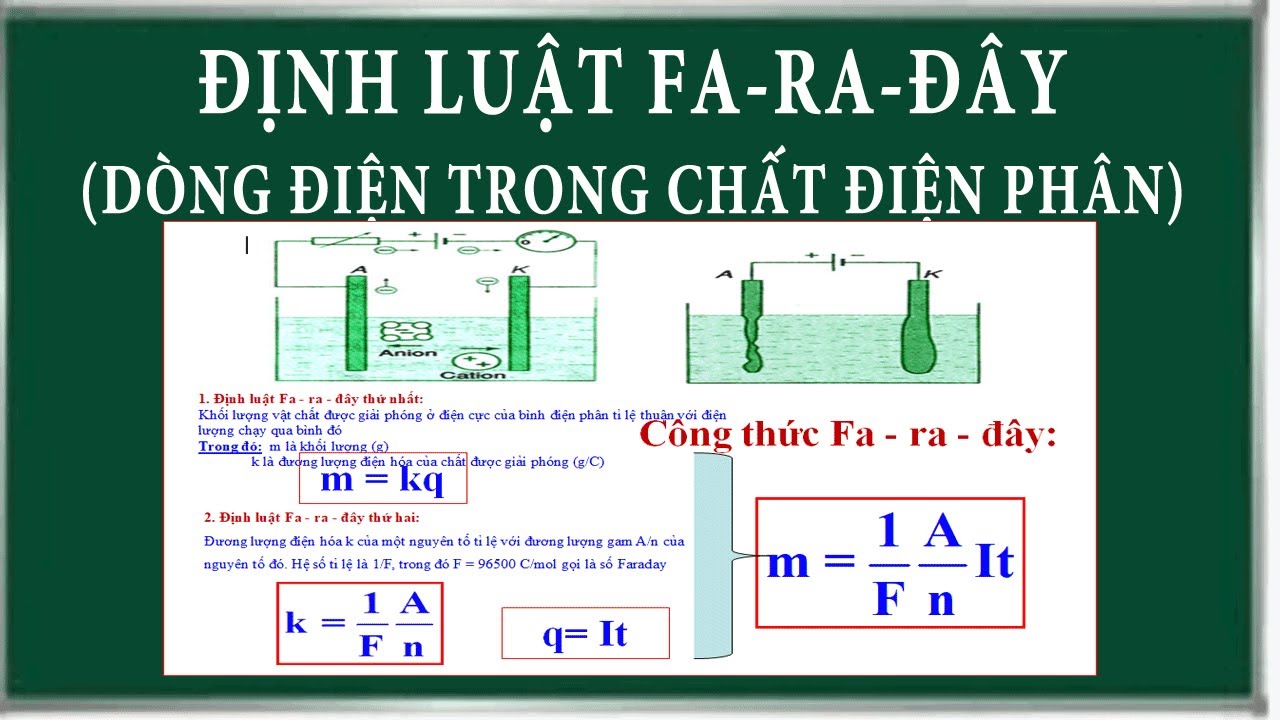
Định luật Faraday là gì – một quy luật quan trọng mô tả mối quan hệ giữa lượng chất điện phân và điện lượng đi qua dung dịch. Tôi thường giải thích cho học sinh bằng ví dụ đơn giản về việc mua sắm – càng nhiều tiền thì mua được càng nhiều hàng.
Công thức Faraday hóa được biểu diễn như sau:
m = (A/nF) × I × t
Trong đó:
- m: khối lượng chất điện phân (g)
- A: khối lượng nguyên tử (g/mol)
- n: hóa trị của ion
- F: hằng số Faraday (96500 C/mol)
- I: cường độ dòng điện (A)
- t: thời gian điện phân (s)
Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường nhầm lẫn giữa A và n. Cách dễ nhớ là A luôn lớn hơn n nhiều lần. Ví dụ với Cu2+, A = 64 g/mol và n = 2.
Công thức này có ý nghĩa rất quan trọng trong công nghiệp điện phân. Nó giúp tính toán chính xác lượng kim loại thu được khi mạ điện hoặc tinh luyện kim loại.

Một ví dụ thực tế là quá trình mạ vàng đồng hồ. Để mạ được lớp vàng 0,001g lên mặt đồng hồ, ta cần dòng điện 0,1A chạy trong 10 phút. Đây là ứng dụng trực tiếp của công thức Faraday.
Các định luật Faraday trong điện phân và cách áp dụng
Định luật Faraday là nền tảng quan trọng trong quá trình điện phân. Các định luật này giúp tính toán chính xác khối lượng chất điện phân và mối quan hệ với điện lượng.
Định luật Faraday 1 về mối quan hệ khối lượng – điện lượng
Định luật Faraday 1 phát biểu: Khối lượng chất điện phân tỉ lệ thuận với điện lượng đi qua dung dịch.
Công thức biểu diễn:
m = k.Q
Trong đó:
- m: khối lượng chất điện phân (g)
- k: hệ số điện hóa (g/C)
- Q: điện lượng (Coulomb)
Tôi thường giảng cho học sinh hiểu đơn giản: Càng cho nhiều điện chạy qua, càng thu được nhiều chất điện phân. Giống như việc càng đổ nhiều nước vào ly thì ly càng đầy vậy.
Định luật Faraday 2 về đương lượng điện hóa
Định luật Faraday 2 hóa học nói về mối liên hệ giữa đương lượng gam của chất và điện lượng cần thiết.
Công thức:
A = F.E
Trong đó:
- A: đương lượng gam của chất
- F: số Faraday (96500 C/mol)
- E: đương lượng điện hóa
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh dễ nhớ công thức này khi liên hệ với Công thức điện phân cơ bản.
Công thức tính khối lượng chất điện phân
Để tính khối lượng chất điện phân, ta áp dụng công thức tổng quát:
m = (A.I.t)/(n.F)
Trong đó:
- m: khối lượng chất (g)
- A: nguyên tử khối
- I: cường độ dòng điện (A)
- t: thời gian (s)
- n: hóa trị
- F: hằng số Faraday
Công thức này kết hợp cả hai định luật trên. Tôi thường hướng dẫn học sinh giải từng bước:
- Xác định hóa trị của ion
- Tính điện lượng Q = I.t
- Áp dụng công thức cuối cùng
Hướng dẫn giải bài tập điện phân theo định luật Faraday
Định luật Faraday là công cụ quan trọng để giải các bài tập Faraday điện phân. Tôi sẽ hướng dẫn chi tiết cách áp dụng định luật này một cách hiệu quả.
Công thức cơ bản của định luật Faraday:
m = (A.I.t)/(n.F)
Trong đó:
- m: khối lượng chất điện phân (g)
- A: khối lượng nguyên tử (g/mol)
- I: cường độ dòng điện (A)
- t: thời gian điện phân (s)
- n: hóa trị của ion
- F: hằng số Faraday (96500 C/mol)
Phương pháp giải bài tập điện phân cơ bản
Bước 1: Xác định chất điện phân và viết phương trình điện phân.
Bước 2: Xác định các thông số trong công thức:
- Khối lượng nguyên tử A từ bảng tuần hoàn
- Hóa trị n từ phương trình điện phân
- Các đại lượng I, t từ đề bài
Bước 3: Áp dụng công thức để cách tính khối lượng điện phân:
m = (A.I.t)/(n.F)

Bài tập mẫu có lời giải chi tiết
Bài toán: Điện phân dung dịch CuSO4 với điện cực trơ, dòng điện 2A trong 30 phút. Tính khối lượng Cu bám vào catot.
Lời giải:
- Phương trình: Cu2+ + 2e → Cu
- Các thông số:
- A(Cu) = 64 g/mol
- n = 2
- I = 2A
- t = 30 x 60 = 1800s
- Áp dụng công thức:
m = (64 x 2 x 1800)/(2 x 96500) = 1,19g Cu
Các dạng bài tập nâng cao và cách giải
Với bài tập nâng cao, ta thường gặp các tình huống phức tạp:
- Điện phân đồng thời nhiều chất:
- Tính toán riêng cho từng chất
- Cộng kết quả cuối cùng
- Điện phân có hiệu suất:
- Tính khối lượng lý thuyết trước
- Nhân với hiệu suất để ra kết quả thực tế
- Điện phân có điện cực tan:
- Xét thêm phản ứng ở anot
- Tính cả khối lượng mất đi ở anot
Ứng dụng định luật Faraday trong thực tiễn
Ứng dụng định luật Faraday được áp dụng rộng rãi trong nhiều lĩnh vực công nghiệp và đời sống. Định luật này giúp tính toán chính xác lượng chất điện phân và thời gian cần thiết cho quá trình điện phân.
Tôi thường ví von định luật Faraday như một “công thức nấu ăn” trong điện phân. Nó cho biết chính xác “nguyên liệu” (dòng điện) cần dùng để có được “món ăn” (sản phẩm điện phân) như ý muốn.
Điện phân nước thu khí H2 và O2
Điện phân nước là gì? Đây là quá trình phân hủy nước thành khí hydro và oxi dưới tác dụng của dòng điện một chiều. Phản ứng xảy ra theo phương trình:
2H2O → 2H2 + O2
Trong quá trình giảng dạy, tôi thường nhấn mạnh với học sinh về tỉ lệ thể tích khí
O2 = 2:1. Điều này giúp các em dễ nhớ và áp dụng vào bài tập.
Điện phân dung dịch NaCl
Điện phân dung dịch NaCl tạo ra nhiều sản phẩm có giá trị công nghiệp. Tại catot (-), ion Na+ nhận electron tạo Na kim loại và phản ứng với nước:
2Na + 2H2O → 2NaOH + H2
Tại anot (+), ion Cl- nhường electron tạo khí Cl2. Sản phẩm chính thu được là NaOH, H2 và Cl2 – những hóa chất quan trọng trong công nghiệp.
Ứng dụng trong công nghiệp mạ điện
Mạ điện là quá trình phủ một lớp kim loại lên bề mặt vật cần mạ nhờ điện phân. Ví dụ khi mạ crôm, ta dùng dung dịch CrO3 làm điện phân.

Kinh nghiệm của tôi cho thấy việc kiểm soát nhiệt độ và mật độ dòng điện rất quan trọng. Nhiệt độ thích hợp khoảng 40-50°C sẽ cho lớp mạ đẹp và bền.
Công nghệ mạ điện ngày nay được ứng dụng rộng rãi trong sản xuất đồ trang sức, phụ tùng ô tô và các thiết bị điện tử.
FAQ: Câu hỏi thường gặp về định luật Faraday
Định luật Faraday là nền tảng quan trọng trong điện hóa học. Tôi sẽ giải đáp những thắc mắc phổ biến nhất về định luật này.
Điều kiện áp dụng định luật Faraday
Định luật Faraday trong hóa học chỉ áp dụng được khi đáp ứng các điều kiện nghiêm ngặt. Điện cực phải là chất dẫn điện tốt và không tham gia phản ứng hóa học.
Dung dịch điện phân cần có nồng độ đủ lớn để dẫn điện tốt. Nhiệt độ và áp suất phải được duy trì ổn định trong suốt quá trình điện phân.
Điện áp đặt vào phải lớn hơn điện thế phân hủy của chất điện phân. Đây là yếu tố quyết định hiệu suất điện phân.
Các sai lầm thường gặp khi giải bài tập
Học sinh thường nhầm lẫn về cách xác định số điện tử trao đổi. Với điện phân dung dịch muối, số điện tử phụ thuộc vào hóa trị của ion.
Một lỗi phổ biến khác là quên kiểm tra điều kiện điện cực trơ. Nếu điện cực hoạt động, phản ứng sẽ khác với lý thuyết.
Việc tính toán thời gian điện phân cũng gây nhiều khó khăn. Cần chú ý đơn vị của cường độ dòng điện và thời gian phải thống nhất.
Mẹo ghi nhớ công thức Faraday
Tôi thường hướng dẫn học sinh ghi nhớ công thức theo cách đơn giản:
m = (A × I × t)/(n × F)
Trong đó:
- m là khối lượng chất (g)
- A là khối lượng nguyên tử (g/mol)
- I là cường độ dòng điện (A)
- t là thời gian (s)
- n là số electron trao đổi
- F là hằng số Faraday (96500 C/mol)
Liên hệ thực tế: Cứ 96500 Coulomb điện tích sẽ giải phóng 1 đương lượng gam chất. Điều này giúp học sinh dễ hình dung và áp dụng công thức.
Việc áp dụng công thức Faraday hóa giúp tính toán chính xác khối lượng chất điện phân và điện lượng cần thiết trong quá trình điện phân. Các định luật Faraday 1, 2 và công thức tính khối lượng chất điện phân tạo nền tảng quan trọng cho nhiều ứng dụng thực tiễn như điện phân nước, muối ăn và mạ điện. Thông qua các bài tập mẫu và phương pháp giải chi tiết, học sinh có thể nắm vững kiến thức cơ bản về điện phân.
Bài viết liên quan

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

Kiến thức về công thức tính thể tích trong hóa học và ứng dụng thực tế
Tổng hợp các công thức tính thể tích trong hóa học với phương pháp tính toán chi tiết cho chất khí, chất lỏng và dung dịch. Hướng dẫn giải bài tập kèm ví dụ thực tế.

