Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Công thức tính nồng độ đương lượng giúp xác định chính xác hàm lượng chất tan trong dung dịch. Các phương pháp tính toán được trình bày chi tiết kèm ví dụ thực tế. Bài viết cung cấp kiến thức từ cơ bản đến nâng cao về đương lượng gam và mối liên hệ với nồng độ mol.
Công thức tính nồng độ đương lượng
Nồng độ đương lượng là một khái niệm quan trọng trong hóa học. Nó cho biết số đương lượng gam chất tan trong 1 lít dung dịch.
Công thức tính nồng độ đương lượng được biểu diễn như sau:
N = n/V = m/(E.V)
Trong đó:
- N: Nồng độ đương lượng (đơn vị đương lượng/lít)
- n: Số đương lượng gam chất tan
- m: Khối lượng chất tan (gam)
- E: Đương lượng gam của chất tan
- V: Thể tích dung dịch (lít)
Để áp dụng công thức này hiệu quả, tôi thường hướng dẫn học sinh theo 3 bước:
- Xác định đương lượng gam (E) của chất tan
- Quy đổi thể tích về đơn vị lít
- Thay số và tính toán
Ví dụ: Hòa tan 4g NaOH trong nước được 500ml dung dịch. Tính nồng độ đương lượng.
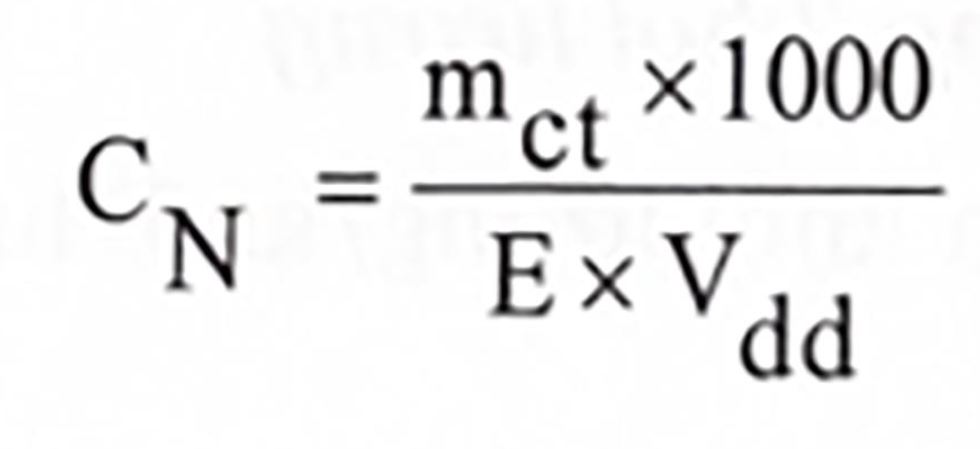
Giải:
- E(NaOH) = M/1 = 40/1 = 40
- V = 500ml = 0,5 lít
- N = 4/(40 × 0,5) = 0,2N
Một lưu ý quan trọng khi sử dụng công thức là phải chú ý đơn vị. Thể tích luôn phải quy về lít và khối lượng về gam để kết quả chính xác.
Nồng độ đương lượng và các khái niệm cơ bản
Nồng độ đương lượng là một khái niệm quan trọng trong hóa học phân tích. Nó giúp xác định chính xác lượng chất tham gia phản ứng.
Việc nắm vững các khái niệm về nồng độ đương lượng sẽ giúp tính toán chính xác trong các phản ứng hóa học, đặc biệt là công thức tính liên kết hidro.
Nồng độ đương lượng là gì và ý nghĩa
Nồng độ đương lượng là số đương lượng gam chất tan trong 1 lít dung dịch. Ký hiệu là N hoặc n.
Công thức tính nồng độ đương lượng:
N = n.z
Trong đó:
- N là nồng độ đương lượng (đvl/l)
- n là nồng độ mol (mol/l)
- z là số electron nhường/nhận trong phản ứng
Ý nghĩa của nồng độ đương lượng thể hiện ở khả năng phản ứng của các chất. Hai dung dịch có cùng nồng độ đương lượng sẽ phản ứng với nhau theo tỉ lệ thể tích 1:1.
Đương lượng gam của chất và cách xác định
Đương lượng gam là khối lượng của chất tương ứng với 1 đương lượng gam hydro trong phản ứng.
Cách xác định đương lượng gam:
E = M/z
Trong đó:
- E là đương lượng gam
- M là khối lượng mol
- z là số electron nhường/nhận
Ví dụ thực tế: Khi tôi giảng dạy về H2SO4, đương lượng gam của nó là 49g/đvl vì M = 98g/mol và z = 2.
Mối liên hệ giữa nồng độ đương lượng và nồng độ mol
Nồng độ đương lượng và nồng độ mol có mối quan hệ chặt chẽ thông qua số electron trao đổi.
Công thức liên hệ:
N = n.z
C = M.N/1000

Trong đó:
- C là nồng độ phần trăm (%)
- M là khối lượng mol
- N là nồng độ đương lượng
Kinh nghiệm giảng dạy cho thấy học sinh thường nhầm lẫn giữa hai khái niệm này. Cần phân biệt rõ nồng độ mol tính theo số mol, còn nồng độ đương lượng tính theo khả năng phản ứng.
Các công thức tính nồng độ đương lượng chi tiết
Nồng độ đương lượng là một khái niệm quan trọng trong hóa học phân tích. Nó cho biết số đương lượng gam chất tan trong 1 lít dung dịch.
Để tính toán chính xác nồng độ đương lượng, cần nắm vững các công thức nồng độ đương lượng cơ bản và cách quy đổi giữa chúng.
Công thức tính nồng độ đương lượng cơ bản

Công thức tổng quát:
N = n/V = m/(E.V)
Trong đó:
- N: Nồng độ đương lượng (đương lượng/lít)
- n: Số đương lượng gam chất tan
- m: Khối lượng chất tan (g)
- E: Đương lượng gam
- V: Thể tích dung dịch (lít)
Khi giảng dạy, tôi thường nhấn mạnh với học sinh rằng công thức này tương tự như công thức tính nồng độ mol, chỉ thay mol bằng đương lượng.
Công thức tính đương lượng gam của acid và base
Đương lượng gam của acid base được tính theo công thức:
Acid: E = M/n
Base: E = M/n
Trong đó:
- E: Đương lượng gam
- M: Phân tử khối
- n: Số H+ có thể cho ra (với acid) hoặc số OH- có thể cho ra (với base)
Việc xác định số H+ và OH- liên quan trực tiếp đến công thức tính số liên kết hóa trị của phân tử.
Quy đổi giữa các dạng nồng độ đương lượng
Quy đổi nồng độ đương lượng giữa các dạng thường gặp:
Từ % sang N:
N = (10d%)/E
Từ M sang N:
N = nM
Trong đó:
- d: Khối lượng riêng của dung dịch (g/ml)
- %: Nồng độ phần trăm
- M: Nồng độ mol
- n: Số H+ hoặc OH- trong phân tử
Kinh nghiệm của tôi cho thấy học sinh thường nhớ công thức quy đổi tốt hơn khi hiểu rõ mối liên hệ giữa các đại lượng.
Hướng dẫn giải bài tập nồng độ đương lượng
Nồng độ đương lượng là một khái niệm quan trọng trong hóa học. Tôi thường giải thích cho học sinh rằng đây là số mol đương lượng gam chất tan trong 1 lít dung dịch.
Để giải các bài tập về nồng độ đương lượng mol/l, cần nắm vững công thức tính và mối liên hệ với công thức tỉ khối.
Việc tính toán đúng số đương lượng gam của chất tan là bước quan trọng nhất. Tương tự như cách xác định công thức tính đồng phân, ta cần phân tích kỹ bài toán.
Phương pháp giải bài tập nồng độ đương lượng mol/l
Bước 1: Xác định số đương lượng gam của chất tan
Z = M/n (M là khối lượng mol, n là số nối)
Bước 2: Áp dụng công thức tính nồng độ đương lượng
N = m/(Z×V) (m là khối lượng chất tan, V là thể tích dung dịch tính bằng lít)
Kinh nghiệm của tôi là học sinh thường nhầm lẫn đơn vị thể tích. Cần đổi đơn vị về lít trước khi tính.
Bài tập mẫu có lời giải chi tiết
Bài toán: Tính cách tính nồng độ đương lượng của dung dịch H2SO4 0,5M.
Giải:
- M(H2SO4) = 98g/mol
- Số nối n = 2
- Z = 98/2 = 49
- N = 0,5 × 2 = 1N
Kết quả: Nồng độ đương lượng của dung dịch H2SO4 0,5M là 1N.
Các dạng bài tập thường gặp và cách giải

Dạng 1: Tính nồng độ đương lượng khi biết nồng độ mol/l
- Xác định số nối
- Nhân nồng độ mol với số nối
Dạng 2: Tính nồng độ đương lượng khi biết khối lượng và thể tích
- Tính số đương lượng gam
- Áp dụng công thức N = m/(Z×V)
Dạng 3: Chuyển đổi giữa các loại nồng độ
- Sử dụng mối liên hệ N = CM × n
- Kiểm tra đơn vị trước khi tính
FAQ: Câu hỏi thường gặp về nồng độ đương lượng
Nồng độ đương lượng là khái niệm quan trọng trong hóa học dung dịch. Qua 20 năm giảng dạy, tôi nhận thấy học sinh thường gặp nhiều thắc mắc về chủ đề này. Cùng tìm hiểu một số câu hỏi phổ biến nhất.
Sự khác biệt giữa nồng độ đương lượng và nồng độ mol
Nồng độ mol thể hiện số mol chất tan trong 1 lít dung dịch. Còn nồng độ đương lượng cho biết số đương lượng gam chất tan trong 1 lít dung dịch.
Nồng độ mol tính theo số mol, không phụ thuộc vào số electron trao đổi. Trong khi nồng độ đương lượng phụ thuộc vào số electron trao đổi trong phản ứng.
Ví dụ với H2SO4, nồng độ mol là 1M nhưng nồng độ đương lượng là 2N vì mỗi phân tử H2SO4 cho 2 ion H+.
Cách quy đổi nồng độ đương lượng sang các nồng độ khác
Công thức quy đổi cơ bản:
N = M × n (với n là số electron trao đổi)
N = C% × d × 10/E (với E là đương lượng gam)
Kinh nghiệm của tôi là học sinh nên ghi nhớ mối quan hệ giữa các đại lượng. Điều này giúp áp dụng công thức dễ dàng hơn.
Những sai lầm thường gặp khi tính nồng độ đương lượng
Sai lầm phổ biến nhất là quên xác định số electron trao đổi. Học sinh thường nhầm lẫn giữa hóa trị và số electron.
Một lỗi khác là không chú ý đơn vị đo. Nồng độ đương lượng có đơn vị đương lượng gam/lít (N) không phải mol/lít.
Tôi thường nhắc học sinh kiểm tra kỹ bài toán có yêu cầu về phản ứng cụ thể nào không. Vì số electron trao đổi phụ thuộc vào từng phản ứng.
Việc áp dụng công thức tính nồng độ đương lượng đòi hỏi sự hiểu biết chính xác về đương lượng gam và mối liên hệ với nồng độ mol. Các công thức tính toán và phương pháp quy đổi nồng độ cần được vận dụng linh hoạt trong từng bài toán cụ thể. Giáo viên và học sinh cần nắm vững các dạng bài tập điển hình để giải quyết tốt các bài toán về nồng độ đương lượng trong chương trình hóa học phổ thông và đại học.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

Kiến thức về công thức tính thể tích trong hóa học và ứng dụng thực tế
Tổng hợp các công thức tính thể tích trong hóa học với phương pháp tính toán chi tiết cho chất khí, chất lỏng và dung dịch. Hướng dẫn giải bài tập kèm ví dụ thực tế.

