Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Công thức tính số liên kết hóa trị giúp xác định chính xác cấu trúc phân tử. Phương pháp này áp dụng cho mọi loại hợp chất hóa học. Các quy tắc đơn giản và dễ nhớ giúp học sinh nắm vững kiến thức cơ bản về liên kết trong phân tử.
Công thức tính số liên kết hóa trị trong hợp chất
Số liên kết hóa trị là một khái niệm quan trọng giúp xác định cấu trúc phân tử của hợp chất. Tôi sẽ giúp các em hiểu rõ cách tính thông số này.
Công thức tính số liên kết hóa trị được xác định bằng tổng số liên kết đơn có trong phân tử. Mỗi liên kết đôi sẽ được tính là 2 liên kết đơn và liên kết ba tính là 3 liên kết đơn.
Công thức tổng quát:
Số liên kết hóa trị = (Tổng hóa trị của các nguyên tố)/2
Ví dụ với phân tử C
– C có hóa trị 4
– H có hóa trị 1 (có 4 nguyên tử H)
- Tổng hóa trị = 4 + (1×4) = 8
- Số liên kết = 8/2 = 4 liên kết
Một kinh nghiệm tôi thường chia sẻ với học sinh là vẽ công thức cấu tạo trước khi tính. Điều này giúp các em hình dung rõ hơn về số liên kết trong phân tử.

Với phân tử phức tạp hơn như C2
– Tổng hóa trị = (4×2) + (1×4) = 12
– Số liên kết = 12/2 = 6 liên kết
- Trong đó có 1 liên kết đôi C=C và 4 liên kết đơn C-H
Việc nắm vững công thức này sẽ giúp các em dễ dàng xác định cấu trúc phân tử và giải các bài tập về liên kết hóa học.
Khái niệm và bản chất của liên kết hóa trị trong phân tử
Liên kết hóa trị là lực liên kết được hình thành khi các nguyên tử dùng chung electron hóa trị. Số liên kết hóa trị là gì? Đó chính là số cặp electron được dùng chung giữa các nguyên tử.
Bản chất của liên kết này là sự xen phủ các orbital nguyên tử chứa electron độc thân. Quá trình này tạo ra orbital phân tử bền vững hơn, giúp các nguyên tử liên kết bền chặt.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về phân tử H2. Hai nguyên tử H mỗi nguyên tử có 1 electron độc thân, khi xen phủ orbital sẽ dùng chung cặp electron tạo liên kết hóa trị trong phân tử.
Định nghĩa và đặc điểm của liên kết hóa trị
Liên kết hóa trị là liên kết được hình thành do sự dùng chung cặp electron giữa hai nguyên tử phi kim. Đây là dạng liên kết phổ biến trong các hợp chất hữu cơ.
Đặc điểm quan trọng của liên kết hóa trị là tính định hướng trong không gian. Góc liên kết được xác định bởi hướng xen phủ các orbital nguyên tử.
Độ bền của liên kết phụ thuộc vào mức độ xen phủ orbital. Càng xen phủ nhiều, liên kết càng bền. Điều này giải thích công thức tính liên kết hidro trong các phân tử.
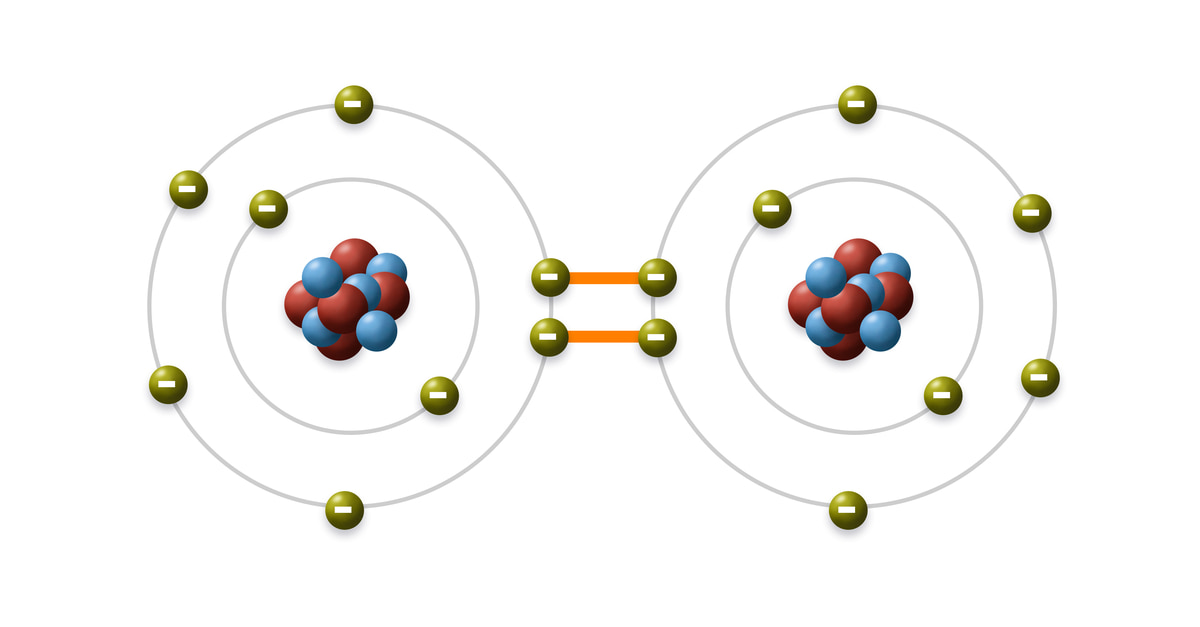
Phân loại các dạng liên kết hóa trị
Liên kết hóa trị có thể phân thành liên kết đơn, đôi và ba dựa trên số cặp electron dùng chung. Liên kết đơn chỉ dùng chung 1 cặp electron.
Liên kết σ (sigma) được hình thành do sự xen phủ trực tiếp theo trục liên kết. Đây là dạng liên kết bền nhất và có trong mọi phân tử.
Liên kết π (pi) hình thành do sự xen phủ bên của các orbital p. Liên kết này xuất hiện trong liên kết đôi và ba, tạo nên tính đặc trưng của các hợp chất không no.
Vai trò của liên kết hóa trị trong cấu tạo phân tử
Liên kết hóa trị quyết định hình dạng không gian của phân tử. Các góc liên kết và độ dài liên kết tạo nên cấu trúc 3D đặc trưng.
Sự phân cực của liên kết hóa trị ảnh hưởng đến tính chất vật lý của phân tử. Phân tử có liên kết phân cực thường có điểm sôi, điểm nóng chảy cao hơn.
Trong các phản ứng hóa học, liên kết hóa trị có thể bị phá vỡ hoặc hình thành mới. Hiểu rõ bản chất liên kết giúp dự đoán được khả năng phản ứng của phân tử.
Phương pháp xác định số liên kết trong các hợp chất
Việc xác định số liên kết trong phân tử là kỹ năng quan trọng để hiểu cấu trúc hóa học. Cách tính số liên kết hóa trị dựa trên nguyên tắc hóa trị và electron hóa trị.
Tôi thường hướng dẫn học sinh bắt đầu bằng việc xác định số electron hóa trị của mỗi nguyên tử. Sau đó tính tổng số liên kết có thể tạo ra.
Ví dụ với phân tử CH4, carbon có 4 electron hóa trị và hydro có 1 electron. Carbon sẽ tạo 4 liên kết đơn với 4 nguyên tử hydro.
Quy tắc đếm liên kết đơn, đôi và ba
Công thức tính liên kết đơn được xác định dựa trên số electron hóa trị chưa tham gia liên kết của các nguyên tử.
Với liên kết đôi, hai nguyên tử chia sẻ 2 cặp electron. Liên kết ba là sự chia sẻ 3 cặp electron.
Trong quá trình giảng dạy, tôi thường lấy ví dụ về công thức tính đồng phân ankan để minh họa cách đếm liên kết.
Phân biệt liên kết σ (sigma) và π (pi)
Tính số liên kết pi và sigma là bước quan trọng để hiểu bản chất liên kết hóa học.
Liên kết σ hình thành khi các orbital chồng lấp trực tiếp theo trục liên kết. Đây là liên kết mạnh nhất.
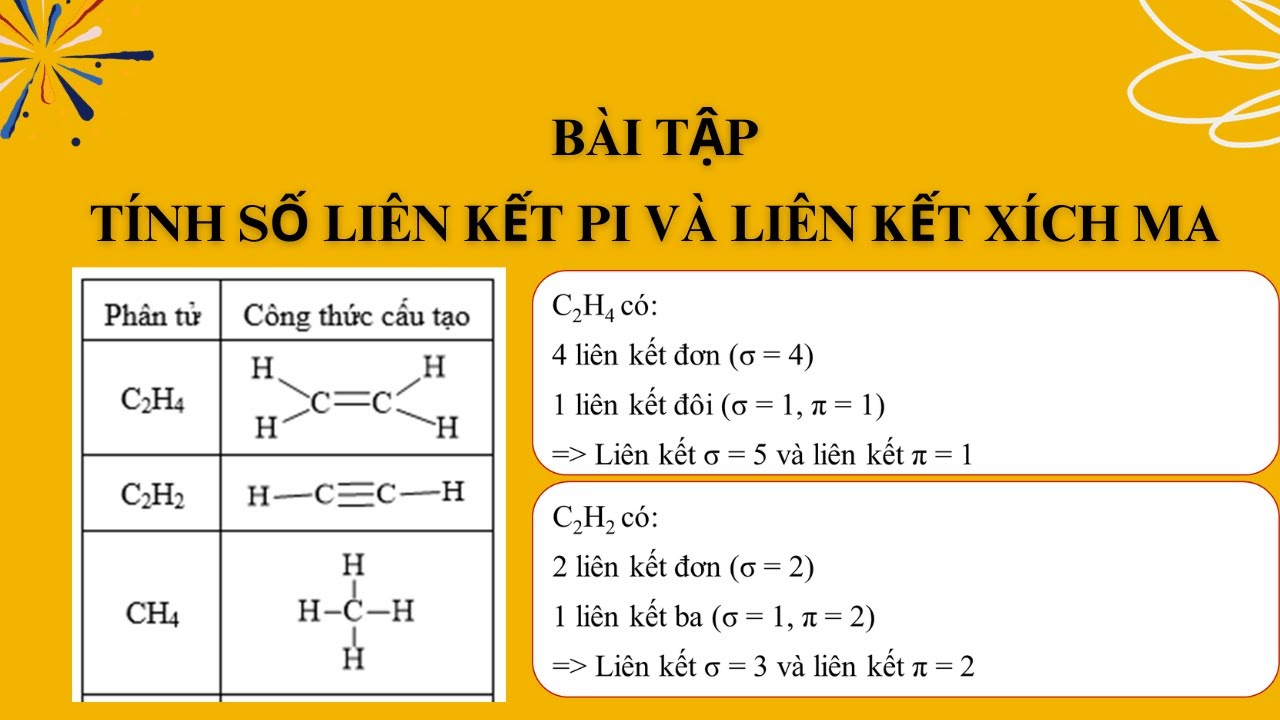
Liên kết π xuất hiện khi orbital p chồng lấp song song với trục liên kết. Liên kết này yếu hơn liên kết σ.
Ứng dụng trong các hợp chất hữu cơ
Việc xác định số liên kết giúp dự đoán tính chất và phản ứng của hợp chất hữu cơ.
Trong alkene, sự có mặt của liên kết đôi C=C quyết định khả năng tham gia phản ứng cộng.
Với alkyne, liên kết ba C≡C tạo điều kiện cho phản ứng trùng hợp xảy ra dễ dàng hơn.
Tính toán số liên kết trong các nhóm hidrocacbon
Hidrocacbon là những hợp chất hữu cơ chỉ chứa carbon và hidro. Việc xác định số liên kết trong ankan anken ankyn giúp ta hiểu rõ cấu trúc phân tử.

Mỗi nguyên tử carbon luôn tạo 4 liên kết hóa trị, còn hidro tạo 1 liên kết. Điều này giúp ta tính được số liên kết trong phân tử.
Đặc điểm liên kết trong ankan
Ankan là hidrocacbon no, chỉ chứa liên kết đơn C-C và C-H. Với công thức phân tử CnH2n+2, ta có:
Số liên kết trong ankan = (n-1) + (2n+2) = 3n+1
Trong đó:
- (n-1) là số liên kết C-C
- (2n+2) là số liên kết C-H
- n là số nguyên tử carbon
Số liên kết trong anken và ankyn
Anken chứa 1 liên kết đôi C=C, ankyn chứa 1 liên kết ba C≡C. Điều này ảnh hưởng đến công thức tính nồng độ đương lượng.
Công thức tính số liên kết:
- Anken (CnH2n): Số liên kết = (n-1) + 2n = 3n-1
- Ankyn (CnH2n-2): Số liên kết = (n-1) + (2n-2) = 3n-3
Bài tập minh họa và phương pháp giải
Bài 1: Tính số liên kết trong phân tử C4H10 (butan)
- Áp dụng công thức ankan: 3n + 1 = 3×4 + 1 = 13 liên kết
- Kiểm tra: 3 liên kết C-C và 10 liên kết C-H
Bài 2: Tính số liên kết trong C3H6 (propen)
- Áp dụng công thức anken: 3n – 1 = 3×3 – 1 = 8 liên kết
- Gồm: 2 liên kết C-C đơn, 1 liên kết C=C và 6 liên kết C-H
Kinh nghiệm của tôi khi giảng dạy là vẽ cấu trúc phân tử để học sinh dễ hình dung và đếm số liên kết.
Bài tập thực hành và phương pháp giải
Việc tính số liên kết hóa trị đóng vai trò quan trọng trong hóa học. Tôi sẽ hướng dẫn các em cách giải nhanh và chính xác các dạng bài tập này.
Các dạng bài tập điển hình
Trong quá trình giảng dạy, tôi thường gặp 3 dạng bài tập chính về liên kết hóa trị:
Dạng 1: Xác định số liên kết trong phân tử đơn giản như H2O, NH3.
Dạng 2: Tính số liên kết trong phân tử có cấu tạo phức tạp như C6H6, CH3COOH.
Dạng 3: So sánh số liên kết giữa các phân tử tương tự nhau.
Phương pháp giải nhanh và chính xác
Quy tắc vàng khi sử dụng công thức tính số liên kết hóa trị là:
Bước 1: Vẽ công thức cấu tạo của phân tử.
Bước 2: Đếm số electron hóa trị của mỗi nguyên tử.
Bước 3: Áp dụng công thức:
Số liên kết = (Tổng số electron hóa trị)/2
Kinh nghiệm của tôi là nên vẽ công thức Lewis để dễ hình dung các liên kết.
Bài tập có lời giải chi tiết
Ví dụ: Tính số liên kết trong phân tử CH4

Lời giải:
- C có 4 electron hóa trị
- H có 1 electron hóa trị
- Tổng số electron = 4 + 4×1 = 8 electron
- Số liên kết = 8/2 = 4 liên kết
Một mẹo nhỏ tôi hay chia sẻ với học sinh: Với các phân tử hydrocarbon, số liên kết thường bằng số nguyên tử hydro cộng với số liên kết giữa các nguyên tử cacbon.
FAQ: Câu hỏi thường gặp về tính số liên kết hóa trị
Khi giảng dạy về số liên kết trong hợp chất hữu cơ, tôi thường nhận được nhiều câu hỏi từ học sinh. Đa số các em gặp khó khăn trong việc xác định và tính toán các liên kết.
Sau đây là những giải đáp chi tiết cho các thắc mắc phổ biến nhất mà tôi đã tổng hợp được qua 20 năm đứng lớp.
Cách phân biệt các loại liên kết trong phân tử
Liên kết đơn là liên kết cộng hóa trị được tạo bởi một cặp electron chung. Nó có năng lượng thấp nhất và bền vững.
Liên kết đôi được tạo bởi hai cặp electron chung giữa hai nguyên tử. Ví dụ điển hình là liên kết C=C trong ethene.
Liên kết ba được hình thành từ ba cặp electron chung. Điển hình là liên kết C≡C trong acetylene. Đây là loại liên kết có năng lượng cao nhất.
Mẹo ghi nhớ công thức tính nhanh
Quy tắc đầu tiên là xác định số electron hóa trị của mỗi nguyên tử. Carbon luôn có 4 electron hóa trị.
Tôi thường hướng dẫn học sinh áp dụng công thức liên kết hóa trị theo công thức:
Số liên kết = (Tổng số electron hóa trị)/2
Một cách ghi nhớ hiệu quả là vẽ sơ đồ Lewis. Phương pháp này giúp hình dung rõ vị trí các electron.
Lỗi thường gặp khi tính số liên kết
Sai lầm phổ biến nhất là quên tính electron tự do. Nhiều học sinh chỉ đếm các liên kết mà bỏ qua electron độc thân.
Lỗi thứ hai là nhầm lẫn giữa liên kết ion và liên kết cộng hóa trị. Cần phân biệt rõ hai loại này dựa vào độ âm điện.
Một số em còn mắc lỗi khi xác định số oxi hóa của các nguyên tố. Điều này dẫn đến tính sai số liên kết.
Việc áp dụng công thức tính số liên kết hóa trị đóng vai trò then chốt trong nghiên cứu cấu trúc phân tử. Các quy tắc xác định liên kết đơn, đôi, ba cùng sự phân biệt liên kết sigma và pi giúp dự đoán chính xác cấu trúc không gian của hợp chất. Phương pháp tính toán số liên kết trong các nhóm hidrocacbon tạo nền tảng vững chắc cho việc phân tích và dự đoán tính chất hóa học của phân tử.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

Kiến thức về công thức tính thể tích trong hóa học và ứng dụng thực tế
Tổng hợp các công thức tính thể tích trong hóa học với phương pháp tính toán chi tiết cho chất khí, chất lỏng và dung dịch. Hướng dẫn giải bài tập kèm ví dụ thực tế.

