Kiến thức về công thức tính thể tích trong hóa học và ứng dụng thực tế
Công thức tính thể tích trong hóa học là kiến thức nền tảng quan trọng trong chương trình phổ thông. Thầy giáo hướng dẫn chi tiết cách áp dụng công thức cho từng dạng bài tập cụ thể. Các phương pháp tính toán được đơn giản hóa giúp học sinh dễ dàng ghi nhớ và vận dụng.
Công thức tính thể tích trong hóa học
Trong hóa học, công thức tính thể tích trong hóa học là một phần quan trọng giúp xác định kích thước không gian của chất.
Với chất khí, thể tích được tính theo công thức:
V = nRT/P
Trong đó:
- V: thể tích (đơn vị lít – L)
- n: số mol chất khí
- R: hằng số khí lý tưởng (0,082 atm.L/mol.K)
- T: nhiệt độ tuyệt đối (K)
- P: áp suất (atm)
Với dung dịch, thể tích được tính theo công thức:
V = m/d
Trong đó:
- V: thể tích (đơn vị ml hoặc L)
- m: khối lượng chất (g)
- d: khối lượng riêng (g/ml hoặc g/L)
Qua 20 năm giảng dạy, tôi thường hướng dẫn học sinh ghi nhớ công thức theo cách đơn giản:
- Với khí: “Thể tích tỉ lệ thuận với số mol và nhiệt độ, tỉ lệ nghịch với áp suất”
- Với dung dịch: “Thể tích bằng khối lượng chia cho khối lượng riêng”
Ví dụ thực tế: Tính thể tích 2 mol khí O2 ở 27°C và áp suất 1 atm.
Giải:
T = 27 + 273 = 300K
V = (2 × 0,082 × 300)/1 = 49,2L
Kết quả cho thấy 2 mol khí O2 chiếm thể tích 49,2L trong điều kiện đã cho.
Các công thức tính thể tích cơ bản trong hóa học
Thể tích là một đại lượng quan trọng trong hóa học. Việc nắm vững các công thức tính thể tích khí và công thức tính thể tích dung dịch giúp học sinh giải quyết nhiều bài toán hóa học phức tạp.
Công thức tính thể tích chất khí
Thể tích chất khí phụ thuộc vào nhiệt độ và áp suất. Công thức tính thể tích chất khí ở điều kiện tiêu chuẩn là:
V = (n × R × T)/P
Trong đó:
- V: thể tích khí (lít)
- n: số mol khí
- R: hằng số khí (0,082 atm.L/mol.K)
- T: nhiệt độ tuyệt đối (K)
- P: áp suất (atm)
Kinh nghiệm 20 năm giảng dạy cho thấy học sinh thường nhầm lẫn đơn vị nhiệt độ. Cần chuyển từ độ C sang độ K bằng cách cộng thêm 273.

Công thức tính thể tích chất lỏng
Thể tích chất lỏng được tính bằng công thức:
V = m/d
Trong đó:
- V: thể tích (ml hoặc cm3)
- m: khối lượng (g)
- d: khối lượng riêng (g/ml hoặc g/cm3)
Với chất lỏng, nhiệt độ ảnh hưởng không đáng kể đến thể tích. Tuy nhiên cần ghi rõ nhiệt độ khi đo khối lượng riêng.
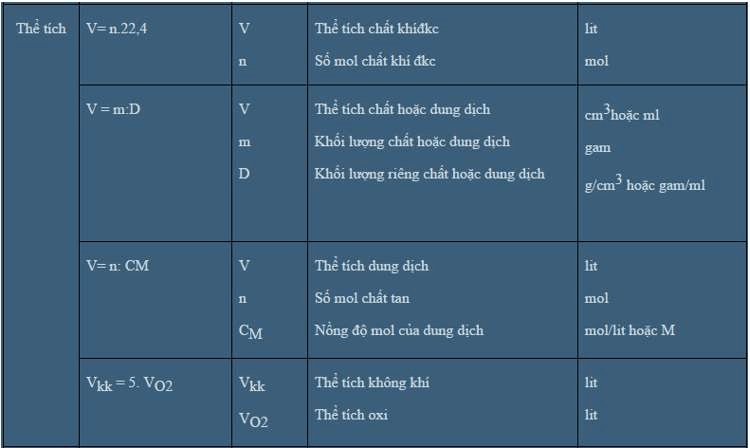
Công thức tính thể tích dung dịch
Dung dịch là hỗn hợp của chất tan và dung môi. Để tính thể tích dung dịch, ta sử dụng công thức tính nồng độ đương lượng.
V = m/(C × d)
Trong đó:
- V: thể tích dung dịch (lít)
- m: khối lượng chất tan (g)
- C: nồng độ mol/lít
- d: khối lượng riêng dung dịch (g/ml)
Lưu ý khi pha loãng dung dịch, thể tích dung dịch sau pha loãng luôn lớn hơn thể tích dung dịch ban đầu.
Công thức tính thể tích trong các phản ứng hóa học
Việc tính toán thể tích trong các phản ứng hóa học là kỹ năng quan trọng với mọi học sinh. Công thức tính thể tích trong hóa học giúp xác định chính xác lượng chất tham gia và sản phẩm.

Để tính toán chính xác, cần nắm vững công thức tính số liên kết hóa trị và các công thức v cơ bản. Tôi sẽ phân tích chi tiết từng trường hợp cụ thể.
Thể tích trong phản ứng tạo khí
Khi tính thể tích khí, ta áp dụng phương trình trạng thái khí lý tưởng:
PV = nRT
Trong đó:
- P: áp suất (atm)
- V: thể tích (lít)
- n: số mol
- R: hằng số khí (0.082 atm.L/mol.K)
- T: nhiệt độ (K)
Ở điều kiện tiêu chuẩn (0°C, 1 atm), 1 mol khí chiếm thể tích 22.4 lít. Đây là con số quan trọng cần nhớ.
Thể tích trong phản ứng dung dịch
Khi tính thể tích dung dịch, ta sử dụng công thức:
V = m/d
Trong đó:
- V: thể tích dung dịch (ml hoặc L)
- m: khối lượng dung dịch (g)
- d: khối lượng riêng (g/ml hoặc g/L)
Với dung dịch loãng, có thể coi khối lượng riêng xấp xỉ bằng 1 g/ml. Kinh nghiệm của tôi là nên quy đổi đơn vị về cùng hệ đo trước khi tính.
Thể tích trong phản ứng đốt cháy
Phản ứng đốt cháy thường tạo CO2 và H2O. Ta tính thể tích theo tỷ lệ:
- mol C → 1 mol CO2 (22.4L ở đktc)
- mol H2 → 1 mol H2O
Lưu ý quan trọng khi tính:
- Xác định số mol C và H trong phân tử ban đầu
- Áp dụng tỷ lệ mol tương ứng
- Quy đổi về thể tích ở điều kiện cần tính
Kinh nghiệm 20 năm dạy học cho thấy học sinh thường nhầm lẫn khi không ghi rõ điều kiện nhiệt độ và áp suất.
Ứng dụng công thức tính thể tích trong thực tế
Việc áp dụng công thức tính thể tích hình trụ rất quan trọng trong phòng thí nghiệm hóa học. Tôi thường hướng dẫn học sinh tính toán chính xác thể tích để pha chế dung dịch và thu khí.
Trong quá trình giảng dạy 20 năm, tôi nhận thấy sinh viên thường gặp khó khăn khi áp dụng công thức tính v trong hóa học. Việc nắm vững các công thức cơ bản sẽ giúp các em tự tin hơn trong thực hành.
Tính thể tích hình trụ trong phòng thí nghiệm
Để tính thể tích ống nghiệm hình trụ, ta áp dụng công thức:
V = πr²h
Trong đó:
- V là thể tích (đơn vị cm³)
- r là bán kính đáy (đơn vị cm)
- h là chiều cao (đơn vị cm)
Khi thực hành, tôi thường khuyên học sinh đo kỹ bán kính và chiều cao trước khi tính toán. Một sai số nhỏ có thể dẫn đến kết quả sai lệch lớn.
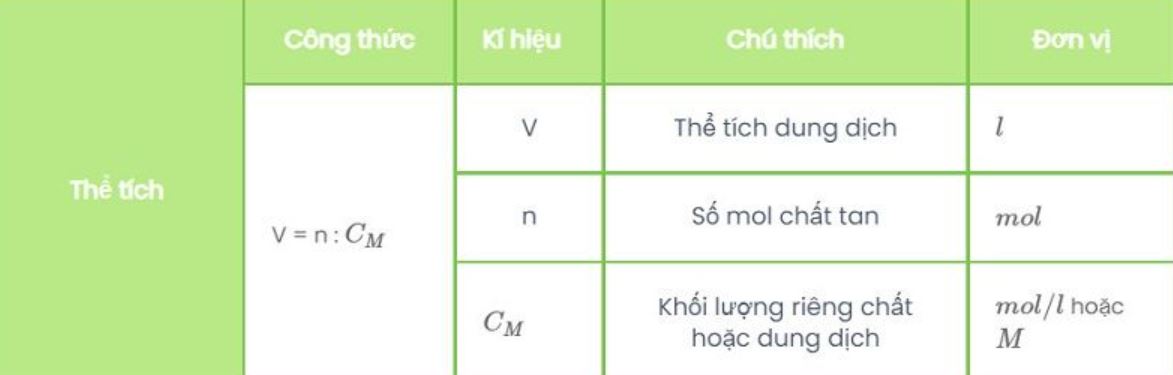
Tính thể tích dung dịch pha chế
Khi pha chế dung dịch công thức ure, cần tính chính xác thể tích nước cần thêm vào. Công thức tính thể tích dung dịch:
V₁C₁ = V₂C₂
Trong đó:
- V₁, C₁: thể tích và nồng độ ban đầu
- V₂, C₂: thể tích và nồng độ sau pha loãng
Kinh nghiệm của tôi là nên pha loãng từ dung dịch đậm đặc sang loãng để tránh lãng phí hóa chất.
Tính thể tích khí sinh ra
Để tính thể tích khí sinh ra trong phản ứng, ta cần biết công thức tỉ khối và áp dụng phương trình:
V = nRT/P
Trong đó:
- V: thể tích khí (lít)
- n: số mol khí
- R: hằng số khí lý tưởng
- T: nhiệt độ (K)
- P: áp suất (atm)
Tôi thường nhắc học sinh chú ý đơn vị và điều kiện tiêu chuẩn khi tính toán thể tích khí. Việc quy đổi đơn vị không chính xác sẽ dẫn đến sai số lớn.
Bài tập và phương pháp giải về thể tích trong hóa học
Việc nắm vững công thức tính thể tích trong hoá học là yếu tố quan trọng để giải quyết các bài tập. Tôi sẽ chia sẻ kinh nghiệm giảng dạy thực tế qua các dạng bài tập phổ biến.
Bài tập về thể tích chất khí
Khi giải bài tập về thể tích khí, cần áp dụng phương trình trạng thái khí lý tưởng:
PV = nRT
Trong đó:
- P: áp suất (atm)
- V: thể tích (lít)
- n: số mol
- R: hằng số khí (0,082 atm.L/mol.K)
- T: nhiệt độ (K)
Ví dụ: Tính thể tích 2 mol khí O2 ở 27°C và 2 atm.
V = nRT/P = 2 × 0,082 × 300/2 = 24,6 lít
Bài tập về thể tích dung dịch
Với dung dịch, ta sử dụng công thức thể tích hoá học cơ bản:
C1V1 = C2V2
Trong đó:
- C1, C2: nồng độ ban đầu và sau pha loãng
- V1, V2: thể tích ban đầu và sau pha loãng
Khi giải bài tập loại này, việc chuyển đổi đơn vị chính xác rất quan trọng. Tôi thường hướng dẫn học sinh kiểm tra kỹ đơn vị trước khi tính toán.
Bài tập tổng hợp
Nhiều bài tập phức tạp đòi hỏi kết hợp nhiều công thức. Để giải nhanh, có thể tham khảo công thức tính nhanh đồng phân.
Một số lưu ý quan trọng:
- Xác định rõ trạng thái vật chất (khí/lỏng/rắn)
- Chuyển đổi đơn vị phù hợp
- Kiểm tra tính hợp lý của kết quả
Qua 20 năm giảng dạy, tôi nhận thấy việc vẽ sơ đồ giải và ghi chú các bước tính toán giúp học sinh tránh sai sót hiệu quả.
FAQ: Câu hỏi thường gặp về công thức tính thể tích trong hóa học
Trong quá trình giảng dạy hóa học, tôi thường nhận được nhiều câu hỏi về công thức tính thể tích hoá học. Đây là những thắc mắc phổ biến nhất mà học sinh hay gặp phải.
Q: Làm sao để tính thể tích khí trong điều kiện tiêu chuẩn?
A: Áp dụng phương trình trạng thái khí lý tưởng PV = nRT, với R = 0,082 atm.L/mol.K. Ở điều kiện tiêu chuẩn (1 atm, 273K), 1 mol khí chiếm thể tích 22,4L.
Q: Công thức tính thể tích dung dịch khi pha loãng?
A: Sử dụng công thức C1V1 = C2V2, trong đó C là nồng độ và V là thể tích của dung dịch trước và sau khi pha loãng.
Q: Cách tính thể tích dung dịch từ khối lượng chất tan?
A: Áp dụng công thức tính v hóa học: V = m/(C.d), với m là khối lượng chất tan, C là nồng độ phần trăm, d là khối lượng riêng.
Q: Làm sao xác định thể tích khí sinh ra từ phản ứng?
A: Dùng định luật Gay-Lussac về thể tích khí: Tỉ lệ thể tích các khí tham gia phản ứng bằng tỉ lệ hệ số cân bằng.
Q: Cách tính thể tích dung dịch khi trộn hai dung dịch cùng chất?
A: Thể tích tổng = V1 + V2, nồng độ mới = (C1V1 + C2V2)/(V1 + V2).
Việc áp dụng chính xác công thức tính thể tích trong hóa học đóng vai trò then chốt trong các phản ứng hóa học và thực hành thí nghiệm. Các công thức tính thể tích khí, chất lỏng và dung dịch giúp học sinh nắm vững cách tính toán cơ bản. Thông qua các bài tập thực hành về thể tích chất khí, dung dịch và phản ứng đốt cháy, học sinh có thể vận dụng kiến thức vào giải quyết các bài toán hóa học thực tế.
Bài viết liên quan
Tổng quan công thức Faraday hóa và ứng dụng trong điện phân
Tìm hiểu chi tiết về công thức Faraday hóa học trong điện phân, cách áp dụng định luật và giải bài tập với phương pháp đơn giản. Hướng dẫn tính toán khối lượng chất điện phân chuẩn xác.

Thông tin chi tiết về công thức tỉ khối và cách áp dụng trong hóa học
Tìm hiểu công thức tỉ khối và cách áp dụng trong hóa học. Bài viết giải thích chi tiết các loại tỉ khối, phương pháp xác định và bài tập thực hành cho học sinh dễ hiểu.

Tổng quan công thức tính nồng độ đương lượng và cách áp dụng
Tìm hiểu chi tiết công thức tính nồng độ đương lượng, cách xác định đương lượng gam và giải bài tập với phương pháp đơn giản. Bao gồm công thức, ví dụ và bài tập mẫu có lời giải.
Tổng quan công thức tính số liên kết hóa trị và cách áp dụng chuẩn xác
Hướng dẫn công thức tính số liên kết hóa trị và phương pháp xác định chính xác các loại liên kết trong phân tử hữu cơ. Giải thích chi tiết cách tính liên kết σ, π kèm bài tập minh họa.
Phân tích công thức tính liên kết hidro và ứng dụng trong hóa học
Tìm hiểu công thức tính liên kết hidro và cách áp dụng trong các phân tử, gen, protein. Giải thích chi tiết bản chất, vai trò quan trọng trong nước, rượu và axit nucleic.

Công thức tính đồng phân và cách xác định nhanh các dạng đồng phân hóa học
Tìm hiểu công thức tính đồng phân và phương pháp xác định nhanh số đồng phân trong hóa học. Hướng dẫn chi tiết cách tính đồng phân ankan, ancol kèm bài tập và mẹo giải nhanh cho học sinh.

