Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Axit nitrơ công thức HNO2 là một chất quan trọng trong hóa học. Chất này có cấu tạo đặc biệt với liên kết N-O và tính chất đa dạng. Nó tham gia nhiều phản ứng hóa học cơ bản và ứng dụng rộng rãi trong công nghiệp. Các phương pháp nhận biết và bảo quản axit nitrơ rất cần thiết trong phòng thí nghiệm.
Axit nitrơ công thức và cấu tạo phân tử
Axit nitrơ có công thức phân tử là HNO2. Đây là một axit yếu thường tồn tại ở dạng dung dịch trong nước.
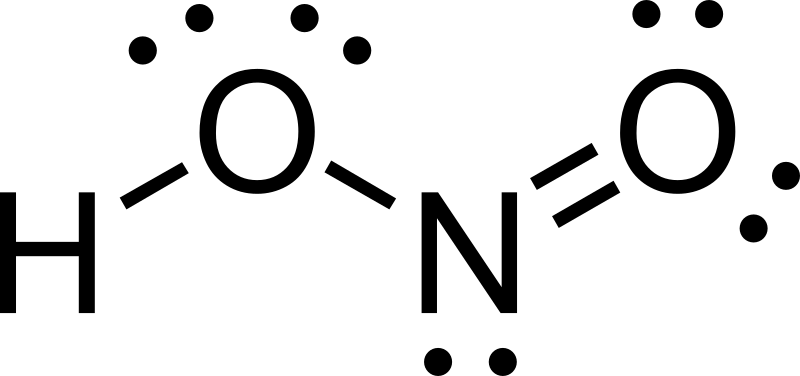
Về cấu tạo phân tử, axit nitrơ công thức cấu tạo là H-O-N=O. Nguyên tử nitơ liên kết với 2 nguyên tử oxi và 1 nhóm OH.
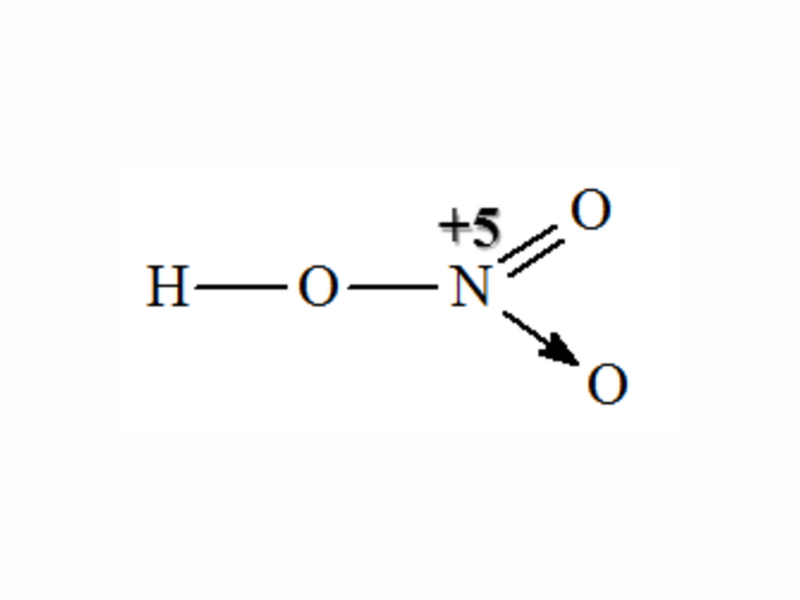
Trong phân tử HNO2, nguyên tử N có số oxi hóa +3. Điều này khiến axit nitơ là gì trở thành một chất có tính oxi hóa khá mạnh.
Tôi thường giảng cho học sinh về cấu tạo axit nitơ bằng cách so sánh với axit citric công thức cấu tạo. Hai axit này có điểm chung là đều chứa nhóm OH.
Khi phân ly trong nước, HNO2 cho ion H+ và ion NO2-:
HNO2 ⇌ H+ + NO2-
Một điều thú vị là axit nitrơ không bền, dễ phân hủy thành NO và NO2 theo phương trình:
2HNO2 → NO + NO2 + H2O
Trong phòng thí nghiệm, tôi thường hướng dẫn học sinh điều chế HNO2 bằng cách cho muối nitrit tác dụng với axit mạnh hơn như H2SO4.
Tính chất hóa học của axit nitrơ HNO2
Axit nitơ HNO2 là một axit yếu có tính chất đặc biệt. Nó vừa thể hiện tính axit, vừa có khả năng oxi hóa và khử trong các phản ứng hóa học.
Trong quá trình giảng dạy, tôi thường ví von HNO2 như một “diễn viên đa năng” trong hóa học. Nó có thể đóng nhiều vai trò khác nhau tùy vào điều kiện phản ứng.
Tính axit của HNO2
HNO2 là axit yếu có độ điện ly thấp trong nước. Phương trình điện ly:
HNO2 ⇌ H+ + NO2-
Ka = 4,5.10-4 (25°C)
Tương tự như axit pecloric tính chất, HNO2 tác dụng được với bazơ tạo muối nitrit và nước:
HNO2 + NaOH → NaNO2 + H2O
Tính oxi hóa của HNO2
HNO2 có thể oxi hóa nhiều chất khử như KI, SO2 hay H2S. Trong môi trường axit:
2HNO2 + 2KI + H2SO4 → 2NO + I2 + K2SO4 + 2H2O
Nitrogen trong HNO2 bị khử từ +3 thành +2 trong NO. Đây là phản ứng định tính quan trọng để nhận biết ion NO2-.
Tính khử của HNO2
Tương tự như glycerin tính chất, HNO2 cũng thể hiện tính khử đặc trưng. Nó bị các chất oxi hóa mạnh như KMnO4 oxi hóa:
5HNO2 + 2KMnO4 + 3H2SO4 → 5HNO3 + 2MnSO4 + K2SO4 + 3H2O
Nitrogen trong HNO2 bị oxi hóa từ +3 thành +5 trong HNO3. Phản ứng này thường được sử dụng để điều chế HNO3 trong phòng thí nghiệm.
Phản ứng hóa học của axit nitrơ với các chất
Axit nitrơ là một axit yếu có tính oxi hóa mạnh. Nó tham gia nhiều phản ứng hóa học quan trọng với các chất khác nhau.
Tôi sẽ phân tích chi tiết các phản ứng chính của axit nitrơ công thức HNO2 với các nhóm chất cơ bản.
Phản ứng với bazơ
Axit nitơ tác dụng với bazơ theo phản ứng trung hòa tạo muối nitrit và nước:
HNO2 + NaOH → NaNO2 + H2O
Phản ứng này diễn ra nhanh và hoàn toàn ở nhiệt độ thường. Muối nitrit tạo thành thường tan tốt trong nước.
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý cân bằng phương trình và xác định tỉ lệ mol phản ứng.
Phản ứng với muối
Axit nitơ tác dụng với muối theo phản ứng trao đổi ion tạo axit mới và muối mới:
HNO2 + Na2CO3 → NaNO2 + H2O + CO2↑
Phản ứng chỉ xảy ra khi tạo thành sản phẩm khó tan hoặc bay hơi. Giống như Công thức axit salicylic, đây là phản ứng quan trọng trong phòng thí nghiệm.

Phản ứng với kim loại
Axit nitơ tác dụng với kim loại hoạt động mạnh giải phóng khí NO và tạo muối:
3Cu + 8HNO2 → 3Cu(NO2)2 + 2NO + 4H2O
Phản ứng này thường đi kèm với sự tạo thành khí NO màu nâu đỏ.
Cần lưu ý học sinh về tính chất oxi hóa của axit nitrơ trong phản ứng này.
Phản ứng với oxi
Axit nitơ tác dụng với oxi theo phản ứng oxi hóa khử tạo axit nitric:
2HNO2 + O2 → 2HNO3
Phản ứng này diễn ra chậm ở nhiệt độ thường.
Trong không khí ẩm, axit nitrơ dễ bị oxi hóa thành axit nitric.
Ứng dụng của axit nitrơ trong công nghiệp và đời sống
Axit nitrơ công thức HNO2 là một hợp chất quan trọng với nhiều ứng dụng đa dạng. Hợp chất này đóng vai trò then chốt trong nhiều quy trình sản xuất công nghiệp và đời sống.
Trong lĩnh vực công nghiệp, axit nitơ trong công nghiệp được sử dụng rộng rãi làm chất xúc tác và tác nhân chuyển hóa. Tôi thường ví von nó như “chìa khóa vạn năng” mở ra nhiều phản ứng hóa học hữu ích.
Sản xuất muối nitrit
Axit nitrơ là nguyên liệu chính để sản xuất các muối nitrit quan trọng. Phản ứng giữa axit nitrơ với bazơ tạo ra muối nitrit tương ứng:
HNO2 + NaOH → NaNO2 + H2O
Muối natri nitrit được sử dụng phổ biến trong công nghiệp thực phẩm làm chất bảo quản. Nó giúp ngăn chặn sự phát triển của vi khuẩn gây hại và duy trì màu sắc thực phẩm.
Tổng hợp hợp chất hữu cơ
Axit nitrơ đóng vai trò quan trọng trong tổng hợp nhiều hợp chất hữu cơ có giá trị. Nó tham gia phản ứng với triglixerit là gì tạo ra các sản phẩm như xenlulozơ trinitrat công thức.
Trong phòng thí nghiệm, axit nitrơ thường được sử dụng làm tác nhân nitro hóa. Phản ứng này tạo ra các dẫn xuất nitro có ứng dụng trong công nghiệp dược phẩm và hóa chất.
Ứng dụng trong công nghiệp thực phẩm
Axit nitrơ và muối nitrit được sử dụng rộng rãi trong chế biến thịt. Chúng giúp bảo quản thịt và tạo màu đỏ hồng đặc trưng cho các sản phẩm thịt chế biến.
Theo nghiên cứu của Viện Công nghệ Thực phẩm, hàm lượng nitrit cho phép trong thực phẩm là 30-150ppm. Mức này đảm bảo an toàn cho người sử dụng và hiệu quả bảo quản.

Ngoài ra, axit nitrơ còn được dùng trong sản xuất phụ gia thực phẩm. Các muối nitrit từ axit nitrơ giúp cải thiện hương vị và kéo dài thời gian bảo quản thực phẩm.
FAQ: Câu hỏi thường gặp về axit nitrơ
Axit nitrơ là một hợp chất hóa học quan trọng trong công nghiệp và phòng thí nghiệm. Tuy nhiên, việc sử dụng và bảo quản axit nitrơ cần tuân thủ các quy tắc an toàn nghiêm ngặt.
Axit nitrơ có độc không?
Axit nitrơ là một chất độc nguy hiểm có thể gây bỏng nặng khi tiếp xúc với da. Hơi axit nitrơ có thể gây kích ứng đường hô hấp và tổn thương phổi nghiêm trọng.
Trong quá trình phân hủy, axit nitrơ tạo ra khí NO2 màu nâu đỏ rất độc. Tương tự như axeton công thức, việc tiếp xúc kéo dài có thể gây tổn thương gan và thận.
Cách bảo quản axit nitrơ an toàn
Axit nitrơ cần được bảo quản trong bình thủy tinh màu tối, tránh ánh sáng trực tiếp. Nhiệt độ bảo quản tối ưu từ 15-25°C, tương tự như cách bảo quản amoni gluconat công thức.
Khi vận chuyển và lưu trữ acetaldehyde là gì, cần đặt bình chứa trong khay chống tràn và tránh xa các chất khử mạnh. Phòng bảo quản phải thông thoáng và có hệ thống hút khí độc.
Cách nhận biết axit nitrơ trong phòng thí nghiệm
Axit nitrơ có thể nhận biết qua màu xanh nhạt đặc trưng và mùi hăng cay nồng. Khi phân hủy sẽ tạo khí NO2 màu nâu đỏ, khác với axit terephtalic công thức không màu.
Phản ứng với đồng kim loại tạo khí NO2 màu nâu đỏ là phương pháp định tính đơn giản. Ngoài ra có thể dùng giấy quỳ tím để kiểm tra tính axit của dung dịch.
Kiến thức về axit nitrơ công thức giúp học sinh nắm vững cấu tạo phân tử và các tính chất đặc trưng của hợp chất quan trọng này. Các phản ứng hóa học của axit nitrơ với bazơ, muối, kim loại và oxi là nền tảng để hiểu vai trò của nó trong công nghiệp. Việc nắm chắc tính chất và ứng dụng của axit nitrơ tạo điều kiện thuận lợi cho học sinh tiếp cận các bài tập nâng cao về hóa học vô cơ.
Bài viết liên quan

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

Khái quát công thức freon và ứng dụng môi chất lạnh trong điều hòa
Tìm hiểu chi tiết về freon công thức, cấu tạo và phân loại các loại môi chất lạnh R22, R32, R410A. Khám phá ứng dụng, tác động môi trường và cách sử dụng an toàn trong điều hòa, máy lạnh.

