Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Công thức hóa học của lưu huỳnh đóng vai trò quan trọng trong ngành công nghiệp hóa chất. Nguyên tố này tồn tại dưới nhiều dạng thù hình với các tính chất đặc biệt. Lưu huỳnh tham gia vào nhiều phản ứng hóa học để tạo thành các hợp chất thiết yếu. Các hợp chất này được ứng dụng rộng rãi trong sản xuất và đời sống hàng ngày.
Công thức hóa học của lưu huỳnh và các dạng tồn tại
Lưu huỳnh là nguyên tố hóa học thuộc nhóm VIA, có công thức hóa học của lưu huỳnh là S. Trong tự nhiên, lưu huỳnh tồn tại ở dạng đơn chất và hợp chất.
Ở dạng đơn chất, công thức lưu huỳnh thường gặp là S8 – một phân tử vòng gồm 8 nguyên tử lưu huỳnh liên kết với nhau. Đây là dạng bền vững nhất của lưu huỳnh ở điều kiện thường.
Trong quá trình giảng dạy, tôi thường ví von S8 như một chiếc vòng trang sức 8 mắt xích. Điều này giúp học sinh dễ hình dung cấu trúc phân tử của nó.
Lưu huỳnh còn tồn tại ở dạng hợp chất với các công thức phổ biến:
- H2S (Hydro sulfua): Khí có mùi trứng thối
- SO2 (Lưu huỳnh đioxit): Khí không màu, mùi hắc
- SO3 (Lưu huỳnh trioxit): Chất lỏng không màu
- H2SO4 (Axit sulfuric): Axit mạnh phổ biến
Kinh nghiệm của tôi khi dạy về lưu huỳnh là luôn nhấn mạnh sự khác biệt giữa S và S8. S là ký hiệu nguyên tử, còn S8 là phân tử thực tế tồn tại trong tự nhiên.
Cấu tạo và tính chất đặc trưng của nguyên tố lưu huỳnh
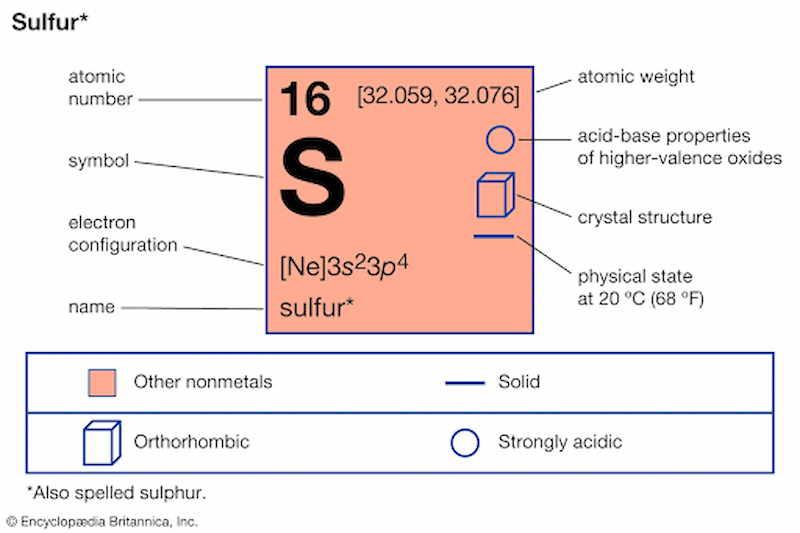
Lưu huỳnh là nguyên tố phi kim thuộc nhóm VIA, có số hiệu nguyên tử 16 và khối lượng nguyên tử 32. Nguyên tố này đóng vai trò quan trọng trong nhiều hợp chất hóa học và quá trình công nghiệp.
Tương tự như công thức hóa học của thiếc, cấu tạo lưu huỳnh có cấu hình electron đặc trưng giúp nó dễ dàng tham gia phản ứng với nhiều nguyên tố khác.
Cấu tạo nguyên tử và phân tử lưu huỳnh
Nguyên tử lưu huỳnh có cấu hình electron: 1s2 2s2 2p6 3s2 3p4. Điều đặc biệt là nó có 6 electron hóa trị ở lớp ngoài cùng.
Trong tự nhiên, phân tử lưu huỳnh tồn tại dưới dạng S8 – một vòng khép kín gồm 8 nguyên tử. Cấu trúc này tạo nên độ bền vững cao cho phân tử.
Mỗi nguyên tử lưu huỳnh trong vòng S8 liên kết với 2 nguyên tử lân cận bằng liên kết đơn, tạo thành góc liên kết xấp xỉ 105°.
Các tính chất vật lý của lưu huỳnh
Ở điều kiện thường, lưu huỳnh là chất rắn màu vàng nhạt, không mùi, không vị. Nhiệt độ nóng chảy là 119°C và nhiệt độ sôi là 444,6°C.
Lưu huỳnh không tan trong nước nhưng tan được trong một số dung môi hữu cơ như benzen và CS2. Đây là tính chất quan trọng trong quá trình tinh chế lưu huỳnh.
Khi đun nóng, lưu huỳnh chuyển từ màu vàng sang màu nâu đỏ và trở nên nhớt. Ở 200°C, nó chuyển thành chất lỏng màu đen.
Các tính chất hóa học cơ bản
Tính chất hóa học của lưu huỳnh thể hiện rõ qua khả năng phản ứng với nhiều nguyên tố khác nhau. Nó tác dụng trực tiếp với kim loại tạo thành muối sulfua.
Với phi kim như oxi, lưu huỳnh cháy tạo thành SO2 – một khí độc có mùi hắc. Phản ứng này thường xảy ra trong các nhà máy luyện kim.
Trong môi trường kiềm, lưu huỳnh tạo thành hỗn hợp muối thiosunfat và sunfit. Đây là cơ sở cho nhiều ứng dụng trong công nghiệp và y học.
Các hợp chất quan trọng của lưu huỳnh và ứng dụng
Lưu huỳnh tạo nên nhiều hợp chất có vai trò quan trọng trong công nghiệp hóa chất. Các hợp chất này được sử dụng rộng rãi làm nguyên liệu sản xuất và trong đời sống hàng ngày.
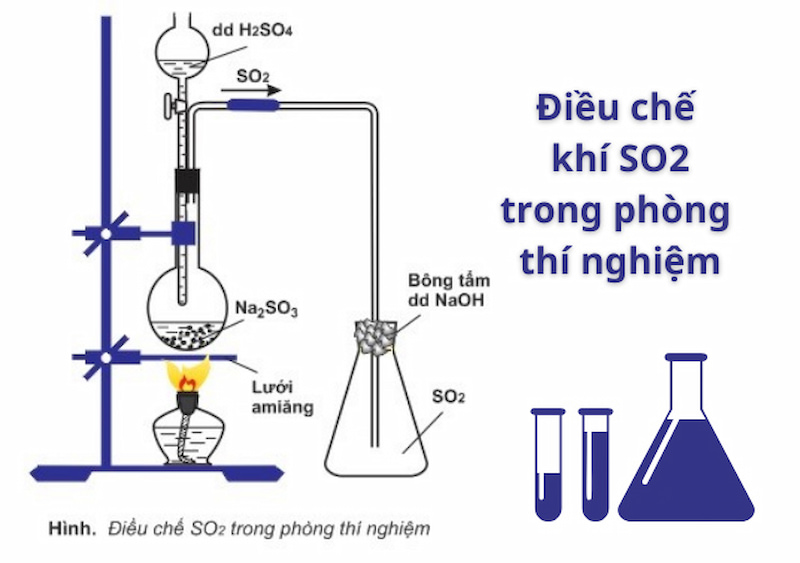
Oxit của lưu huỳnh và phương pháp điều chế
Công thức oxit lưu huỳnh phổ biến nhất là SO2 và SO3. SO2 được điều chế bằng cách đốt cháy lưu huỳnh trong không khí theo phương trình:
S + O2 → SO2
SO3 được tổng hợp từ SO2 qua phản ứng xúc tác V2O5 ở 450°C:
2SO2 + O2 → 2SO3
Trong quá trình giảng dạy, tôi thường nhắc học sinh chú ý điều kiện phản ứng tạo SO3 cần xúc tác và nhiệt độ thích hợp.
Axit sunfuric và các muối sulfat
Axit sunfuric H2SO4 là axit mạnh được sản xuất công nghiệp quy mô lớn. Quá trình sản xuất gồm 3 giai đoạn:
- Đốt S thành SO2
- Oxi hóa SO2 thành SO3
- Hấp thụ SO3 vào H2O tạo H2SO4
H2SO4 tạo ra các muối sulfat quan trọng như công thức phèn chua dùng trong xử lý nước và công nghiệp dệt nhuộm.
Ứng dụng của lưu huỳnh trong công nghiệp và đời sống
Lưu huỳnh được ứng dụng rộng rãi trong sản xuất phân bón, thuốc trừ sâu và diêm. Trong y học, lưu huỳnh là thành phần của nhiều loại thuốc điều trị bệnh ngoài da.
Các hợp chất lưu huỳnh còn được dùng trong công nghiệp sản xuất giấy, cao su và pin ắc quy. Theo thống kê của Hiệp hội Hóa chất Việt Nam, ngành công nghiệp hóa chất sử dụng khoảng 60% lượng lưu huỳnh khai thác được.
Phản ứng hóa học đặc trưng của lưu huỳnh
Lưu huỳnh là một phi kim điển hình, có khả năng phản ứng với nhiều chất khác nhau. Các phản ứng của lưu huỳnh thường xảy ra ở nhiệt độ cao và tạo thành nhiều sản phẩm khác nhau.
Tương tự như quá trình điện phân trong Công thức Faraday hóa, các phản ứng của lưu huỳnh đều tuân theo quy luật về electron và năng lượng.
Phản ứng với oxi và các phi kim

Lưu huỳnh phản ứng với oxi tạo thành khí SO2 theo phương trình:
S + O2 → SO2
Phản ứng này xảy ra mạnh khi đốt nóng lưu huỳnh trong không khí, tạo ra ngọn lửa màu xanh đặc trưng. Khí SO2 sinh ra có mùi hắc và gây kích ứng đường hô hấp.
Với các phi kim khác như clo, lưu huỳnh tạo thành S2Cl2 theo phương trình:
2S + Cl2 → S2Cl2
Phản ứng với kim loại và bazơ
Khi nhiệt độ cao, lưu huỳnh hóa học phản ứng trực tiếp với hầu hết kim loại tạo thành muối sunfua:
2Fe + 3S → Fe2S3
2Al + 3S → Al2S3
Với dung dịch bazơ, lưu huỳnh tạo thành hỗn hợp muối sunfua và sunfit:
3S + 6NaOH → 2Na2S + Na2SO3 + 3H2O
Phản ứng này thường được ứng dụng trong công nghiệp để sản xuất các muối vô cơ quan trọng.
Sự phân bố và khai thác lưu huỳnh trong tự nhiên
Lưu huỳnh trong tự nhiên tồn tại khá phổ biến ở dạng tự do hoặc hợp chất. Nó chiếm khoảng 0,05% khối lượng vỏ Trái Đất, đứng thứ 16 trong các nguyên tố phổ biến.
Các mỏ lưu huỳnh lớn thường phân bố tập trung ở vùng núi lửa hoạt động. Những khu vực này có điều kiện địa chất đặc biệt giúp tích tụ lưu huỳnh qua hàng triệu năm.
Các dạng tồn tại trong tự nhiên
Lưu huỳnh tồn tại chủ yếu ở hai dạng: nguyên tố tự do và hợp chất. Dạng tự do thường gặp là tinh thể màu vàng S8 trong các mỏ quặng.
Ở dạng hợp chất, lưu huỳnh kết hợp với các kim loại tạo thành sulfua như:
- Pyrit (FeS2): Quặng sắt phổ biến có ánh kim đặc trưng
- Galena (PbS): Quặng chì quan trọng trong công nghiệp
- Cinnabar (HgS): Quặng thủy ngân với màu đỏ đặc trưng
Phương pháp khai thác và tinh chế
Phương pháp Frasch là kỹ thuật khai thác lưu huỳnh hiệu quả nhất hiện nay. Nước nóng 165°C được bơm xuống mỏ để nóng chảy lưu huỳnh.

Hỗn hợp lưu huỳnh nóng chảy và nước được bơm lên mặt đất nhờ khí nén. Sau đó, lưu huỳnh được tách riêng và làm nguội để tạo thành khối rắn.
Quá trình tinh chế tiếp theo gồm các bước:
- Lọc tạp chất cơ học
- Chưng cất phân đoạn loại bỏ tạp chất
- Kết tinh tạo sản phẩm tinh khiết
FAQ: Câu hỏi thường gặp về lưu huỳnh
Lưu huỳnh là một phi kim điển hình thuộc nhóm VIA trong bảng tuần hoàn. Nguyên tố này có nhiều ứng dụng quan trọng trong công nghiệp và đời sống.
Lưu huỳnh có bao nhiêu hóa trị?
Lưu huỳnh hóa trị mấy là câu hỏi phổ biến của nhiều học sinh. Lưu huỳnh có thể tồn tại ở nhiều trạng thái oxi hóa khác nhau.
Trong các hợp chất, lưu huỳnh thường có các hóa trị: -2, +2, +4 và +6. Hóa trị -2 xuất hiện trong H2S và các muối sulfua.
Hóa trị +4 và +6 thường gặp trong các oxit SO2, SO3 và các muối sulfat. Đây là những hóa trị quan trọng cần nhớ.
Các dạng thù hình của lưu huỳnh
Lưu huỳnh tồn tại ở nhiều dạng thù hình khác nhau. Dạng bền nhất ở điều kiện thường là lưu huỳnh rhombic màu vàng.
Khi đun nóng trên 95,5°C, lưu huỳnh rhombic chuyển thành dạng đơn tà. Tiếp tục đun nóng sẽ tạo thành lưu huỳnh lỏng.
Công thức hóa học của lưu huỳnh ở dạng phân tử là S8 – một vòng 8 nguyên tử. Cấu trúc này tạo nên tính chất đặc trưng.
Cách nhận biết lưu huỳnh trong phòng thí nghiệm
Lưu huỳnh có thể được nhận biết qua màu sắc vàng đặc trưng và mùi đặc biệt khi cháy tạo SO2.
Phương pháp thử định tính đơn giản là đốt mẫu thử. Lưu huỳnh cháy với ngọn lửa màu xanh nhạt, tạo khí SO2 có mùi hắc.
Có thể dùng giấy quỳ tím để kiểm tra sản phẩm cháy. SO2 tạo thành làm đổi màu quỳ tím sang đỏ do tính axit.
Kiến thức về công thức hóa học của lưu huỳnh giúp các em nắm vững cấu tạo và tính chất của nguyên tố này. Lưu huỳnh tồn tại ở nhiều dạng thù hình khác nhau và tham gia vào nhiều phản ứng hóa học quan trọng. Các hợp chất của lưu huỳnh như axit sunfuric và muối sulfat có vai trò thiết yếu trong công nghiệp và đời sống. Việc tìm hiểu về lưu huỳnh là nền tảng để học tốt môn hóa học.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

Khái quát công thức freon và ứng dụng môi chất lạnh trong điều hòa
Tìm hiểu chi tiết về freon công thức, cấu tạo và phân loại các loại môi chất lạnh R22, R32, R410A. Khám phá ứng dụng, tác động môi trường và cách sử dụng an toàn trong điều hòa, máy lạnh.

