Nắm kỹ công thức hóa học của nitơ và các tính chất quan trọng
Công thức hóa học của nitơ là nền tảng để hiểu về nguyên tố quan trọng này. Nitơ tồn tại phổ biến trong không khí dưới dạng phân tử N2. Nguyên tố này tham gia vào nhiều phản ứng hóa học thiết yếu. Các hợp chất nitơ đóng vai trò then chốt trong sự sống và công nghiệp hiện đại.
Công thức hóa học của nitơ
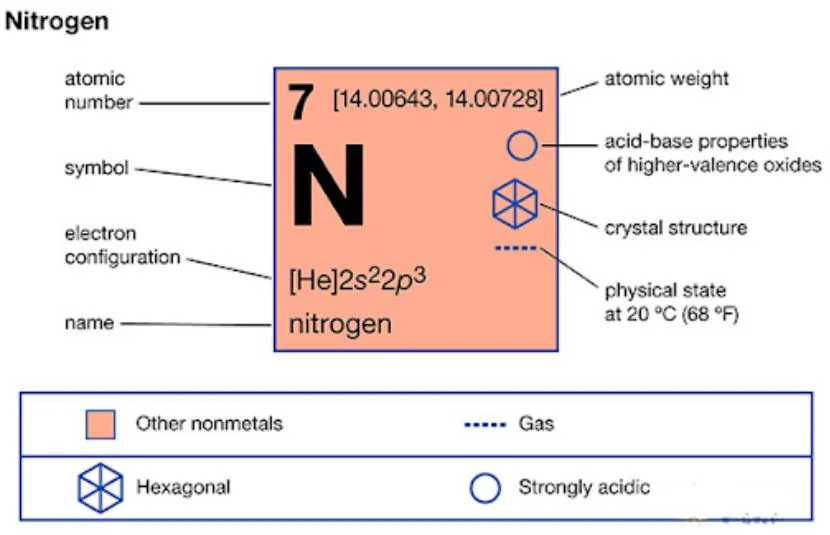
Nitơ là nguyên tố hóa học thuộc nhóm VA, có số hiệu nguyên tử 7 và khối lượng nguyên tử 14. Công thức hóa học của nitơ trong tự nhiên là N2.
Phân tử nitơ được tạo thành từ 2 nguyên tử N liên kết với nhau bằng liên kết cộng hóa trị ba rất bền vững:
N≡N
Trong đó:
- N là ký hiệu hóa học của nguyên tố nitơ
- Dấu ≡ thể hiện liên kết ba giữa 2 nguyên tử N
- Chỉ số 2 bên dưới cho biết phân tử có 2 nguyên tử N
Với cấu tạo đặc biệt này, công thức nitơ là gì và tại sao nó lại bền vững đến vậy? Đó là do 3 cặp electron được chia sẻ giữa 2 nguyên tử N tạo thành liên kết ba rất khó phá vỡ.
Trong quá trình giảng dạy, tôi thường ví von liên kết ba trong N2 như 3 sợi dây thừng chắc chắn buộc 2 nguyên tử lại với nhau. Điều này giúp học sinh dễ hình dung và nhớ lâu hơn.
Nitơ phân tử N2 chiếm tới 78% thể tích không khí, là nguồn nguyên liệu quan trọng để sản xuất phân đạm và nhiều hợp chất hữu cơ khác trong công nghiệp hóa chất.
Cấu tạo và tính chất hóa học của nguyên tố nitơ
Nitơ là nguyên tố phi kim thuộc nhóm VA, có vai trò quan trọng trong tự nhiên và đời sống. Nguyên tố này tham gia vào nhiều hợp chất hữu cơ thiết yếu như nicotine là gì và protein.
Cấu tạo nguyên tử và đồng vị của nitơ
Nitơ có cấu tạo nguyên tử gồm 7 proton, 7 neutron và 7 electron. Electron được sắp xếp theo cấu hình 1s2 2s2 2p3.
Nitơ có mấy đồng vị tự nhiên? Nitơ có 2 đồng vị bền là N-14 chiếm 99.63% và N-15 chiếm 0.37%. Các đồng vị nhân tạo như N-12, N-13 đều không bền.
Hóa trị và liên kết của nitơ
Nitơ hóa trị mấy là câu hỏi phổ biến của học sinh. Nitơ có thể thể hiện các hóa trị -3, +3 và +5.
Với cấu hình electron 2s2 2p3, nitơ có 3 electron độc thân nên dễ tạo liên kết cộng hóa trị. Trong phân tử N2, hai nguyên tử nitơ liên kết bằng 3 liên kết cộng hóa trị.
Tính chất vật lý của nitơ
Nitơ tồn tại ở dạng phân tử N2 không màu, không mùi, không vị. Nhiệt độ nóng chảy -210°C, nhiệt độ sôi -196°C.
Nitơ có độ tan thấp trong nước, nhẹ hơn không khí và chiếm khoảng 78% thể tích khí quyển.
Tính chất hóa học cơ bản của nitơ
Nitơ có tính chất gì đặc trưng? Nitơ khá trơ ở điều kiện thường do liên kết ba bền vững trong phân tử N2.
Ở nhiệt độ cao, nitơ phản ứng với kim loại kiềm, kiềm thổ tạo nitrit. Với hydro tạo amoniac NH3 là phản ứng quan trọng trong công nghiệp.
Nitơ cũng tham gia phản ứng với oxi ở nhiệt độ cao hoặc phóng điện tạo thành các oxit nitơ khác nhau.
Các dạng tồn tại và ứng dụng của nitơ trong tự nhiên
Nitơ là nguyên tố phổ biến thứ 4 trong cơ thể sống, chiếm khoảng 78% thể tích khí quyển. Nitơ có ứng dụng vô cùng đa dạng trong nhiều lĩnh vực khác nhau.
Nitơ trong không khí và chu trình nitơ
Trong khí quyển, nitơ tồn tại dưới dạng phân tử N2 với liên kết ba bền vững. Vi sinh vật cố định đạm chuyển hóa N2 thành các hợp chất nitơ.
Chu trình nitơ diễn ra qua nhiều giai đoạn: cố định nitơ, amoni hóa, nitrat hóa và phản nitrat hóa. Quá trình này đảm bảo cân bằng nitơ trong tự nhiên.
Ứng dụng của nitơ trong công nghiệp
Nitơ lỏng được sử dụng làm môi chất làm lạnh trong công nghiệp thực phẩm và bảo quản. Nhiệt độ sôi thấp (-196°C) giúp đông lạnh nhanh, giữ nguyên cấu trúc tế bào.
Trong công nghiệp hóa chất, nitơ là nguyên liệu quan trọng sản xuất phân bón Công thức hóa học của NPK, amoniac, axit nitric và nhiều hợp chất khác.
Vai trò của nitơ trong nông nghiệp
Nitơ là thành phần thiết yếu của protein, axit nucleic trong cây trồng. Thiếu nitơ, cây sinh trưởng kém, lá vàng và năng suất giảm.

Phân bón chứa công thức hóa học của nitơ dạng NH4+, NO3- giúp cung cấp đạm cho đất. Cây trồng hấp thu và chuyển hóa thành các hợp chất hữu cơ.
Nitơ trong y tế và đời sống
Nitơ lỏng được dùng trong điều trị u nhú, mụn cóc bằng phương pháp đông lạnh. Khí nitơ tinh khiết phục vụ phẫu thuật và bảo quản mẫu sinh học.
Trong công nghiệp thực phẩm, nitơ tạo môi trường yếm khí bảo quản thực phẩm. Nitơ lỏng còn được ứng dụng trong ẩm thực phân tử tạo hiệu ứng khói.
Phản ứng hóa học quan trọng của nitơ
Nitơ là nguyên tố phi kim điển hình với công thức hóa học của nitơ là N2. Phân tử nitơ có liên kết ba bền vững nên khá trơ trong điều kiện thường.
Phản ứng với oxi và hydro
Nitơ phản ứng với oxi tạo thành các oxit khác nhau tùy điều kiện:
N2 + O2 → 2NO (nhiệt độ cao)
2NO + O2 → 2NO2
Với hydro, nitơ tạo thành amoniac theo phương trình:
N2 + 3H2 ⇌ 2NH3 (xúc tác Fe, 450°C, 200atm)
Đây là phản ứng thuận nghịch quan trọng trong công nghiệp, tương tự như natri cromat là chất gì.
Phản ứng với kim loại và phi kim
Ở nhiệt độ cao, nitơ phản ứng trực tiếp với một số kim loại tạo nitrit:
3Ca + N2 → Ca3N2
2Li + N2 → 2Li3N
Với phi kim, nitơ tạo thành các hợp chất như NCl3, NF3 trong điều kiện đặc biệt.
Phản ứng tạo muối nitrat
Nitơ không trực tiếp tạo muối nitrat mà phải qua trung gian là axit nitric:
N2 → NO → NO2 → HNO3 → Muối nitrat
Muối nitrat được tạo ra khi HNO3 tác dụng với:
- Kim loại: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O
- Bazơ: NaOH + HNO3 → NaNO3 + H2O
- Oxit bazơ: CuO + 2HNO3 → Cu(NO3)2 + H2O
FAQ: Câu hỏi thường gặp về nitơ
Nitơ là một trong những nguyên tố phổ biến nhất trong tự nhiên. Tôi sẽ giải đáp những thắc mắc thường gặp về nguyên tố này.
Nitơ có độc không?
Nitơ có độc không khi ở trạng thái tự nhiên? Câu trả lời là không. Nitơ chiếm tới 78% thành phần không khí chúng ta hít thở hàng ngày.
Tuy nhiên, nitơ có thể gây nguy hiểm khi nồng độ quá cao trong không gian kín. Nó sẽ chiếm chỗ của oxy và gây ngạt thở.
Trong phòng thí nghiệm, tôi luôn nhắc học sinh phải thao tác với nitơ trong điều kiện thông thoáng.
Nitơ có màu và mùi không?
Nitơ có màu gì và nitơ có mùi không? Nitơ là chất khí không màu, không mùi, không vị ở điều kiện thường.
Đặc điểm này khiến việc phát hiện rò rỉ nitơ khá khó khăn. Vì vậy các phòng thí nghiệm cần lắp đặt thiết bị cảnh báo rò rỉ khí.
Nitơ có phải là khí hiếm không?
Nitơ có phải khí hiếm không? Không, nitơ không phải là khí hiếm. Nó thuộc nhóm VA trong bảng tuần hoàn.
Khí hiếm chỉ bao gồm 6 nguyên tố: He, Ne, Ar, Kr, Xe và Rn thuộc nhóm VIIIA. Nitơ phổ biến hơn nhiều so với các khí hiếm.
Nitơ có tan trong nước không?
Nitơ có tan trong nước không? Nitơ rất ít tan trong nước ở điều kiện thường. Độ tan của nó chỉ khoảng 20mg/L ở 20°C.
Đặc tính này khiến nitơ thường được sử dụng để đuổi không khí ra khỏi dung dịch trong phòng thí nghiệm.
Trong thực tế giảng dạy, tôi thường cho học sinh làm thí nghiệm sục khí nitơ qua nước để chứng minh tính ít tan của nó.
Kiến thức về công thức hóa học của nitơ giúp chúng ta hiểu rõ vai trò quan trọng của nguyên tố này trong tự nhiên và đời sống. Nitơ là nguyên tố thiết yếu với cấu tạo đặc biệt, tính chất đa dạng và nhiều ứng dụng trong công nghiệp, nông nghiệp và y tế. Các phản ứng hóa học của nitơ tạo nên nhiều hợp chất có giá trị và đóng vai trò then chốt trong chu trình sinh địa hóa của Trái đất.
Bài viết liên quan

Hiểu rõ axit nitrơ công thức và tính chất hóa học cơ bản
Tìm hiểu chi tiết về axit nitrơ công thức HNO2, cấu tạo phân tử và tính chất hóa học. Khám phá các phản ứng với bazơ, muối, kim loại cùng ứng dụng trong công nghiệp.

Hiểu sâu nước brom công thức và ứng dụng trong thí nghiệm hóa học
Tìm hiểu chi tiết về nước brom công thức, cấu tạo phân tử và tính chất đặc trưng. Hướng dẫn điều chế, phản ứng hóa học quan trọng cùng các biện pháp an toàn khi sử dụng trong phòng thí nghiệm.

Tổng quan natri carbonat công thức và ứng dụng trong đời sống
Tìm hiểu chi tiết về natri carbonat công thức Na2CO3, cấu tạo phân tử, tính chất hóa học đặc trưng và quy trình sản xuất trong công nghiệp. Khám phá ứng dụng thực tiễn của muối cacbonat.

Học thuộc công thức hóa học của lưu huỳnh và các hợp chất quan trọng
Tìm hiểu chi tiết công thức hóa học của lưu huỳnh, cấu tạo phân tử và các dạng tồn tại. Khám phá tính chất, phản ứng đặc trưng cùng ứng dụng quan trọng của nguyên tố này trong đời sống.

Điểm qua oleum công thức và cách tính nồng độ trong hóa học
Tìm hiểu chi tiết về oleum công thức, cấu tạo và tính chất hóa học. Hướng dẫn cách tính nồng độ, pha chế an toàn kèm bài tập có lời giải chi tiết cho học sinh phổ thông.

Tìm hiểu công thức DAP và cách sử dụng phân bón DAP hiệu quả cho cây trồng
Tìm hiểu công thức DAP và hướng dẫn chi tiết về cách pha, tỉ lệ bón phân DAP cho từng loại cây trồng. Giải thích thành phần hóa học và kỹ thuật sử dụng phân bón DAP hiệu quả.

